- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Chromatografia wykorzystująca hydrofobowe właściwości cząsteczek: chromatografia fazy odwróconej cz. I
 W chromatografii fazy odwróconej podstawą jest oddziaływanie hydrofobowych obszarów cząsteczek białkowych oraz ligandu, które trwale są umocowane na powierzchni odpowiedniego nośnika. Hydrofobowe ligandy stosowane w technice RPC są znacznie gęściej rozmieszczone na powierzchni nośnika, niż w złożach do chromatografii oddziaływań hydrofobowych (HIC) [1], [12].
W chromatografii fazy odwróconej podstawą jest oddziaływanie hydrofobowych obszarów cząsteczek białkowych oraz ligandu, które trwale są umocowane na powierzchni odpowiedniego nośnika. Hydrofobowe ligandy stosowane w technice RPC są znacznie gęściej rozmieszczone na powierzchni nośnika, niż w złożach do chromatografii oddziaływań hydrofobowych (HIC) [1], [12].W technice RPC zazwyczaj wykorzystuje się ligandy alkilowe, których łańcuchy zbudowane są z 4 do 18 atomów węgla (C4 – C18). W konsekwencji zastosowania właśnie takich ligandów dochodzi do bardzo silnego i wielopunktowego wiązania białek. Do elucji białek wymagane jest zastosowanie niepolarnych rozpuszczalników, co niestety może być przyczyną zajścia nieodwracalnych zmian aktywności biologicznej dużych cząsteczek białkowych. Tak więc, chromatografia fazy odwróconej ma ograniczone zastosowanie, a mianowicie nie używa się jej do preparatywnej chromatografii enzymów i receptorów białkowych, z kolei metoda ta znalazła bardzo szerokie zastosowanie praktyczne w przypadku małocząsteczkowych związków organicznych (zarówno w skali analitycznej jak i w preparatywnej), [1], [12].
Złoża do chromatografii fazy odwróconej
Technika izokratyczna polega na dostarczaniu przez system pomp solwentu, który nie ulega zmianie w czasie rozdziału. W technice gradientowej skład solwentu ulega zmianie w trakcie trwania rozdziału, przy czym każda zmiana jest bardzo dokładnie kontrolowana. W zależności od zastosowanej techniki (gradientowej czy izokratycznej) otrzymuje się różne wyniki separacji makromolekuł, na co wpływ mają odmienne procesy zachodzące w obrębie kolumny chromatograficznej w trakcie rozdziału. Metodę gradientową można podzielić na dwa etapy:
- w pierwszym zachodzi sorpcja makromolekuł na hydrofobowym ligandzie, a warunki sorpcji dobierane są w taki sposób, by zapewnić najlepszą ekspozycję hydrofobowych obszarów na powierzchni separowanych makromolekuł. W przypadku białek kolumna zazwyczaj zrównoważona jest za pomocą zakwaszonej wody. W dalszym etapie przemywa się kolumnę za pomocą solwentu startowego (co ma na celu usunięcie nieswoiście zaadsorbowanych cząsteczek).
- w drugim etapie metody, system pomp dostarcza eluent charakteryzujący sie narastającym stężeniem niepolarnego rozpuszczalnika organicznego. W tym celu można zastować m.in. : metanolu lub acetonitryl. Na tym etapie, faza ruchoma staje się bardziej atrakcyjnym srodowiskiem dla zaadsorbowanych na unieruchomionym ligandzie cząsteczek – dochodzi do zmiany preferowanej przez separowane cząsteczki fazy : z fazy nieruchomej na ruchomą. To właśnie ten proces określono : „odwracaniem faz” [12].
Gdy znamy stężenie niepolarnego solwentu możemy tak ustawić program chromatografii, by w możliwie krótkim czasie uzyskać stężenie będące nieco poniżej stężenia niezbędnego do elucji, a w dalszym etapie procesu bardzo powoli dochodzić do warunków wymywania danej cząsteczki z kolumny [12].
- w technice gradientowej nie ma ograniczeń co do objętości próbki nanoszonej na kolumnę, a także co do stopnia rozcieńczeń danej próbki
- możliwość znacznego skrócenia czasu rozdziału (praca w technice izokratycznej)
- technika chromatografii fazy odwróconej pozwala na odsalanie i zatężanie próbki
- technika charakteryzuje się wysoką rozdzielczością i selektywnością [2].
Wady RPC:
- stosowanie bardzo kosztownych solwentów charakteryzujących się najwyższą czystością
- niektóre stosowane solwenty moga degradować biomolekuły
- ograniczony wybór solwentów [2].
Rozdział chromatograficzny krótkich peptydów (wyodrębnianych z hydrolizatu fibrynogenu) [3], [12].
Zasada metody:
- w pierwszym etapie za pomocą filtracji żelowej oddziela się małe peptydy od tych większych (fragmentów łańcuchów polipeptydowych trawionego białka).
- w drugim etapie za pomocą chromatografii fazy odwróconej możliwe jest frakcjonowanie peptydów wykorzystując w tym celu różnicę ich hydrofobowości [3], [12].
Wykonanie:
Wszystkie bufory i próbki stosowane w chromatografii HPLC muszą być filtrowane (filtry o porowatości od 0,45 do 0,6 µm) [3].
Trawienie fibrynogenu:
Filtracja żelowa hydrolizatu fibrynogenu:
Rozdział chromatograficzny peptydów
Oznaczanie leków w płynach fizjologicznych- metody analityczne [4], [12].
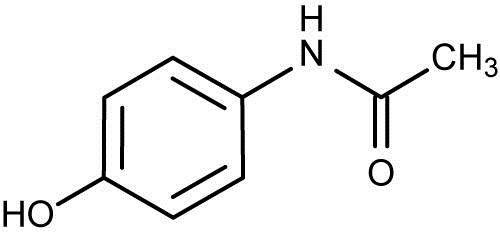
NAPQI ulega detoksykacji poprzez nieenzymatyczną reakcj z grupami sulfhydrolowymi glutationu lub też z innymi związkami, które zawierają grupę tiolową (N-acetylocysteina), z ostatecznym wytworzeniem sprzężenia z kwasem merkapturowym. Powstałe w ten sposób nieaktywne i nietoksyczne metabolity są wydalane przez nerki [6], [7]. Wyczerpanie komórkowych rezerw glutationu i kumulacja NAPQI prowadzi do całkowitego zniszczenia wątroby i śmierci [8]. U niemowląt paracetamol jest metabolizowany głównie do siarczanów, z kolei u osób dorosłych paracetamol jest przede wszystkim sprzęgany z kwasem glukuronowym.
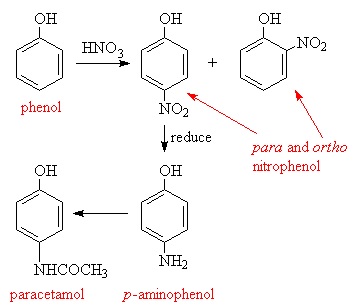
Paracetamol wchłaniany jest drogą jelitową,a następnie metabolizowany w wątrobie. W przypadku, gdy stężenie paracetamolu w osoczu przekroczy 2 mM dochodzi do poważnego uszkodzenia wątroby [12].
Teofilina
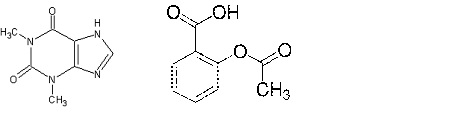
Zdjęcie: Teofilina–wzór(lewa strona) i kwas salicylowy –wzór (prawa strona) http://www.farmakognozja.farmacja.pl/alkaloid/index.php?alka=teofil, http://www.sigmaaldrich.com/catalog/product/sigma/a5376?lang=pl®ion=PL
[2]. http://www.biofizyka.p.lodz.pl/ch7.pdf
[3]. Cierniewski C.S., Budzyński Z., 1993. Localization of the cross-linking site of GPRVVERHK in the ɣ-chain of human fibrinogen. Eur. J. Biochem., 218: 321 – 325
[4]. Wallinder H. High performance reversed phase chromatography in clinical chemistry: Separation of paracetamol, theophylline and salicylate in serum. Liquid chromatography. Application Note 368, LKB Bromma, Sweden.
[5].History of Tylenol (ang.). [dostęp 17 grudnia 2012].; http://www.nancywest.net/pdfs/McNeilConsumerHealthcareCompany.pdf
[6]. K.D. Rainsford: AspirinandRelatedDrugs. CRCPress, 2004.
[7]. Nonsteroidal Anti-inflammatory Drugs. W: William O. Foye, Thomas L. Lemke, David A. Williams: Principles of Medicinal Chemistry. Williams & Wilkins; 4th edition, 1995, s. 544–545. ISBN 0-683-03323-9.
[8].Grieb P., Prof. Dr. Hab. WPŁYW LEKÓW NA PROCESY WOLNORODNIKOWE W ORGANIZMIE. „FARMACJA POLSKA Czasopismo Polskiego Towarzystwa Farmaceutycznego”. Tom LVII, s. 01–15.08., 2001.
[9].Toxic responses of the liver. W: M Treinen-Moslen: Casarett and Doull's Toxicology. The basic science of poisons. Sixth Edition. McGraw-Hill Medical Publishing Division, 2001. ISBN 0-07-134721-6.
[10]. http://www.farmakognozja.farmacja.pl/alkaloid/index.php?alka=teofil
[11]. Andrew T. Chan, MD, MPH; JoAnn E. Manson, MD, DrPH; Diane Feskanich, ScD; Meir J. Stampfer, MD, DrPH; Graham A. Colditz, MD, DrPH; Charles S. Fuchs, MD, MPH. Long-term Aspirin Use and Mortality in Women. Arch Intern Med. 2007;167(6):562-572. doi:10.1001/archinte.167.6.562, http://archinte.jamanetwork.com/article.aspx?articleid=412018
[12]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 172 - 176
Tagi: chromatografia, faza odwrócona, RPC, teofilina, paracetamol, fibrynogen, rozdział, acetylosalicylany, lab, laboratorium
wstecz Podziel się ze znajomymi











Recenzje