WstępAtrakcyjność preparatów enzymatycznych związana jest z ich szerokim zastosowaniem praktycznie w każdej gałęzi przemysłu spożywczego. Ułatwiają one otrzymanie pożądanych zmian surowca, poprawę jakości produktu gotowego oraz zmniejszenie kosztów produkcji. Na skalę przemysłową otrzymuje się enzymy, wykorzystując do tego celu mikroorganizmy. Procesy biosyntezy ulegają stałemu rozwojowi spowodowanemu głównie nowymi możliwościami wykorzystania inżynierii genetycznej do modyfikacji organizmów oraz nowych rozwiązań konstrukcyjnych bioreaktorów. Dzięki inżynierii genetycznej możemy otrzymać obecnie preparaty o wybranej ściśle określonej specyficzności, a dzięki temu o nowych właściwościach i zastosowaniach w przemyśle. Mimo to, organizmy genetycznie zmodyfikowane cechuje duża zmienność i niska stabilność w procesach technologicznych. Dlatego też w dalszym ciągu prowadzone są doświadczenia na szczepach pochodzących ze środowiska naturalnego, których genom nie został wcześniej zmodyfikowany na drodze inżynierii genetycznej. Jedną z najstarszych i najbardziej rozpowszechnionych grup enzymów są enzymy amylolityczne [10].
Preparaty enzymów amylolitycznychAmylazami nazywa się wiele enzymów używanych do hydrolizy skrobi na cukry prostsze.
Od dawna amylazy pochodzenia roślinnego były używane w przemyśle spożywczym, a zwłaszcza w przemyśle piwowarskim i spirytusowym. Obecnie w przemyśle spożywczym są najpowszechniej stosowane są amylazy otrzymywane przy użyciu drobnoustrojów [8].
Do grupy amylaz należą m. in. [4]
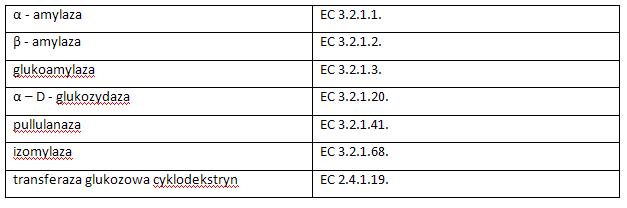
Do amylaz rozszczepiających wiązania α – 1,4 – glikozydowe skrobi należy: α – amylaza, β – amylaza, egzo – α – amylazy. Wiązania α – 1,6 – glikozydowe rozszczepia izoamylaza i pullulanaza. Glukoamylaza i niektóre pullulanazy mogą rozszczepiać wiązania α – 1,4 – i 1,6 – glikozydowe. Biorąc pod uwagę położenie rozszczepianego wiązania w łańcuchu skrobi, rozróżniamy endoamylazy, np. α – amylazy, amylazy znoszące rozgałęzienia cyklodektrynazy oraz egzoamylazy, tj. glukoamylazy, β – amylazy, egzo - α – amylazy [4], [2]. Biorąc pod uwagę technologiczny punkt widzenia wyróżniamy amylazy upłynniające - α – amylazy, pullulanazy, cyklodekstrynazy oraz scukrzające – niektóre α – amylazy, β – amylazy, glukoamylazy. Badania nad enzymatyczną degradacją skrobi są prowadzone od dawna. W przemyśle skrobiowym można stosować rożne enzymy lub ich mieszaniny, co umożliwia uzyskanie różnych produktów spełniających określone wymagania odbiorców. Końcowe produkty hydrolizy skrobi są różne i zależne od użytego enzymu.Podatność skrobi na działanie enzymów amylolitycznych zależy od jej pochodzenia. Zaobserwowano, że skrobia kukurydziana i sojowa ulega hydrolizie szybciej od skrobi ziemniaczanej. Enzymy amylolityczne dzięki swoim właściwościom znajdują powszechne zastosowanie m. in. w przemyśle piwowarskim, w procesie zacierania słodu do upłynniania i scukrzania skrobi, w celu przygotowania jej do fermentacji przez drożdże. Dzięki za zastosowaniu enzymów amylolitycznych można obniżyć temperaturę kiełkowania skrobi z ok. 75 - 80°C do temperatury maksymalnie 70°C. Scukrzanie skrobi następuje w wyniku współdziałania „cukrującej” β – amylazy i „dekstrującej” α – amylazy, na co zdecydowany wpływ ma temperatura i pH środowiska [4] .Należy pamiętać, że na końcowy efekt działania enzymów ma wpływ wiele czynników technologicznych, w tym ogromne znaczenie mają temperatura i pH [7].
Preparaty amylolityczne pochodzenia mikrobiologicznego nabierają szczególnego znaczenia w tym przemyśle w związku ze stosowaniem do otrzymywania brzeczek z niesłodowanych surowców (śruty jęczmiennej, ryżowej czy kukurydzianej, pszennej), w których proporcje związków białkowych do skrobi są inne niż w słodzie jęczmiennym. Amylazy pochodzenia mikrobiologicznego znajdują zastosowanie w gorzelnictwie rolniczym przy scukrzaniu skrobi ziemniaczanej lub zbożowej, umożliwiają częściowe lub całkowite wyeliminowanie słodu, co skutkuje znacznymi efektami ekonomicznymi. Zastosowanie amylazy pochodzenia pleśniowego umożliwia zastąpienie słodu o 50 – 60%, natomiast użycie termostabilnej, bakteryjnej α – amylazy oraz amyloglukozydazy (glukoamylazy) pochodzenia grzybowego pozwala na całkowicie wyeliminowanie słodu. Dawka enzymów w przeliczeniu na skrobię wynosi 0,1 – 0,5% α – amylazy i 0,15 – 0 4% amyloglukozydazy [4].
Zastosowanie preparatów amylolitycznych w piekarnictwie powoduje zwiększenie puli cukrów fermentowanych wykorzystywanych przez drożdże, co z kolei zwiększa pulchność ciasta [8].
Enzymy amylolityczne stosuje się także w:
• przemyśle zbożowym – do produkcji dekstryn, krystalicznej glukozy, tzw. syropu zbożowego,
• cukiernictwie – do odzyskiwania cukru z odpadów cukierniczych,
• przemyśle ziemniaczano – krochmalniczym – do produkcji różnych preparatów: środków zagęszczających, dodatków do sosów, budyni, składników odżywek dla dzieci, do produkcji dekstryn i amylozy służącej jako materiał do opakowań środków spożywczych. Preparaty stosuje się często przy produkcji glukozy i syropów dla przemysłu cukierniczego (do produkcji cukierków i chałwy), owocowo – warzywnego (do produkcji dżemów i marmolad), a także jako środek słodzący w przemyśle piekarniczym i piwowarskim.
W zakładach wytwórczych glukozy na całym świecie daje się zauważyć tendencję do coraz częstszego stosowania kwasowo – enzymatycznych i enzymatycznych metod hydrolizy skrobi zamiast hydrolizy kwasowej.
Enzym α – amylaza hydrolizuje wiązania α – 1,4 – glikozydowi wewnątrz łańcucha cząsteczki skrobi, co zmniejsza lepkość roztworu.
Stosuje się go w pierwszym etapie przetwarzania skrobi, powodując jej szybkie upłynnienie. Produktami końcowymi hydrolizy skrobi, w zależności od pochodzenia enzymu, może być maltoza i niewielkie ilości dekstryn granicznych.
Przy użyciu Aspergillus oryzae, otrzymana α – amylaza w hodowli powierzchniowej, była pierwszym enzymem produkowanym na skalę przemysłową.
Aspergillus oryzae jest grzybem używanym najczęściej w badaniach nad optymalizacją biosyntezy α – amylazy, co umożliwia opracowanie warunków jej przemysłowego otrzymywania podczas hodowli wgłębnej.
W zależności od drobnoustroju użytego do produkcji α – amylazy, otrzymane enzymy różnią się miejscem hydrolizowanego wiązania α – 1,4 – glikozydowego w skrobi oraz optymalnymi warunkami hydrolizy, tj. optymalną temperaturą i kwasowością. Tym samym końcowe produkty hydrolizy skrobi mogą być różne, zależnie od pochodzenia α – amylazy. Enzym ten, syntetyzowany przez bakterie, może upłynniać lub upłynniać i scukrzać skrobię.
W wyniku działania enzymu upłynniającego ze skrobi otrzymujemy syrop o DE 30 (równoważnik dekstrozowy, tj. liczba cukrów redukujących przypadająca na jednostkę suchej substancji produktu), zawierający glukozę, maltozę, maltotriozy, znaczne ilości oligosacharydów zawierających 6 reszt glukozowych oraz dekstryny graniczne.
W wyniku działania enzymów scukrzających na skrobię otrzymuje się cząsteczki zawierające 1 - 6 reszt glukozowych oraz α – dekstryny graniczne. W następstwie hydrolizy skrobi otrzymuje się syrop o DE 50.
Dzięki α – amylazom syntetyzowanym przez grzyby skrobi można uzyskać syrop o DE 30 – 80, zawierający glukozę, maltozę, oligosacharydy zawierające 3 – 6 reszt glukozy oraz α – dekstryny graniczne [4].
Należy podkreślić , że α – amylazy grzybowe, w przeciwieństwie do α – amylazy bakteryjnej, wykazują większą aktywność w środowisku o niższej temperaturze i wyższym pH. Używając wyselekcjonowanego szczepu szczepu Bacillus licheniformis, otrzymano termostabilną α – amylazę o optymalnej temperaturze hydrolizy skrobi 95°C; przez krótki czas jest ona nawet aktywna w temp. 105 - 110°[8].
Preparaty enzymów proteolitycznychZ punktu widzenia handlowego najważniejszą grupę enzymów stanowią enzymy proteolityczne (proteazy) [14]. Głównie wynika to ze stosowania proteaz do produkcji detergentów (proszki do prania), niemniej należy też podkreślić ich ważną rolę w przetwórstwie żywności [5]. Obejmują one białka enzymatyczne, wśród których można wyróżnić cztery grupy różniące się budową centrum aktywnego. Jedną z grup tych enzymów są proteazy serynowe, głownie pochodzenia bakteryjnego. Należy tu m. in. subtilizyna. Proteazy serynowe działają w środowisku zasadowym i wykorzystuje się je do obróbki skór rzeźnych oraz do usuwania sierści. Inną grupę enzymów proteolitycznych stanowią proteazy cysteinowe, których najbardziej znanym przedstawicielem jest roślinny enzym papaina. Działa ona w środowisku obojętnym i jest szeroko wykorzystywana w browarnictwie do klarowania piwa oraz do tenderyzacji (zwiększania kruchości) mięsa.
W przemyśle spożywczym duże zastosowanie znalazły proteazy asparaginowe, produkowane głównie przez pleśnie z gatunków Mucor miehi i M. pusillus. Ich optimum pH wynosi 4 – 4,5 [5], [14]. Najważniejszym enzymem z tej grupy jest podpuszczka stosowana w przemyśle serowarskim do koagulacji białek mleka. Tradycyjnie enzym ten był otrzymywany z treści żołądków cieląt. Kwaśne proteazy pleśniowe, podobnie jak cielęca renina, nie hydrolizują kazeiny, tylko powodują jej ścinanie w drodze koagulacji. Należy jednak zwrócić uwagę na fakt, że od preparatów kwaśnych proteaz wymagana jest wysoka czystość, jakiekolwiek bowiem zanieczyszczenia innymi protezami i lipazami mogą prowadzić do rozkładu kazeiny oraz powstania gorzkiego smaku. Kwaśne proteazy wytwarzane przez grzyby z rodzaju Mucor stosuje się głównie do wyrobu serów typu cheddar. W latach dziewięćdziesiątych XX wieku skonstruowano rekombinowane genetycznie drożdże i bakterie, zdolne do syntezy proteaz podpuszczkowych znanych pod nazwą chymozyny. Enzymy te są obecnie szeroko stosowane w przemyśle serowarskim.
Proteaz pleśniowych używa się także w piekarnictwie do poprawiania tekstury ciasta, skrócenia czasu jego miesienia i zwiększania objętości pieczywa. Enzymy te są również dodawane do piwa w celu zwiększenia jego klarowności i polepszenia warunków filtracji. W przemyśle mleczarskim proteazy pleśniowe są wykorzystywane do stabilizacji zagęszczanego mleka i produkcji hydrolizatów białkowych.
Należy dodać, że jedynym enzymem proteolitycznym pochodzenia zwierzęcego, oprócz podpuszczki, który ma zastosowanie przemysłowe i dla którego optimum pH wynosi 1,8 – 2,5, jest pepsyna pozyskiwana z błony śluzowej żołądków kurcząt rzeźnych [5].
Udokumentowanie wiodącej roli enzymów endogennych w procesie dojrzewania ryb solonych i marynat rybnych nasunęło wniosek wykorzystania preparatów proteolitycznych dla stymulacji tego procesu. W latach siedemdziesiątych i osiemdziesiątych prowadzono bardzo intensywne badania w tym zakresie w wielu krajach, szczególnie w Holandii, W. Brytanii, Norwegii, ZSRR i w Polsce. Uzyskano kilkadziesiąt różnego rodzaju patentów i otrzymane wyniki wydawały się początkowo bardzo obiecujące, przynajmniej w skali laboratoryjnej i ćwierćtechnicznej. Dotyczyły one głównie zastosowania: wysuszonych i częściowo oczyszczonych wyrostków pylorycznych z ryb, mieszanki enzymów wyizolowanych z solanek rybnych, dodawania preparatów proteolitycznych pochodzenia zwierzęcego (głównie trypsyna), roślinnego (papaina, bromelaina, ficyna) lub mikrobiologicznego (głównie ze szczepów Aspergillus i Bacillus). W Polsce do produkcji enzymatycznie solonych ryb został dopuszczony preparat proteolityczny typu Proteopol BP-S (Pektowin, Jasło), otrzymywany w procesie biosyntezy z wykorzystaniem szczepu bakterii Bacillus subtilis, na bazie naturalnych podłoży pochodzenia roślinnego. Enzymy zawarte w preparacie hydrolizują białka do polipeptydów, peptydów i aminokwasów w środowisku o odczynie zbliżonym do obojętnego (pH 6-8). Preparat ten, jak również inne enzymy, był przedmiotem naszych badań podczas dojrzewania ryb solonych. Odnotowano, że enzymy te są bardzo efektywne, lecz ich działanie ogranicza się głównie do powierzchniowych warstw mięsa, które po pewnym czasie staje się papkowate, podczas gdy zmiękczenie tkanki wewnątrz fileta lub tuszy jest niedostateczne. Wiąże się to z utrudnioną dyfuzją enzymów jako makromolekuł w głąb mięsa. Przy nastrzykiwaniu filetów solanką z dodatkiem enzymu wyniki są korzystniejsze. Jednak żaden z dotychczas przebadanych preparatów enzymatycznych nie gwarantował uzyskania typowego, w pełni dojrzałego produktu solonego, tak pod względem smakowo-zapachowym jak i tekstury. Zauważono również, że proteazy pochodzenia roślinnego (np. papaina) są zbyt aktywne i powodują szybkie upłynnianie mięsa oraz, że obecność domieszki lipaz w preparacie proteolitycznym pogarsza jego przydatność technologiczną. Stosowanie odpowiednio oczyszczonych enzymów łączy się ze sprawą kosztów i obowiązkiem ich inaktywacji w gotowym produkcie [11]
Preparaty enzymów pektynolitycznych i celulolitycznychJuż w latach 30. XX wieku do produkcji soku owocowego stosowano pektynazy. Ich użycie ograniczało się początkowo do obróbki miazgi i soku podczas przerobu owoców jagodowych i do depektynizacji soku z owoców ziarnkowych. Operacje te stworzyły możliwość oferowania konsumentom klarownych, stabilnych soków owocowych.
Jednym z ważniejszych kierunków zastosowania tych preparatów enzymatycznych jest maceracja miazgi owoców i warzyw. Proces ten ułatwia tłoczenie i przyczynia się do zwiększenia uzysku soku. Preparaty używane do maceracji miazgi stanowią kompozycję enzymów pektynolitycznych, hemiceluloz i celulaz. Działanie enzymów hemicelulolitycznych, oprócz wspomagania procesu tłoczenia, zapobiega występowaniu wtórnych zmętnień w soku, spowodowanych nadmierną ilością rozpuszczalnej hemicelulozy w soku. Odpowiednio dobrany, do konkretnych surowców preparat enzymatyczny, ułatwia również dalszą obróbkę soku, tj. depektynizację, klarowanie i filtrację [9].
Preparaty enzymów lipolitycznychW produkcji żywności coraz częściej sięga się po enzymy lipolityczne (lipazy). Należą one do esteraz rozkładających triglicerydy wyższych kwasów tłuszczowych. Ponieważ lipidy nie rozpuszczają się w wodzie reakcja lipaz zachodzi na granicy fazy wodnej, w której rozpuszczone są enzymy, oraz fazy stałej (produkt zawierający tłuszcze) [5], [12], [3]. Do produkcji lipaz wykorzystuje się głównie grzyby strzępkowe z rodzaju Rhizopus, Aspergillus i Mucor.
Dotychczas lipazy były wykorzystywane głównie w serowarstwie do przyspieszania dojrzewania i poprawiania aromatu serów. Ostatnio rośnie jednak zainteresowanie ich stosowaniem do regulowania składu kwasów tłuszczowych w triglicerydach, co ma znaczenie w kształtowaniu wartości odżywczej margaryn.
Zastosowanie innych enzymów jest znacznie mniejsze i ogranicza się do specjalnych celów. Spośród enzymów z grupy oksydaz w produkcji żywności stosuje się oksydazę glukozową do usuwania glukozy lub tlenu z produktów spożywczych (masa jajowa, piwo, soki cytrusowe) lub dla zapobieżenia utlenianiu lipidów (np. majonez). Pewne zastosowanie znalazła także katalaza, która chroni produkty spożywcze przed szkodliwym działaniem nadtlenku wodoru (mleko, susze). Innym przykładem zastosowania enzymów oksydacyjnych jest lipooksydaza sojowa stosowana do zapobiegania ciemnieniu mąki pszennej [5].
Dzięki postępom enzymologii jest możliwe wytwarzanie fruktozylotransferaz o dużej aktywności w postaci immobilizowanej i preparatów ciekłych do stosowania w procesach biokonwersji sacharozy [6].
Z kolei zastosowanie powszechnie znanej reakcji hydrolizy laktozy w przemyśle mleczarskim może wspomagać przetwórstwo mleka i produktów ubocznych w celu: usunięcia laktozy z mleka, kontroli krystalizacji laktozy w koncentratach mleczarskich, pełnego wykorzystania serwatki i jej permeatu, produkcji karmy dla zwierząt, syntezy oligosacharydów i egzopolisacharydów, intensyfikacji syntezy kultur starterowych, poprawy i zwiększenia syntezy związków smakowo-zapachowych, otrzymania nowych, modyfikowanych produktów, np. serów serwatkowych, serów o nowych cechach smakowozapachowych, produktów do smarowania pieczywa.
Obecnie duże zainteresowanie towarzyszy zastosowaniu laktozy jako substratu w reakcjach enzymatycznej syntezy prebiotycznych galaktooligosacharydów. Kataliza reakcji transgalaktozylacji prowadzona jest z udziałem enzymów o różnym stopniu oczyszczenia oraz katalizatorów niewydzielonych ze struktur komórkowych (całokomórkowe, ang. whole-cell system) [1].
PodsumowanieStosowanie preparatów enzymatycznych w praktyce jest szerokie, gdyż obejmuje prawie wszystkie gałęzie przemysłu spożywczego. Najważniejsze korzyści płynące z zastosowania enzymów to: przyspieszenie procesów technologicznych, możliwość uruchomienia produkcji nowych asortymentów żywności (w tym żywności funkcjonalnej), podniesienie jakości i atrakcyjności oraz wydłużenie trwałości produktów żywnościowych, możliwość zwiększenia wydajności tradycyjnie stosowanych surowców i zmniejszenie kosztów produkcji [13].
Autor: Emilia Cielecka Literatura:1. Adamczak M., Bednarski W. Enzymatyczna synteza galaktiooligosacharydów i laktulozy w permeacie po ultrafiltracji serwatki. ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2008, 6 (61): 105 – 117
2. Aiyer P. V., Amylases and their applications. African Journal of Biotechnology Vol. 4 (13), 2005: 1525 – 1529
3. Aravindan R., Anbumathi P., Viruthagiri T.Lipase Application in Food Industry. Indian Journal of Biotechnology. Vol.6,(4), 2007: 141 – 158
4. Bednarski W., Reps A. Biotechnologia żywności. Wydawnictwa Naukowo – Techniczne. Warszawa, 2003: 298 - 315
5. Gawęcki J., Mossor – Pietraszewska T. red. Kompendium wiedzy o żywności, żywieniu i zdrowiu. Wydawnictwo Naukowe PWN. Warszawa, 2004: 85 - 126
6. Król B., Klewicki R. Wytwarzanie koncentratów fruktooligosacharydów (FOS) o zróżnicowanym składzie oligomerycznym z wykorzystaniem enzymatycznej biokonwersji sacharozy. ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2005, 2 (43): 5 – 22
7. Krzyżaniak W., Olesienkiewicz A., Białas W., i in. Charakterystyka chemiczna maltodekdtryn o malym równoważniku glukozowym otrzymywanych przez hydrolizę skrobi ziemniaczanej za pomocą alfa –amylaz. Technologia Alimentaria 2 (2), 2003: 5 -15
8. Monteiro de Souza P., Magalhães P. Application of Microbial α – Amylase in Industry – A Review. Brazilian Journal of Microbiology (2010) 41: 850 – 861
9. Nowak D. Enzymy jako nowoczesne narzędzie technologiczne. Agro Przemysł 2/2008: 28 - 30
10. Nowak D., Nowak A. Kinetyka wzrostu biomasy oraz biosyntezy enzymów amylolitycznych przez drożdże Saccharomycopsis Fibuligera podczas hodowli w bioreaktorze. ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2009, 1 (62): 28 – 36
11. Prof. dr hab. Edward Kołakowski Katedra Technologii Żywności, Prof. dr hab. Anna Kołakowska Katedra Towaroznawstwa i Oceny Jakości. Postępy w technologii solenia i marynowania ryb. Wydział Nauk o Żywności i Rybactwa Akademia Rolnicza w Szczecinie: 22 - 23
12. Rajendran A., Palanisamy A., Thangavelu V. Lipase Catalyzed Ester Synthesis for Food Procesing Industries. Brazilian Archieves Biology and Technology. An International Journal. Vol. 52 (1): 207 – 219
13. Samborska K. Suszenie rozpyłowe enzymów – przyczyny inaktywacji oraz metody i mechanizmy ich stabilizacji. ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2010, 6 (73): 7 – 17
14. Sumantha A., Larroche Ch., Pandey A. Microbiology and Industrial Biotechnology of Food – Grade Proteases: A Perspective. Food Technol. Biotechnol. 44 (2), 2006: 211 – 220


 Streszczenie
Streszczenie
Recenzje