- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Możliwości wykorzystania kolumnowej chromatografii cieczowej
Chromatografia cieczowa to ogólna nazwa rozdziału składników mieszaniny, zachodzącego w układzie dwóch niemieszających się faz, z których jedna (gazowa lub ciekła), nazywana fazą ruchomą, porusza się względem drugiej (ciekłej lub stałej), nazywanej fazą stacjonarną. Chromatograficzne rozdziały analityczne i preparatywne różnią się skalą oraz zakresem zastosowań w laboratoriach analitycznych i w różnych działach przemysłu chemicznego, farmaceutycznego, czy spożywczego [8].
Słowa kluczowe: chromatografia, chromatografia cieczowa, chromatografia żelowa, chromatografia jonowymienna, chromatografia powinowactwa, chromatografia hydrofobowa, HPLC
 Wstęp
WstępTwórcą chromatografii jest Rosjanin Michaił S. Cwiet (1872 – 1919), który opracował ją i ogłosił w 1903 r. w Warszawie. Na swój pomysł wpadł w czasie prób nad sposobem rozdzielania barwników – głównie chlorofilów, zawartych w zielonych liściach. Wyizolowywał barwniki ze sproszkowanych liści, wymywając je eterem naftowym. Swoją metodę nazwał chromatografią, od greckiego chroma – barwa, grapho – maluję, piszę, a słupek z adsorbentem i z rozdzielonymi na nim substancjami nazwał chromatografem [5].
W najważniejszym dla biochemii typie chromatografii strefowej, mała objętość („strefa”) badanej próbki unoszona jest przez fazę ruchomą. W trakcie przemieszczania się względem fazy stacjonarnej poszczególne składniki mieszaniny ulegają zróżnicowanemu wyhamowywaniu, co wynika z różnic w mocy ich oddziaływań z fazą stacjonarną. Proces chromatograficzny pozwala na wielokrotne wzmocnienie tych początkowo nawet bardzo drobnych różnic, gdyż poruszająca się strefa próbki kontaktuje się kolejno ze świeżymi partiami fazy stacjonarnej i różnicująca składniki próbki równowaga chemiczna każdorazowo ulega odtworzeniu.
Przyjmując za kryterium podziału metod chromatograficznych stan skupienia fazy ruchomej wyróżniamy chromatografię gazową i chromatografię cieczową. W dalszym, najszerszym podziale chromatografii cieczowej bierze się pod uwagę stan skupienia fazy stacjonarnej oraz naturę i fizykochemiczny mechanizm zjawisk decydujących o rozdziale substancji. Na podstawie tych kryteriów wyróżniamy:
• chromatografię podziałową (inaczej: chromatografię w układzie ciecz – ciecz), w której fazą stacjonarną jest ciecz, a podstawą rozdziału substancji jest zjawisko podziału,
• chromatografię adsorpcyjną (inaczej: chromatografię w układzie ciecz – ciało stałe), w której faza stacjonarna jest fazą stałą, a rozdział substancji zachodzi dzięki zjawiskom adsorpcji.
Ze względu na różnorodność technik chromatografii cieczowej, zwłaszcza na gruncie biochemii, potrzebne jest jednak bardziej szczegółowe wyróżnienie technik:
• chromatografii żelowej, nazywanej też sączeniem molekularnym,
• chromatografii jonowymiennej,
• chromatografii powinowactwa,
• chromatografii oddziaływań hydrofobowych.
Trzy ostatnie techniki zaliczyć można do szeroko rozumianego typu chromatografii adsorpcyjnej, natomiast chromatografia żelowa jest techniką unikalną, choć przez niektórych uważaną za specyficzny rodzaj chromatografii podziałowej [8]. Do chromatografii sita molekularnego stosuje się kolumnę wypełnioną żelem Sephadex [7].
Techniki chromatograficzne są wykorzystywane do separacji makromolekuł na podstawie takich parametrów, jak: wielkość i kształt, hydrofobowość, ładunek powierzchniowy czy powinowactwo.
Pierwszą z tych technik - sączeniem molekularnym zwanym także filtracją żelową - rozdziela się białka
na podstawie wielkości i kształtu ich cząsteczek. Separacja białek za pomocą chromatografii jonowymiennej polega na wykorzystaniu różnic w ładunku powierzchniowym cząsteczek białka. W chromatografii oddziaływań hydrofobowych uwzględnia się różnice w hydrofobowości białka, natomiast w chromatografii powinowactwa wykorzystuje się powinowactwo dwóch substancji, np. enzymu i substratu, z których jedna jest unieruchomiona na nośniku [13].
Chromatografię można podzielić ze względu na kształtu złoża na kolumnową i planarną. Istotne znaczenie ma także sposób prowadzenia procesu rozdzielania oraz sposób przemieszczania mieszaniny wzdłuż kolumny wypełnionej fazą stacjonarną. Najbardziej rozpowszechnione są metody, w których przemieszczenie mieszaniny następuje na drodze elucji, tj., gdy faza ruchoma przemieszcza się ciągle przez złoże chromatograficzne lub wzdłuż niego a próbka jest wprowadzana do układu w postaci określonej porcji. W chromatografii elucyjnej do określenia fazy ruchomej używa się terminu eluent. W technice elucyjnej eluent płynie nieprzerwanie przez aparaturę. Próbka badanej mieszaniny wprowadzana jest do układu przez dozownik (zwykle jest to układ z pętlą dozowniczą o pojemności od kilku do kilkuset μl, do którego wprowadza się próbkę strzykawką) a następnie przenoszona przez eluent do kolumny i tam rozdzielana na składniki. Podczas analizy temperatura kolumny i prędkość przepływu eluentu mogą być stałe (elucja izokratyczna) lub zmieniać się w czasie (elucja gradientowa). Pojawienie się poszczególnych składników w detektorze wytwarza sygnały elektryczne rejestrowane przez komputer sterujący pracą chromatografu [11].
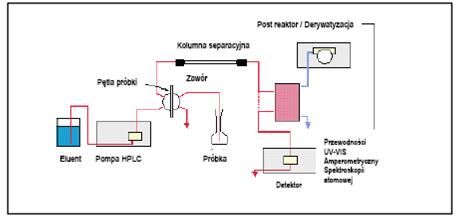
Rys 1. System HPLC lub IC z najważniejszymi składnikami [4].
Współczesna chromatografia jonowymienna na małych cząsteczkach w wysokosprawnych kolumnach z użyciem detektorów konduktometrycznych, amperometrycznych lub spektro - fotometrycznych jest nazywana chromatografią jonową (Ion Chromatography, IC). Jest to technika, w której rozdzielanie jest głównie wynikiem różnej zdolności składników próbki do ulegania wymianie jonowej.
Do podstawowych zalet chromatografii jonowej należą:
• możliwość jednoczesnego oznaczania kilku jonów w próbce,
• krótki czas analizy (od kilku do kilkunastu minut),
• niskie progi wykrywalności (1 ng/ml), które mogą być dodatkowo obniżone o 2-3 rzędy przez zastosowanie kolumny zagęszczającej,
• szeroki zakres oznaczanych substancji, możliwość stosowania różnych detektorów,
• niewielka ilość próbki potrzebna do analizy (0,1-1 ml),
• łatwość przygotowania próbki do analizy,
• wysoka selektywność oznaczanych jonów w próbkach o złożonej matrycy.
Obecnie w krajach wysokorozwiniętych większość rutynowych analiz jonów nieorganicznych i organicznych wykonuje się tą techniką. Północnoamerykańska Agencja Ochrony Środowiska (EPA) już od końca lat siedemdziesiątych zaleca stosowanie chromatografii jonowej do badania stanu środowiska. Technika chromatografii jonowej nieustannie się rozwija i stale podąża za rozwojem, stanowiących jej bazę, dziedzin takich jak: fizykochemia, mechanika precyzyjna, inżynieria materiałowa, elektronika i informatyka. Z drugiej strony IC wychodzi na przeciw stale rosnącym wymaganiom stawianym metodom analitycznym przez dziedziny takie jak np. biotechnologia czy technologia materiałów półprzewodnikowych.
Chromatografia jonowa jest techniką analityczną wykorzystującą wiele rodzajów separacji oraz detekcji w celu uzyskania rutynowych oznaczeń indywiduów jonowych w zakresie od μg/l (sub ppb) do mg/l (ppm). Wielość dostępnych metod pozwala na prawidłowe wybranie sposobów rozdziału i detekcji ,a w rezultacie optymalne rozwiązanie szczegółowych problemów analitycznych. We wszystkich przypadkach, rozdział w chromatografii jonowej odbywa się z wykorzystaniem różnic w położeniu równowagi podziału składników próbki pomiędzy fazę ruchomą i stacjonarną. Skład i budowa fazy stacjonarnej są kluczowe dla procesu rozdziału chromatografii jonowej. Obecnie w chromatografii jonowej stosuje się trzy główne sposoby rozdziału, różniące się rodzajem materiału wypełnienia kolumny, jego zdolnością wymienną, a przede wszystkim mechanizmem wymiany.
Są to:
• Wysokosprawna Chromatografia Jonowa (High Performance Ion Chromatography,
HPIC)
• Wysokosprawna Chromatografia Jonowykluczająca (High Performance
Ion Chromatography Exclusion, HPICE)
• Chromatografia Par Jonowych (inaczej Chromatografia Jonowa z Fazą
Ruchomą) (Ion Pair Chromatography, Mobile Phase Ion Chromatography, MPIC) [11].
Rozdział chromatograficzny może być dokonywany w celu:
• analitycznym, gdy interesuje nas wyłącznie identyfikacja oraz oznaczenie ilościowe składników mieszaniny,
• preparatywnym, gdy co najmniej jeden z rozdzielonych składników zostaje wyodrębniony w postaci czystej, np. jako ostateczny produkt jakiejś technologii przemysłowej [8].
Analityka środowiskowa należy do najważniejszych zastosowań chemii analitycznej i obejmuje badania wód, gleb i powietrza. Do najczęściej oznaczanych analitów w tego rodzaju próbkach zaliczyć należy metale, w tym metale alkaliczne, metale ziem alkalicznych, metale ciężkie i przejściowe, a także lantanowce i aktynowce. Stosowanie klasycznych metod mokrych jest zazwyczaj praco- i czasochłonne, ponadto wymaga stosowania dużych ilości drogich i toksycznych odczynników. Obecnie metody te są z powodzeniem zastępowane przez techniki instrumentalne, które są szybsze, bardziej dokładne i powtarzalne. Zastosowanie znalazły tu metody chromatografii cieczowej, ze szczególnym uwzględnieniem metod chromatografii jonowej do oznaczania jonów metali w próbkach środowiskowych [10].
Metodami chromatograficznymi, służącymi do oznaczania pestycydów mogą być zarówno chromatografia gazowa (GC), która jest stosowana najczęściej, jak i chromatografia cieczowa (HPLC), cienkowarstwowa (TLC) oraz chromatografia z płynem w stanie nadkrytycznym (SFC) [3].
Jedną z możliwości wykorzystania chromatografii powinowactwa jest metoda oczyszczania białek wiążących DNA. Metoda ta wykorzystuje zdolność białka do wiązania się z określoną sekwencją. W metodzie tej fragment DNA lub lub syntetyczny oligonukleotyd jest wiązany z kolumną, zazwyczaj przez połączenie jednego końca DNA ze złożem krzemionkowym. Przez kolumnę przepuszcza się ekstrakt białek w buforze o małym stężeniu soli, który umożliwia związanie białek z rozpoznawanymi przez nie sekwencjami. W kolumnie pozostają białka specyficznie wiążące się ze związanym fragmentem DNA, pozostałe białka są z niej wypłukiwane. Po całkowitym wypłukaniu białek niezwiązanych z kolumną, płucze się ją buforem o dużym stężeniu soli, który destabilizuje kompleksy DNA. W ten sposób można otrzymać czyste białko wiążące się z konkretnym fragmentem DNA [1].
W ciągu kilku ostatnich lat liczne nowe metody chromatograficzne stały się dostępne w analizie chemicznej flawonoidów i saponin. Metody te nie tylko skracają czas rozdziału tych związków, lecz umożliwiają izolację wcześniej nieznanych lub niestabilnych składników ekstraktów surowców roślinnych.
Preparatywna chromatografia kolumnowa
Do rozdziału frakcji octano-etylowej otrzymanej z ekstraktu metanolowego z rośliny Lepechinia graveolens, zawierającej m.in. flawonoidy, w tym 7-O-glukouronid luteoliny, zidentyfikowany później, jako jeden z głównych związków wymiatających wolne rodniki w tej roślinie została zastosowana kolumna Sephadex LH-20.
Metody rozdziału i identyfikacji flawonoidów oraz saponin metodą wysokosprawnej chromatografii cieczowej (HPLC)
Wysokosprawna chromatografia cieczowa (HPLC) jest metodą analityczną pozwalającą na rozdział różnorodnych mieszanin związków chemicznych. Jest powszechnie wykorzystywana w analizie substancji pochodzenia roślinnego ze względu na dobrą czułość i uniwersalność. HPLC jest metodą cały czas rozwijaną, również poprzez łączenie jej z innymi technikami jak np. spektrometria masowa czy spektroskopia magnetycznego rezonansu jądrowego [9].
Przykładem łączenia metod chromatograficznych z innymi metodami jest przedstawiona metoda oznaczania dwunastu leków przeciwdepresyjnych (amitryptyliny, chlorpromazyny, klomipraminy, doksepinu, fluoksetyny, lewomepromazyny, maprotyliny, paroksetyny, perazyny, promazyny, sertraliny, tiorydazyny) we krwi z użyciem chromatografii cieczowej sprzężonej ze spektrometrią masową (LC/MS). Badane związki ekstrahowano z próby krwi za pomocą acetonitrylu. Rozdział chromatograficzny przeprowadzono na kolumnie Eclipse XDb C18 (150 x 4,6 mm, 5 μm). Jako fazę ruchomą zastosowano mieszaninę acetonitrylu i 0,1%tFA w wodzie (50:50 v/v) z przepływem 0,4 ml/min. Analizę prowadzono w trybie monitorowania pozornych jonów molekularnych [MH+] charakterystycznych dla analizowanych związków [12]
Analiza flawonoidów metodą HPLC
Prawie każda ze 199 metod rozdziału HPLC opisanych w publikacjach poświęconych identyfikacji flawonoidów, posiada własny schemat separacji [9].
Wysokosprawna chromatografia cieczowa (HPLC) znalazła też zastosowanie w analizie zawartości kwasu fitynowego (IP6) w różnych produktach [6].
Analizy kwasu fitynowego oraz niższych fosforanów mio - inozytolu dokonano również przy wykorzystaniu wysokosprawnej chromatografii jonowej (HPIC) z elucją gradientową, detekcją UV oraz systemem postkolumnowej derywatyzcji [2].
Obecnie techniki chromatograficzne, dzięki ich możliwościom wykrywania analizowanej substancji i oznaczania jej ilości w próbce na bardzo niskim poziomie, w obecności szeregu innych substancji, stały się jedną z najbardziej rozpowszechnionych metod instrumentalnych w biochemii [8].
Autor: Emilia Cielecka
Literatura:
1. Brown T. A. Genomy. Wydawnictwo Naukowe PWN. Warszawa, 2001: 144 – 168
2. Chen Qing – Chuan, Li B. W. Separation of phytic acid and other related inositol phosphates by high – performance ion chromatography and its applications. Journal of Chromatography A, 1018 (2003): 41 - 52
3. Czeczko R. Zastosowanie metod chromatograficznych do oznaczania pozostałości pestycydów w owocach i warzywach. Ochrona Środowiska i Zasobów Naturalnych NR 48. 2011: 462 – 466
4. Eith C., Kolb M., Seubert A., Viehweger K. H. (red). Krawczyk W. E. (tł). Praktyczna chromatografia jonowa. Monografia Metrohm'a . Szwajcaria: 15
5. Filipowicz B. Chemia i życie. Wiedza Powszechna. Warszawa 1981: 145 – 165
6. Harland B. F., Smikle – Williams S., Oberleas D. High performance liquid chromatography analysis of phytate (IP6) in selected foods. Journal of Food Composition and Analysis 17 (2004): 227 – 223
7. Kączkowski J. Podstawy biochemii. Wydawnictwa Naukowo – Techniczne. Warszawa, 2005: 68 - 90
8. Kozik A., Rąpała – Kozik M., Guevara – Lora I. Analiza instrumentalna w biochemii. Wybrane problemy i metody instrumentalnej biochemii analitycznej. Seria Wydawnicza Instytutu Biologii Molekularnej Uniwersytetu Jagiellońskiego. Kraków, 2001: 157 – 218
9. Machowski M., Kaliszewska D., Kiss A. Chromatograficzne metody izolacji i identyfikacji flawonoidów i saponin. BIULETYN Wydziału Farmaceutycznego Warszawskiego Uniwersytetu Medycznego. 2010, 4: 27 – 37
10. Michalski R., Kanarski J. Instrumentalne metody oznaczania metali w próbkach środowiskowych Część I Metody chromatograficzne. Ekologia i Technika. 2007, R. 15, nr 6: 230 – 235
11. Pogocki D. Wstęp do chromatografii jonowej. Instytut Chemii i Techniki Jądrowej. Warszawa, 1998: 5 – 9
12. Pufal E., Sykutera M. Wykorzystanie chromatografii cieczowej z detektorem masowym (LC/MS) do oznaczania leków przeciwdepresyjnych we krwi. ARCH. MED. SĄD. KRYM., 2008, LVIII: 171 – 176
13. Rosiński M., Piasecka – Kwiatkowska D., Warchlewski J. R. Przegląd metod separacji i oczyszczania białek przydatnych w badaniach i analizie żywności. ŻYWNOŚĆ. Nauka. Technologia. Jakość. 2005, 3 (44): 5 – 22
Tagi: chromatografia, chromatografia cieczowa, chromatografia żelowa, chromatografia jonowymienna, chromatografia powinowactwa, chromatografia hydrofobowa, HPLC, lab, laboratorium, laboratoria
wstecz Podziel się ze znajomymi











Recenzje