Zdjęcie:http://infarma.pl/fileadmin/badania_kliniczne_rapor/Badania%20kliniczne%20w%20Polsce%202010.pdf [4].
Wśród najczęściej dostrzeganych pozytywów przeprowadzania badań klinicznych należy wymienić:
- wpływ na różne sektory gospodarki (sektor opieki medycznej, inne sektory powiązane z rynkiem badań)
- prowadzenie badań klinicznych przez duże międzynarodowe firmy farmaceutyczne przyczynia się do zwiększonego napływu środków pieniężnych do naszej gospodarki [4].
Wśród osób narażonych na wystąpienie działań niepożądanych w trakcie trwania badania klinicznego, oprócz pacjentów należy m.in. wymienić:
- badaczy(lekarze prowadzący dany eksperyment)
- sponsorów badania klinicznego
- firmy farmaceutyczne (mające za zadanie finansowanie i częściową realizację badania klinicznego)
- ośrodki (tj. szpitale, poradnie, gabinety lekarskie, w których badanie kliniczne się odbywa)
- monitorów badań klinicznych (tj. firmy prowadzące i zarządzające badaniami) [1], [2].
Ponadto, w badanie kliniczne oprócz głównych podmiotów zaangażowanie są także: komisje bioetyczne, instytucje zezwalające oraz nadzorujące realizację danego badania klinicznego, w tym: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, a także urzędy oraz instytucje, które przygotowują i uchwalają i wdrażają dane regulacje prawne dotyczące badań klinicznych. Ponadto, w badania zaangażowane są także towarzystwa ubezpieczające [2].
By skutecznie zapobiegać zagrożeniom, które mogą występować w trakcie prowadzenia badania klinicznego, wymagane jest opracowanie skutecznych metod ujawniania i analizy zagrożeń. Ograniczanie ryzyka osiąga się poprzez:
- szkolenia,
- trening,
- nadzór oraz system kar i środków dyscyplinujących.
Warto także opracować zasady eliminowania i ograniczania zagrożeń, co więcej szkolenia i treningi w tym kierunku, powinny dotyczyć wszystkich podmiotów zaangażowanych w badanie i być dostosowane do charakteru, w jakim dany podmiot jest zaangażowany w realizację badania klinicznego. Nadzór na badaniami klinicznymi powinny sprawować zarówno podmioty bezpośrednio realizujące badania kliniczne (tj. badacze, ośrodki), jak również instytucje zewnętrzne (tj. firmy zarządzające badaniami, komisje bioetyczne czy Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych). Bardzo radykalnym sposobem ograniczania ryzyka w badaniach klinicznych (a zarówno bardzo skutecznym) są różnorodne kary i środki dyscyplinujące, które mają na celu zapobieganie ponownemu udziałowi podmiotów, które utraciły wiarygodność oraz umożliwiać dyscyplinowanie podmiotów tak, aby realizacja każdego badania klinicznego przebiegała w zgodzie z obowiązującymi prawami i normami etycznymi [1].
W trakcie realizacji badań mogą wystąpić następujące szkody:
- fizyczne, które polegają na poniesieniu trwałego lub przemijającego uszczerbku na zdrowiu
- szkody dotyczące psychiki (w większości polegające na niekorzystnym postrzeganiu swojej osoby,ujawnianiu sie emocji takich jak strach czy poczucie winy)
- szkody w sferze stosunków społecznych (pojawienie się niekorzystnych relacji międzyludzkich, takich jak: dyskryminacja, stygmatyzacja, ostracyzm, utrata dobrego imienia)
- szkody prawne (oskarżenie, aresztowanie, proces sądowy) lub szkody materialne (straty ekonomiczne)
- szkody dotyczące godności osobistej lub szkody wynikające z zerwania relacji lub zobowiązań pomiędzy podmiotami, które zaangażowane są w realizację danego badania klinicznego, naruszanie prywatności, zwyczajów i zachowań
Realizacji każdego badania klinicznego obarczona jest ryzykiem/zagrożeniem. Zagrożeniem określa się każdą sytuację, która prowadzi do wystąpienia szkody, potrzebę ograniczania danego ryzyka określaja międzynarodowe wytyczne, jednakże z uwagi na nowatorski charakter badań nie jest możliwe całkowite wyeliminowanie ryzyka [5], [6].
W trakcie rozpoczynania badania klinicznego pojawia się pytanie, czy wszystkie osoby zaangażowane w równym stopniu narażone są na wystąpienie ewentualnych działań niepożądanych?. Zazwyczaj, osobami, które najbardziej narażone są na szkody w trakcie realizacji badania są sami uczestnicy badani (tj. zdrowi ochotnicy lub chorzy). I to gównie te osoby brane są pod uwagę w trakcie opracowywania wytycznych i przepisów prawnych, mających na celu wyeliminowanie (bądź ograniczenie) ryzyka. Inne podmioty zaangażowane w realizację badań, bardzo często są nieświadome istniejących zagrożeń, a niestety one również są na nie narażone. Co więcej, dane zagrożenie bardzo rzadko dotyczy tylko jednego podmiotu i zazwyczaj wiąże się ono z powstaniem różnych rodzajów szkód dla poszczególnych podmiotów [2].
Analiza zagrożenia w badaniach klinicznychBy zapobiegać zagrożeniom oraz zmniejszać ryzyko w badaniach klinicznych wymagane jest opracowanie skutecznych metod służących do ujawniania i analizy tych potencjalnych zagrożeń. Proces ten musi być prowadzony w sposób indywidualny, dostosowany do rodzaju badania, ponieważ każde badanie kliniczne jest inne. Co więcej, analiza powinna uwzględniaćwszystkie możliwe typy szkód, które mogą wystąpić w trakcie badania.
Podczas analizy zagrożeń, w pierwszej kolejności należy ujawnić te zagrożenia, które bezpośrednio towarzyszą realizacji badania klinicznego, a w drugiej szkody z nim związane (tj. te,które mogą być następstwem wykrytych zagrożeń). Przykładem zagrożenia towarzyszącego badaniu klinicznemu może być fakt uczestniczenia w nim badacza, który nie wykupił polisy ubezpieczeniowej, a następstwem powstałego zagrożenia wynikającego z jej braku- konieczność wypłacenia odszkodowania uczestnikowi badania, który to poniósł szkodę na zdrowiu w wyniku udziału w danym eksperymencie. W momencie, ujawnienia potencjalnych zagrożeń oraz szkód należy przystąpić do opracowywania metod, które mają na celu zminimalizowanie ryzyka wystąpienia niemożliwego do uniknięcia zagrożenia, a także metody mogące ograniczyć niekorzystne skutki powstałej szkody.
Skuteczną metodą mającą ograniczyć niekorzystne skutki badania klinicznego w powyższym przykładzie jest zawarcie odpowiedniej polisy ubezpieczeniowej, która to będzie chronić badacza przed roszczeniami finansowymi uczestnika badania klinicznego, a tym samym zapewniać mu wypłacenie odszkodowania przysługującego z powodu utraty zdrowia pacjenta [1].
Rozpoczęcie analizy potencjalnego zagrożenia Aby analiza potencjalnego zagrożenia miała sens, musi być ona prowadzona w sposób ciągły. Pierwsze analizy badania powinny być rozpoczęte już w trakcie jego projektowania, co ma służyć opracowaniu szczegółowych zasad przeciwdziałania zagrożeniom. W trakcie realizacji części klinicznej często zachodzi potrzeba powtórnej analizy wybranych (znanych) zagrożeń, a także opracowania zasad postępowania w przypadku pojawienia się nowych zagrożeń (jeszcze nie znanych- wcześniej nie przewidzianych). Ostatnim etapem analizy zagrożeń jest faza opracowania zebranych wcześniej danych [1].


 Co roku w Polsce przeprowadzanych jest kilkaset badań klinicznych. Każde badanie kliniczne niesie ze sobą ryzyko wystąpienia tzw. działań niepożądanych, a także wiele korzyści materialnych i niematerialnych. Zazwyczaj działania niepożądane kojarzone są z pacjentami, czyli osobami, na których dane badanie jest przeprowadzane, jednakże w rzeczywistości na zagrożenia te narażone są także pozostałe osoby zaangażowane w badanie.
Co roku w Polsce przeprowadzanych jest kilkaset badań klinicznych. Każde badanie kliniczne niesie ze sobą ryzyko wystąpienia tzw. działań niepożądanych, a także wiele korzyści materialnych i niematerialnych. Zazwyczaj działania niepożądane kojarzone są z pacjentami, czyli osobami, na których dane badanie jest przeprowadzane, jednakże w rzeczywistości na zagrożenia te narażone są także pozostałe osoby zaangażowane w badanie.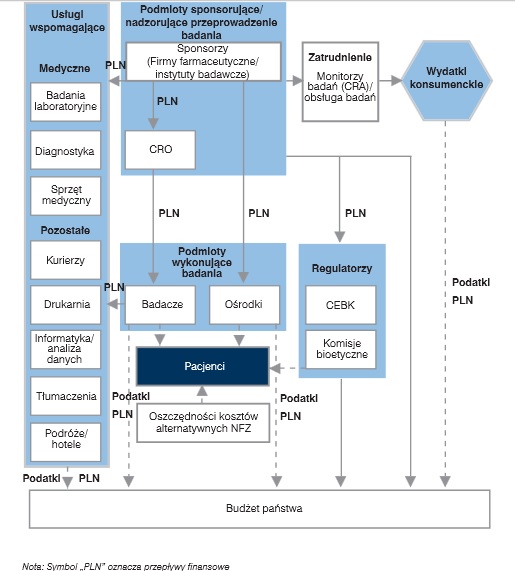
Recenzje