Rysunek 1. Zasada działania techniki MALDI. Impuls laserowy po dotarciu do materiału matrycy, która zawiera badana próbkę wywołuje zjawisko desorpcji i jonizacji, w wyniku czego powstają duże dodatnio naładowane jony, które oddalają się w kierunku detektora masowego. Na rysunku: próbka (ang. sample), matryca (ang. matrix), impuls laserowy (ang. laser pulse) [1].
W celu wyjaśnienia procesu desorpcji dużych cząsteczek w technice MALDI, opracowano do niej kilka teorii. Jedną z nich jest model termiczny, który proponuje, by cząsteczki sublimowały na powierzchni matrycy w wyniku lokalnego ogrzewania przez niską energię lasera, zaś powyżej pewnego natężenia padającej energii szybko wzrastała desorpcja o dużej wydajności nienaruszonych cząsteczek. Ogólnie uważa się, że jonizacja odbywa się przez przeniesienia protonu lub poprzez przekształcenie w kationy. Jonizacja zależy od materiału matrycy, ale nie zależą od ilości kwasowych lub zasadowych grup analitu. Sugeruje to, że jest odpowiedzialny za jonizację jest bardziej złożony mechanizm, niż prosta chemia kwasowo-zasadowa.
Związki matrycoweTechnika MALDI wykorzystuje matrycę, która pośredniczy w przekazywaniu energii do badanej substancji, przez co ułatwia jej jonizację. Matryca umożliwia badanie substancji nielotnych, wielkocząsteczkowych oraz polarnych. Zasadniczymi cechami związków matrycy stosowanych w technice MALDI jest dobra absorpcja promieniowania z zakresu UV, łatwa sublimacja oraz możliwość dostarczenia po desorpcji dużych ilości protonów potrzebnych do jonizacji badanej substancji. Najczęściej stosowanymi związkami matrycy są kwasy 3,5-dimetoksy-4-hydroksycynamonowy (SIN), 2,5-dihydroksybenzoesowy (DHB), alfa-cyjano-4-hydroksycynamonowy (α-CN) oraz 1,8,9-trihydroksyantracen (Dithranol) (Rys. 2).
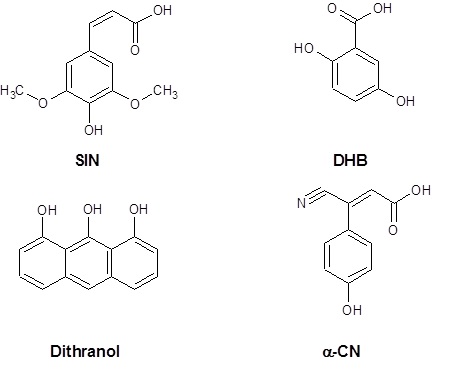
Rysunek 2. Na rysunku widoczne są cztery podstawowe związki tworzące matryce w MALDI. Kolejno SIN, DHB, α-CN oraz dithranol [2].
Rodzaje generowanych jonówPodczas jonizacji metodą MALDI mogą powstawać jony dodatnie i ujemne (peptydy polikwasowe). W przypadku próbek biologicznych powstają w różnej proporcji jony typu [M+H]+, [M+Na]+ oraz [M+K]+. Natomiast polimery generują przede wszystkim jony stabilizowane kationami metali (przeważnie sodu) (Tab. 1).
Tabela 1. Rodzaje jonów generowanych w technice MALDI [3].
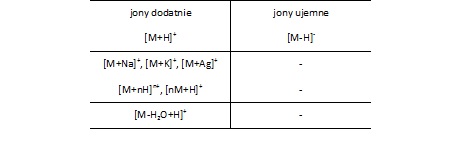
Jony zawierające cząsteczkę matrycy, lub cząstkę powstałą w wyniku jej rozpadu, powstają na ogół z małą wydajnością. Dla stabilizacji jonów otrzymywanych z Dithranolu bardzo często stosuje się dodatek kationów srebra [M+Ag]+. W innych przypadkach pod wpływem wysokiej temperatury może zachodzić wydzielenie wody z cząsteczki [M-H2O+H]+.
Najczęściej w widmie obserwuje się przede wszystkim intensywny pik molekularny typu [M+H]+ oraz niewielką liczbę jonów wielokrotnie naładowanych typu [M+nH]n+ oraz jonów typu [nM+H]+. Dwa ostatnie typy jonów powstają częściej przy jonizacji peptydów, oraz cząsteczek o dużej powierzchni. Sporadycznie w technice MALDI tworzą się rzeczywiste jony molekularne typu [M]+. Dotyczy to w zasadzie tylko pomiarów wykonywanych bez użycia matrycy (kaliksareny, fulereny).
MALDI zalicza się do łagodnych sposobów jonizacji, pokrewnych jonizacji chemicznej. Matryca separuje od siebie cząsteczki badanej substancji i w łagodny sposób (tj. bez wywoływania rozkładu) przekazuje im zaabsorbowaną przez siebie energię. Ponieważ główną część energii cieplnej, przekształcanej następnie na energię drgań wiązań chemicznych, pochłania matryca, chroni to badaną substancję przed rozkładem. Natomiast jony substancji o małej masie cząsteczkowej często ulegają w tych warunkach fragmentacji. Paradoks ten tłumaczy się tym, że duże cząsteczki mają wiele możliwości wykonywania drgań i rotacji, tak że zaabsorbowana energia ulega rozproszeniu bez rozerwania wiązań chemicznych. Duży wpływ na to zjawisko ma dodatek kationu o dużym promieniu jak K+, czy Ag+, który stabilizuje powstający jon cząsteczkowy.
Pomiar masy cząsteczkowejPomiar masy cząsteczkowej analizowanego związku odbywa się w spektrometrze masowym (MS). Detektor ten został zmodyfikowany i w technice MALDI mierzy czas przelotu jonów Tof (ang. time of flight) Analizowana substancja rozpuszczona w lotnym rozpuszczalniku miesza się z roztworem matrycy I WSPÓŁKRYSTALIZUJE.
Po dokładnym wysuszeniu próbkę wprowadza się do komory pomiarowej aparatu i usuwa powietrze. Po uzyskaniu dostatecznej próżni wykonuje się właściwy pomiar. Najczęściej wykorzystuje się laser na ciele stałym itrowo-glinowo-neodymowy. Skoncentrowany impuls wywołuje ciąg następujących po sobie reakcji. Najpierw następuje absorpcja promieniowania głównie przez materiał matrycy, odparowanie próbki i wyrzucenie strumienia gazów prostopadle do jej powierzchni. W kolejnym etapie dochodzi do dysocjacji termicznej matrycy i tworzenie jonów (głównie H+, Na+, K+). Powstałe jony reagują z badaną substancją i materiałem matrycy. Wytworzone w ten sposób jony są przyspieszane w polu elektrycznym i kierowane do detektora. Całkowity czas trwania wymienionych procesów nie przekracza kilku nanosekund, dlatego aby zachodziły one z dobrą wydajnością i powtarzalnością konieczna jest możliwie doskonała homogenizacja próbki. Stąd też w technice MALDI wielkie znaczenie ma sposób przygotowania próbki przed pomiarem (użyta matryca, rozpuszczalnik, stężenia roztworów oraz sposób ich mieszania i nakładania).
Ostatecznym rezultatem analizy MALDI-ToF-MS jest otrzymanie widma spektrometrycznego, na którym widoczne są sygnały od mas powstałych jonów oraz cząsteczki niezjonizowanej [M]. Sygnał cząsteczki niezjonizowanej widoczny jest bardzo rzadko. Sygnały układają się zgodnie ze wzrostem masy otrzymanego jonu bądź molekuły. Ich intensywność zależy od proporcji i rodzaju otrzymanych jonów (Rys. 3).
Rysunek 3. Przykładowe widmo glikoproteiny A1GB wykonane techniką MALDI-ToF-MS [4].
Zastosowania MALDI
Technika MALDI dzięki swej nieinwazyjności oraz precyzji znalazła zastosowanie w biochemii do szybkiej identyfikacji białek izolowanych za pomocą elektroforezy żelowej. W chemii organicznej do analizy syntetycznych makrocząsteczek, takich jak spiroidy, dendrymery oraz bardzo rozgałęzione polimery. Chemia polimerowa wykorzystuje MALDI zwłaszcza do określanie rozkładu masy molowej otrzymywanych polimerów. Natomiast mikrobiologia używa jej do identyfikacji mikroorganizmów. Są to tylko niektóre ciekawsze zastosowania tej techniki.
Podsumowanie
Postęp, który dokonał się w analizie peptydów i białek technikami MS od końca lat osiemdziesiątych, w dużej mierze można przypisać rozwojowi badań nad desorpcja i jonizacją laserową z wykorzystaniem metod takich jak MALDI. Dotyczy to przede wszystkim rozdzielczości i dokładności pomiarów. Ponadto MALDI jest obecnie rutynową analizą peptydów i białek o femtomolowej czułości. Doskonale nadaje się do odwzorowania masy białka i jego strukturalnych zależności. Wszystko wskazuje na to, że spektrometria masowa w najbliższych latach użyje metodę MALDI, jako podstawowego narzędzia badawczego ze względu na jej większą czułość, precyzję, dokładność oraz sprawność.
Autor: Karolina Wójciuk
Literatura
1. Lewis, J.K., Wei, J., Siuzdak, G., 2000. Matrix-assisted Laser Desorption/Ionization Mass Spectrometry in Peptide and Protein Analysis. Encyclopedia of Analytical Chemistry, R.A. Meyers (Ed.) 5880-5894.
2. Fitzgerald, M.C., Parr, G.R., Smith, L.M., 1993. Basic matrixes for the matrix-assisted laser desorption/ionization mass spectrometry of proteins and oligonucleotides. Analytical Chemistry 65(22), 3204-11.
3. Knochenmuss, R., 2006. Ion formation mechanisms in UV-MALDI. Analyst. 131(9), 966-86.
4. Stehle, J.R.Jr, Weeks, M.E., Lin, K., Willingham, M.C., Hicks, A.M., Timms, J.F., Cui, Z., 2007. Mass spectrometry identification of circulating alpha-1-B glycoprotein, increased in aged female C57BL/6 mice. Biochim. Biophys. Acta. 1770(1), 79-86.




Recenzje