

|
Zamknij X
|
Streszczenie
Reakcja redoks nazywana reakcją utleniania i redukcji, jest szczególnym przypadkiem reakcji chemicznej, w której dochodzi zarówno do redukcji jak i utleniania. W praktyce każda rzeczywista reakcja, w której następuje zmiana stopnia utlenienia atomów lub ich grup jest reakcją redoks, gdyż każdej reakcji redukcji musi towarzyszyć reakcja utlenienia i na odwrót. Rzeczywisty mechanizm danej reakcji jest zwykle bardzo złożony. Pierwiastek lub związek chemiczny będący w analizowanej reakcji redoks donorem (dawcą) elektronów nazywany jest reduktorem, zaś substancja będąca akceptorem elektronów nazywana jest utleniaczem.
Wprowadzenie
Reakcjami utleniania i redukcji nazywamy wszystkie procesy chemiczne, którym towarzyszy zmiana stopnia utlenienia reagentów. Procesem utlenienia nazywamy przemianę związaną z oddawaniem elektronów, natomiast procesem redukcji jest ich pobieranie. Reagent oddający elektrony (ulegający utlenieniu) nazywamy reduktorem (ma on niższy potencjał), reagent pobierający elektrony (ulegający redukcji) jest utleniaczem (ma wyższy potencjał). Procesy te są ściśle ze sobą powiązane. Procesowi utleniania jakiegoś atomu (zwiększeniu jego stopnia utlenienia), zawsze towarzyszy proces redukcji innego atomu (zmniejszenia jego stopnia utlenienia). Stopniem utlenienia nazywamy liczbę elektronów, związanych z atomem danego pierwiastka w związku chemicznym, które stanowią nadmiar lub niedomiar elektronów w stosunku do liczby atomowej tego pierwiastka. W jednoatomowych jonach nadmiar elektronów nazywamy ujemnym stopniem utlenienia, niedomiar zaś dodatnim stopniem utlenienia. Ponadto, wszystkie pierwiastki w stanie wolnym (atomowym bądź cząsteczkowym), mają stopień utlenienia równy zeru. Jednak w jonach kompleksowych lub w związkach cząsteczkowych stopień utlenienia musi być obliczony z ładunków jonowych i stopni utlenienia innych, obecnych w danym związku, pierwiastków. W celu ułatwienia obliczeń należy zwrócić uwagę na fakt, iż w związkach pewna liczba pierwiastków charakteryzuje się zawsze tylko jednym stopniem utlenienia, różnym od zera. Tlen z wyjątkiem nadtlenków ma zawsze stopień utlenienia –2, wodór z wyjątkiem wodorków ma stopień utlenienia +1, litowce mają stopień utlenienia +1, natomiast berylowce mają stopień utleniania +2. Korzystając z faktu, że stopień utlenienia obojętnej cząsteczki wynosi zero, a jonu kompleksowego jest z kolei równy jego wartościowości, można obliczyć stopnie utlenienia dowolnych atomów w cząsteczce. Czasem się zdarza, że ten sam pierwiastek w cząsteczce występuje na dwóch różnych stopniach utlenienia. Każda reakcja utleniania i redukcji może być zapisana w formie dwóch reakcji połówkowych, z których jedna przedstawia proces utleniania, zaś druga redukcji. Zapis taki pozwala w łatwy sposób znaleźć współczynniki stechiometryczne, mnożąc oba równania połówkowe przez czynniki prowadzące do zbilansowania ilości wymienianych elektronów (ilość elektronów oddawanych w procesie redukcji musi być równa ilości elektronów pobieranych w procesie utlenienia).
Potencjał normalny utleniania i redukcji
Parametr pozwalający określić i porównywać moc utleniającą (redukującą) dwóch substancji nazywany jest potencjałem normalnym (E0). Niestety nie jest możliwe określenie bezwzględnej tendencji do utleniania (redukcji), łatwo jednakże można określić względną zdolność do ulegania tego typu reakcjom. Normalny potencjał utleniania i redukcji jest wartością różnicy potencjałów elektrycznych standardowego półogniwa, w którym zachodzi interesujący nas proces utleniania i redukcji, względem standardowej elektrody wodorowej, której potencjał normalny przyjęto umownie jako równy zeru. Połowiczne reakcja redukcji ma ten sam, co do wartości, potencjał normalny co analogiczne reakcja utleniania, lecz różny co do znaku. Szeregiem elektrochemicznym metali nazywamy tablicę potencjałów normalnych, zestawionych w kolejności malejących wartości E0, ograniczających się do metali i wodoru. Wartość potencjału utleniania i redukcji zależy od stężenia i temperatury. Wartości potencjałów normalnych odnoszą się do temperatury 250C i stężeń (aktywności) substancji utleniającej (redukującej) wynoszących 1M (mol/dm3).
Potencjał dla układu w innej temperaturze i przy innych stężeniach reagentów należy obliczyć ze wzoru:
E = E0 – (RT/nF)ln(cprod/csub)
gdzie E0 - potencjał normalny, R - stała gazowa, T - temperatura, F - stała Faradaya, c – stężenia (aktywności) substratów i produktów, n - ilość elektronów wymienianych w reakcji.
Wartości potencjałów normalnych pozwalają przewidzieć kierunek reakcji utleniania i redukcji.
Wskaźniki
Wskaźniki zwane też indykatorami, są to substancje chemiczne pozwalające na stwierdzenie danej cechy. Związki te zmieniają barwę w pobliżu punktu równoważnikowego miareczkowania. Wskaźniki mogą być stosowane samodzielnie, bądź z obojętnym barwnikiem, wzmagającym intensywność ich koloru (wskaźniki mieszane). Na zabarwienie wskaźników ma wpływ temperatura oraz obecność w roztworze soli obojętnych, rozpuszczalników organicznych oraz koloidów.
W zależności od rodzaju miareczkowania, rozróżnia się wskaźniki alkacymetryczne, kompleksometryczne, redoks, promieniotwórcze oraz adsorpcyjne.
Wskaźniki alkacymetryczne in. wskaźniki pH, są to słabe kwasy lub zasady organiczne, które tworzą z wodą sprzężoną parę kwas-zasada, przy czym postać kwasowa ma inne zabarwienie aniżeli postać zasadowa. Wskaźnikiem alkacymetrycznym jest oranż metylowy, czerwień metylowa, błękit tymolowy, czy też fenoloftaleina.
Wskaźniki kompleksometryczne, to substancje organiczne, które tworzą barwne kompleksy z oznaczanym metalem. Przykładem takiego wskaźnika jest fiolet pirokatechinowy.
Wskaźniki redoks, to substancje organiczne, tworzące sprzężone układy redoks, przy czym postać utleniona wskaźników ma inną barwę aniżeli postać zredukowana. Przykładem takiego wskaźnika jest difenyloamina, błękit metylenowy, czy fenantrolina.
Wskaźnikiem promieniotwórczym są izotopy pierwiastków promieniotwórczych zastępujące pierwiastki nie promieniotwórcze w ich związkach. Przykładowo jod-131 zamiast jodu, czy lutet-177.
Wskaźniki adsorpcyjne, to substancje organiczne o charakterze kwasowym, jak fluoresceina lub zasadowym - rodaminy), które ulegają adsorpcji, bądź desorpcji na powierzchni osadu, co obrazuje się zmianą barwy. Stosowane są podczas strącania osadów w analizie strąceniowej.
Wskaźniki redoks
Wskaźnikami utleniania i redukcji nazywamy substancje barwne które tworzą układy utleniająco-redukujące, przy czym barwa utleniona wskaźnika (InOx) ma inne zabarwienie niż zredukowana (InRed). Układ utleniacz-reduktor utworzony przez wskaźnik ma potencjał określony wzorem:
E = E0In + (RT/nF)ln([InOx] /[InRed])
gdzie E0In określa potencjał przy którym [InOx] = [InRed]. Brawa wskaźnika zależy od stężeń postaci utlenionej i zredukowanej. Podobnie jak w przypadku wskaźników alkacymetrycznych, zabarwienie pochodzące tylko od jednej z form obserwuje się w przypadku gdy stężenie tej formy jest ponad dziesięciokrotnie większe niż drugiej, co prowadzi do wniosku, że zakres zmiany barwy wskaźnika red-ox opisuje zależność:
E = E0In ± 0,059/n
Difenyloamina
Organiczny związek chemiczny o nazwie difenyloamina popularnie używany jest jako fungicyd jabłek (Rys. 1). Związek ten ma bowiem bardzo silne właściwości przeciwutleniających, które chronią skórę jabłek przed produktami utleniania podczas składowania. Alkilowane pochodne pierścieniowe są stosowane jako antyjonizatory w przemyśle gumowym. Związek ten ulega różnym reakcjom cyklizacji. Difenyloamina służy jako wskaźnik redoks do oznaczania żelaza, a także DNA [2].
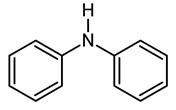
Rysunek 1. Struktura difenyloaminy [1].
Fenantrolina
Właściwą nazwą tego wskaźnika jest o-fenantrolina lub 1,10-diazofenantren (Rys. 2).
Takrystaliczna substancja rozpuszczalna jest w wodzie, alkoholu etylowym oraz acetonie i benzenie. Kompleks o-fenantroliny z żelazem o nazwie ferroina jest wskaźnikiem redoks, który przechodzi z formy niebieskiej (w środowisku utleniającym) do czerwonej (w środowisku redukującym).
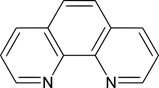
Rysunek 2. Struktura o-fenantroliny [3].
Błękit metylenowy
Błękit metylenowy jest związkiem organicznym z grupy barwników tiazynowych. Jego nazwa systematyczna to chlorek 3,7-bis(dimetyloamino)feno-5-tioazynowy. Struktura tego związku odznacza się swoistą symetrią (Rys. 3).
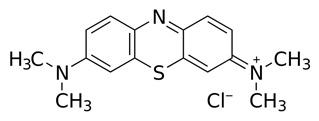
Rysunek 3. Struktura błękitu metylenowego [4].
W warunkach normalnych błękit metylenowy ma postać ciemnozielonego proszku. Rozpuszcza się w wodzie, dając intensywnie niebieski roztwór nawet w małych stężeniach.
Błękit metylenowy jest szeroko wykorzystywany w biologii oraz medycynie, ponieważ wybiórczo wybarwia pewne komórki bakteryjne. Jako wskaźnik redoks jest często stosowany w chemii.
Podsumowanie
Znajomość mechanizmów reakcji utleniania i redukcji jest jednym z ważniejszych celów w interpretacji procesów biologicznych i przemysłowych. Na podstawie potencjałów standardowych można uszeregować utleniacze i reduktory, podobnie jak kwasy i zasady na podstawie ich wartości pKa. Im bardziej dodatni jest potencjał standardowy układu, tym chętniej przyjmuje on elektrony (większa moc utleniająca). Im bardziej ujemny jest potencjał standardowy, tym chętniej oddaje on elektrony (większa moc redukująca). Organiczne wskaźniki redoks stanowią bardzo ważna grupę układów barwnych tworzonych przez pary formy utlenionej i zredukowanej danego związku. Zwłaszcza w biologii komórkowej ich zastosowanie jest o tyle ważne, iż mamy tam do czynienie z procesami elektronowymi na bardzo małej przestrzeni. Zastosowanie tych wskaźników umożliwia śledzenie procesów metabolicznych, które innymi metodami nie możliwe są do zobrazowania i detekcji. Znane są prace, w których proste barwniki redoks przyłączane są do dużych białek, a nawet DNA w celu detekcji danej reakcji na przykład enzymatycznej. Rozwój tej dziedziny nauki jest nadal aktualny, gdyż potrzebne są coraz to nowsze rozwiązania umożliwiające „zajrzenie” w głąb żywej komórki. Zastosowania biologiczne niosą za sobą możliwości zwalczania różnego rodzaju chorób, zwłaszcza degeneracyjnych i nowotworowych.
Autor: Karolina Wójciuk
Literatura:
1. http://pl.wikipedia.org/wiki/Difenyloamina
2. Filfield, F.W., Principle and Practice of Analytical Chemistry, 2000. 5th Edition
3. http://portalwiedzy.onet.pl/15851,,,,wskazniki,haslo.html
4. http://pl.wikipedia.org/wiki/Plik:Methylene_blue.svg
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje