

|
Zamknij X
|
Hemoglobina jest z pewnością najczęściej badanym białkiem w historii. Analizowana jest na wielu płaszczyznach: od jej właściwości biologicznych, strukturalnych i allosterycznych do szczegółowych mechanizmów regulacyjnych. Jej właściwości zostały dostrzeżone przez Darwina, kiedy to pisał, że czerwone krwinki biora udział w wiązaniu i transporcie tlenu [8].
Określanie całkowitej hemoglobiny (Hb) jest jednym z najczęściej zamawianych badań laboratoryjnych. Parametr ten ma także duże znaczenie w diagnostyce anemii, a ciągły pomiar hemoglobiny pozwala na śledzenie postępów leczenia choroby, utraty krwi i skuteczności terapii mających na celu przywrócenie wartości Hb do normalnego poziomu. Tradycyjny pomiar hemoglobiny wymaga inwazyjnego pobrania krwi żylnej. Krw następnie poddawana jest analizie za pomocą specjalnych urządzeń laboratoryjnych (np. CO-oksymetru). CO-oksymetr pozwala na analizowanie hemolizowanej krwi, opierając się na detekcji spektrofotometrycznej. Dokładność tego urządzenia jest funkcją wielu zmiennych (np. długości fal stosowanego światła). W urządzeniach laboratoryjnych stosowanych do określania stężenia Hb możliwe jest zastosowanie jako próbki badanej krwi żylnej lub tętniczej. Należy jednak mieć na uwadze, że pomiar hemoglobiny może się różnić w zależności od tego, czy zastosowano krew żylną czy tętniczą. Mokken i wsp. oraz Yang Za i wsp. przeprowadzili badania, w których udowodniono, że pomiar hemoglobiny w krwi żylnej wykazuje mniejsze stężenie (w zakresie 0,7 – 1.0 g/dL) w porównaniu do krwi tętniczej. Choć całkowita ilość krwinek czerwonych i Hb pozostaje stosunkowo stała w krwi tętniczej i żylnej, procentowe stężenie w osoczu waha się w krwi tętniczej i żylnej pod wpływem różnych czynników fizjologicznych [1].
Methemoglobina (metHgb)
Methemoglobina (metHgb) jest zmienioną formą hemoglobiny, w której atom żelaza w cząsteczce (krytyczna część obszaru wiązania tlenu) został przekształcony na wyższy stopień utlenienia. To powoduje, że jest on zdolny do wiązania tlenu. Wysokie poziomy metHgb we krwi (tzw. methemoglobinemie) mogą powodować uszkodzenia w dostarczaniu tlenu. U zdrowych osób, normalny poziom methemoglobiny jest mniejszy niż 1% całkowitej hemoglobiny. Jeżeli wartości te odbiegają od normy (przekroczenie 1% lub 2% całkowitej hemoglobiny), wtedy mówi się o methemoglobinemii [7].
Otrzymywanie methemoglobiny (wg Kłyszejko-Stefanowicz L., 2003)
Wykonanie:
Materiałem do przeprowadzenia oznaczenia jest roztwór oksyhemoglobiny, który traktuje się kilkoma kroplami roztworu heksacyjanożelazianu (III) (żelazicyjanku) potasowego K3[Fe(CN)6]. W wyniku reakcji z powyższym środkiem utleniającym Hb-O2 przechodzi w Met-Hb (methemoglobina). W probówce zabarwienie krwi zmienia się na brunatne, a w spektroskopie pojawiają się 4 charakterystyczne słabe smugi absorpcyjne. Wykazują one maksimum absorbancji przy długości fali równej odpowiednio λ= 631, λ=576, λ=540 oraz λ=500 nm. W wyniku dodania do próbki roztworu Na2S2O4 zachodzi reakcja redukcji, w efekcie czego powstaje hemoglobina (wykazująca jedną charakterystyczną smugę w spektroskopie) [2].
Próba benzydynowa - wykrywanie hemoglobiny (wg Kłyszejko-Stefanowicz L., 2003)
Wykonanie:
Kilka kryształków benzydyny należy rozpuścić w lodowatym kwasie octowym. Do próbki dodać równą objętość 3% roztworu nadtlenku wodoru . Roztwór ten nie może się zabarwić (ani na niebiesko ani na zielono), gdyż dopiero dodanie do próbki rozcieńczonego roztworu hemoglobiny powoduje zmianę zabarwienia na niebieski. Dzieje się tak, ponieważ hemoglobina (tak jak i peroksydaza) ma zdolność utleniania substratów w obecności nadtlenku wodoru [2].
Karboksyhemoglobina a tlenek węgla
Tlenek węgla jest związkiem, który ulega szybkiej absorpcji przez płuca. We krwi CO łaczy się z hemoglobiną dając karboksyhemoglobinę (HbCO). Powinowactwo CO do hemoglobiny jest ponad 200 razy większe niż tlenu do hemoglobiny. Toksyczność CO wiąże się z zablokowaniem części hemoglobiny jako transportera tlenu, a obecność HbCO powoduje przesunięcie krzywej dysocjacji HbO2 w lewo. W wyniku tak przebiegających reakcji dochodzi do zmniejszenia ilości oddysocjowanego tlenu z hemoglobiny utlenowanej w tkankach, co jest zjawiskiem bardzo niekorzystnym [3]. Oznaczanie karboksyhemoglobiny znalazło zastosowanie w diagnostyce, ale tylko w przypadku, gdy oznaczenie HbCO wykonane jest w czasie krótszym niż 2-3 godzin od momentu pobrania krwi. Ma to związek z bardzo szybkimi zmianami stężenia karboksyhemoglobiny we krwi pacjenta, w wyniku czego oznaczenie tego parametru po upływie dopuszczalnego czasu nie ma korelacji z aktualnym stanem chorego. Zatrucie CO powoduje również zmiany w innych płynach ustrojowych (np. we krwi obserwuje się wzrost aktywności kinazy kreatynowej i dehydrogenazy mleczanowej, zaś w moczu można stwierdzić obecność mioglobiny, która wskazuje na martwicę mięśni) [3].
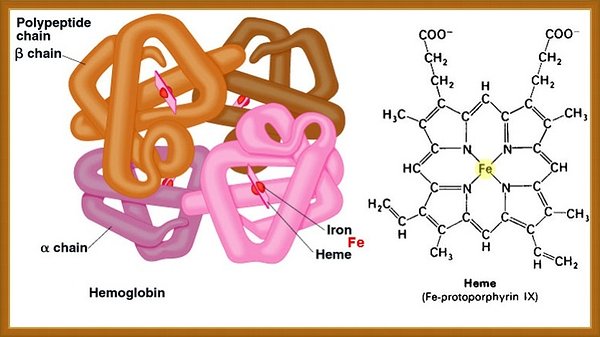
Zdjęcie: struktura hemoglobiny, budowa hemu, http://pharamcytimes.com/category/human-anatomy-physiology/the-blood/
Wykrywanie tlenku węgla
Wykrywanie tlenku węgla jest jednym z parametrów stosowanych w diagnostyce i analityce. Poziom powstałej karboksyhemoglobiny służy do szacowania nasilenia zatrucia tlenkiem węgla [6]. Zazwyczaj do wykrywanie CO wykorzystywane są metody kolorymetryczne, spektrofotometryczne oraz chromatografię gazową[4]. W badaniach toksykologicznych przyjmuje się, że stężenie we krwi karboksyhemoglobiny (COHb) wynoszące więcej niż 50% jest stężeniem śmiertelnym. Wysycenie krwi tlenkiem węgla w granicach 10% - 50% wskazuje na inhalację gazu zawierającego CO [4]. Mechanizm toksycznego działania tlenku węgla opiera się na blokowaniu transportu tlenu, w wyniku konkurencyjnego wiązania z atomem żelaza w cząsteczce hemu. W wyniku tego tworzona jest karboksyhemoglobina (COHb). Badania wykazały, iż powinowactwo tlenku węgla do hemoglobiny, ferrytyny i mioglobiny jest ok. 200-300 razy większe niż powinowactwo tlenu. Oddychanie powietrzem zawierającym CO prowadzi do niedotlenienia anemiczno-cytotoksyczno-zastoinowego, ponadto zwolnione zostają procesy metaboliczne, a w komórkach dochodzi do gromadzenia się kwaśnych metabolitów. Co więcej, zmniejsza się napięcie ścian naczyń mózgowych, dochodzi do przekrwienia mózgu oraz rozwinięcia ciężkiej hipoksji tkankowej i kwasicy mleczanowej [4]. Okres półtrwania karboksyhemoglobiny (COHb t1/2) u osób z zatruciem CO potraktowanych 100% O2 często podawany jest jako 80 min. Dane te pochodzą z prac dostarczonych przez Peterson’a JE. i Stuart’a RD.(1970). Wyniki te zostały uśrednione z dwóch pomiarów (od dwóch zdrowych ochotników), którzy oddychali przez maskę z O2 po eksperymentalnej ekspozycji na CO. Peterson i Stewart (1970) nie mierzyli okresu półtrwania u osób , które uległy przypadkowemu lub celowemu zatruciu CO [5].
Oznaczanie COHb
Karboksyhemoglobina zamiast tlenu w swojej budowie posiada związany tlenek węgla. Hemoglobina ma silne powinowactwo do tlenku węgla, przez co bardzo skutecznie wypiera tlen z cząsteczek, a zatem zakłóca jego dostarczanie. Normalny poziom karboksyhemoglobiny we krwi wynosi od 1% - 3% całkowitej hemoglobiny. Jawne toksyczne objawy zatrucia tlenkiem węgla pojawiają się, gdy stężenie karboksyhemoglobiny osiągnie wartość 15% – 20%. Poziom COHb powyżej 40% wiąże się z pojawieniem się halucynacji i stanem szoku [7].
W praktyce toksykologii sądowej największe zastosowanie w wykrywaniu karboksyhemoglobiny znalazły metody chemiczne, kolorymetryczne, spektrofotometryczne oraz chromatografia gazowa (z różnymi systemami detekcji)- podobnie jak w przypadku wykrywania CO [4].
Otrzymywanie karboksyhemoglobiny (wg Kłyszejko-Stefanowicz L., 2003)
Wykonanie:
Roztwór hemoglobiny należy wysycić gazem świetlnym, w skład którego wchodzi ok. 8% CO (tlenku węgla). W wyniku reakcji zachodzi nieznaczne przesunięcie smugi absorpcyjnej z 578 nm do 572 nm oraz z 540 nm do 535 nm (przejście Hb-O2 w Hb-CO). W wyniku reakcji nie zachodzi zmiana zabarwienia roztworu- nawet po dodaniu do próbki dwutionianu sodu [2].
Wykrywanie karboksyhemoglobiny na drodze chemicznej (wg Kłyszejko-Stefanowicz L., 2003)
1) Próba Kunkela
DO 2 probówek należy dodać po 1 ml stężonego roztworu Hb-O2 oraz Hb-CO w stosunku: 1 ml krwi + 1 ml wody. Następnie, do każdej probówki dodać po kilka kropli 3% roztworu taniny, w wyniku reakcji zachodzi zmiana barwy próbek. Osad krwi normalnej ma barwę szaro-różową, zaś osad karboksyhemoglobiny (HB-CO)przybiera intensywnie różowy kolor. Barwy roztworów nie ulegają zmianie nawet po dłuższym odstaniu próbek.
2) Próba z zasadą
W porcelanowej parowniczce należy zmieszać 4 krople krwi z 4 kroplami 25% roztworu wodorotlenku sodu. Próbkę należy ogrzewać na siatce azbestowej (nad płomieniem) przez 1 minutę. Pojawienie się w parowniczce czerwonego strątu świadczy o obecności w próbce karboksyhemoglobiny. Pojawienie się zielono-szarego strątu świadczy z kolei o obecności oksyhemoglobiny [2].
Ilościowe oznaczanie hemoglobiny w obecności amoniaku (wg Homolka J., 1961)
W trakcie hemolizy erytrocytów dochodzi do przemiany hemoglobiny w oksyhemoglobinę. Oksyhemoglobina w obecności dwutionianu sodu oddaje tlen, a sama przekształca się w hemoglobinę. Towarzyszy temu zmiana zabarwienia roztworu na czerwono-fioletowy. Dodanie do próbki rozcieńczonego roztworu amoniaku (o pH=8) zapobiega powstawaniu zmętnienia- powodowanego wytrącaniem się w próbce białek [9].
Wykonanie:
Jako materiał do badań służy krwe pobrana z opuszki palca.
O,1 ml krwi należy zmieszać z 9,9 ml 0,04% roztworu amoniaku (NH3). Do próbki dodać kilka kryształów dwutionianu sodu, całość dokładnie wymieszać, aż do momentu całkowitego rozpuszczenia się kryształów. W wyniku reakcji w próbce pojawia się fioletowe zabarwienie. Zmierzyć wartość absorbancji dla badanego roztworu względem wody przy długości fali rónej λ= 570 nm. Analogicznie wykonać oznaczenie z wzorcowym roztworem hemoglobiny. Na podstawie otrzymanych wyników należy obliczyć stężenie hemoglobiny w g/100 ml wg wzoru:
Hb[g/100 ml] = A(próba badana) / A(próba wzorcowa) • C(wzorca) [g/100 ml (%)] [9].
Ilościowe oznaczenie hemoglobiny metodą cyjanomethemoglobinową (wg Krawczyk J., 1967)
Hemoglobina w reakcji z odczynnikiem Drabkina przechodzi w trwałą pochodną cyjanową – cyjanomethemoglobinę. Maksimum jej absorbcji przypada na λ= 540 nm. Milimolowy wspólczynnik absorbcji przy tej długości fali ma wartość 44,0.
Wykonanie:
Do 5 ml odczynnika Drabkina (tj.: w kolbie rozpuścić 0,305 g K3[Fe(CN)6], 1 g NaHCO3, 00,5 g KCN- całość uzupełnić wodą do objętości 1000 ml), a następnie dodać 0,02 ml krwi. Po upływie 15 minutowej inkubacji należy odczytać wartość absorbancji (przy λ=540 nm) wobec odczynnika Drabkina.
Obliczenia: na podstawie otrzymanych wyników oblicza się stężenie hemoglobiny, przyjmując wartość 44 dla milimolowego współczynnika absorpcji (me) przy 540 nm.
Hb[g/100 ml] = A∙ masa molowa Hb ∙rozcieńczenie krwi/ me ∙10 ∙100 = A ∙64 ∙400 ∙251 / 44 ∙10 000 = A∙36,7 [10].
Hematyna
Hematyna zaliczana jest do pochodnych hemu, w budowie której wyróżnia się trójwartościowy atom żelaza (Fe3+). Związek ten powstaje z hemoglobiny bądź z hemu pod wpływem działania bardzo silnych związków utleniających. Krystalizacja hematyny jest niezbędnym składnikiem fizjologii pasożytów malarii. Uważa się, że leki przeciwmalaryczne mają zdolność hamowania krystalizacji, dzięki czemu pasożyty wystawione są na toksyczne działanie rozpuszczalnej hematyny. Dlatego też, poznanie mechanizmów hamowania krystalizacji hematyny jest kluczowe dla projektowania nowych leków [11].
Główną przeszkodą w badaniach mikroskopowych, spektroskopowych i krystalograficznych dotyczących krystalizacji hematyny były problemy z otrzymaniem dużych kryształów hematyny w warunkach identycznych, jakie stwarzają pasożyty malarii. Dzięki badaniom, Olafson KN. i wsp. (2014) opracowali biomimetyczną metodę powtarzalnego wzrostu dużych kryształów hematyny, osiągających długość 50 µm. W badaniach naśladowano wakuole trawienne pasożyta Plasmodium falciparum przez zastosowanie dwufazowego roztworu oktanolu i buforu cytrynowego. Pomiędzy fazą wodną i organiczną powstają „zarodki” kryształów, gdzie uporządkowane warstwy cząsteczek oktanolu służą jako substrat do tworzenia tychże „zarodków”. Powstałe „zarodki” przenoszone są następnie do oktanolu nasyconego hematyną w kontakcie z buforem cytrynowym. Kryształy rosną w warstwie organicznej (oktanol), gdy bufor dostarcza jony wodorowe niezbędne do wiązania cząsteczek hematyny w kryształy. Dostępność dużych cząsteczek hematynowych otwiera nowe możliwości dla badań hematynowej detoksykacji pasożytów malarii w erytrocytach gospodarza [11], [12].
Zdjęcie: Hematyna, http://www.sigmaaldrich.com/catalog/product/sigma/h3281?>
Otrzymywanie kwasowej hematyny (wg Kłyszejko-Stefanowicz L., 2003)
Wykonanie:
Jako materiał do doświadczenia wykorzystuje się 10x rozcieńczoną krew do której należy dodać kilka kropli 2 M roztworu kwasu solnego. W wyniku reakcji roztwór zmienia kolor na brunatny, co jest wynikiem zachodzącego rozkładu hemoglobiny (hemoglobina rozpada się na globine oraz kwasową hematynę). Z hematyny w obecności jonów Cl- powstaje chlorowodorek hematyny (znany jako hemina). Brunatne zabrawienie heminy może być wykorzystywane do oznaczania hemoglobiny [2].
Berczeller L.(1918) i Wu H. (1922) w swoich badaniach donosili, że pojawianie się zabarwienia w metodzie służacej do wykrywania kwasowej hematyny, związane jest z obecnością w osoczu niehemoglobinowych substancji. Wniosek ten spowodował,że Wu H. (1922) wprowadził swoją własną metodę oznaczania alkalicznej hematyny, jednakże metoda ta nigdy nie została dokładnie oceniona. Błędne wyniki w alkalicznej metodzie Wu H. (1992) uzyskiwano na różnych etapach badania nawet wtedy, gdy z osocza usuwano wszystkie potencjalne zanieczyszczenia, a analizę przeprowadzano na separowanych komórkach.
W swoich badaniach Ponder E. (1942) analizował błędy związane z alkaliczną metodą wprowadzoną przez Wu H. (1922). Jako materiał do badań wykorzystywano pełną krew ludzką lub upakowane czerwone krwinki (wirowane przez 2h z szybkością 4000 rpm/minutę). Oznaczanie hemoglobiny przeprowadzano w temperaturze pokojowej z wykorzystaniem metod służących do określania kwasowej i alkalicznej hematyny (jak to opisali Peters JP. i Van Slyke DD.,1932). Otrzymane wyniki porównywano z wynikami oznaczania hemoglobiny zmodyfikowaną metodą Wong’a (1942) na podstawie zawartości żelaza, zakładając, że hemoglobina zawiera 336 mg/dL żelaza [13]. Metoda oznaczania hematyny kwasowej w upakowanych erytrocytach nie była do końca wiarygodna, gdyż pojawiające się w trakcie oznaczenia zmiany zabarwienia, świadczące o zajściu reakcji zmieniały się w próbkach w różnych czasach i z różnym natężeniem. Wartości obliczanego stężenia hemoglobiny metodą kwasową nie były porównywalne do metody, gdzie na podstawie zawartości żelaza w próbce obliczano stężenie hemoglobiny. Próby wykrycia tych błędów podjął Peters i Van Slyke, opierając się na założeniu, że duże rozbieżności w oznaczaniu kwasowej hematyny są większe niż w metodzie oznaczania żelaza, ponieważ rozwijający się w próbkach kolor zależy od substancji innych niż hemoglobina. Stwierdzono, że osocze zawiera takie substancje jak lipidy i pigmenty, które wpływają na rozproszenie pochodnych hemoglobiny (hematyny) i ich absorpcję barw. Wniosek ten nie został ogólnie uznany, jednakże w doświadczeniach z hematyną alkaliczną usuwano osocze z komórek, co automatycznie powodowało zanik zakłóceń w metodzie [13].
Autor: Lidia Koperwas
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje