

|
Zamknij X
|
Azotany i azotyny w podwyższonych stężeniach wykazują negatywny wpływ na stan zdrowia człowieka. Związki te zmniejszają wartość odżywczą żywności poprzez destrukcję witamin z grupy A i B oraz obniżają przyswajanie białka z pożywienia. Niektóre składniki pożywienia mają zdolność zapobiegania niekorzystnemu działaniu azotynów jako prekursory związków N-nitrozowych, a wśród nich wymienia się białka, witaminę C i wapń [1].
Azotany (III) i azotany (V) są solami kwasów azotowych. Ich obecność stwierdza się w znacznych ilościach w środkach spożywczych oraz w wodzie, dlatego też jest to główne źródło narażenia na te związki dla człowieka. Obecność azotanów (V) w żywności (a szczególnie pochodzenia roślinnego) związane jest ze stosowaniem nawozów mineralnych (obecność w warzywach azotanów (V) jest wynikiem nadmiernego stosowania nawozów). Zawartość azotanów (III) w świeżych warzywach wynosi ok. kilku mg/kg, ale może ona wzrosnąć. Podczas przechowywania warzyw poprzez ograniczenie dostępu tlenu dochodzi do mikrobiologicznej redukcji azotanów (V) do azotanów (III). Ponadto azotany (V) i azotany (III) stosowane są w przetwórstwie mięsnym i serowarstwie, gdzie odpowiadają za nadawanie pożądanych właściwości sensorycznych tym produktom [11].
Obieg azotu w przyrodzie
Wolny azot krążący w atmosferze wiązany jest przez bakterie azotowe (bakterie symbiotyczne lub wolno żyjące). W wyniku ich działalności dochodzi do redukcji azotu do jonu amonowego. W zachodzącym w glebie procesie nitryfikacji jony amonowe ulegają utlenieniu do jonów azotynowych,a dalej azotyny przekształcane są do azotanów. Azotany absorbowane są przez rośliny i wbudowywane w ich białka. Poprzez łańcuchy pokarmowe azot dostaje się na wszystkie poziomy troficzne. Martwa materia organiczna łącznie z wydalanymi produktami przemiany materii rozkładane są w procesie amonifikacji, w wyniku czego powstaje amoniak. Amoniak znajdujący się w wodzie tworzy tzw. sole amonowe, a także jest pobierany przez rośliny i bakterie nitryfikacyjne. Proces przemiany wolnego azotu w azotany zostaje odwrócony w procesie denitryfikacji, dzięki czemu cykl krążenia azotu w przyrodzie zostaje zamknięty [5].
Wpływa azotanów i azotynów na organizm
W wyniku przeprowadzonych badań nad wpływem azotynów i azotanów na organizm ssaków stwierdzono, że toksyczność samych azotanów dla zwierząt jednożołądkowych oraz człowieka jest niewielka. Bardziej niekorzystny wpływ na organizm wywierają azotyny, które w porównaniu do azotanów wykazują od 6-10 razy większą toksyczność [5].
Badanie wpływu azotanów i azotynów na organizm żywy koncentruje sie głównie wokół zagadnień toksyczności ostrej. Nadmierne pobieranie z dietą związków azotanów i azotynów bądź też zachodząca redukcja azotanów do azotynów w organizmie człowieka może prowadzić do tzw. methemoglobinemii, tj. utlenienia dwuwartościowego żelaza hemoglobiny (Hb) do formy trójwartościowej. Forma ta nie ma zdolności odwracalnego wiązania tlenu. Wśród głównych objawów methemoglobinemii wyróżnia się m.in. sinicę, bóle brzucha, wymioty, biegunki, bóle i zawroty głowy, rozszerzenie obwodowych naczyń tętniczych czy spadek ciśnienia krwi [5],[10].
Toksyczne działanie azotynów i azotanów może również powodować niedokrwistość wywołaną uszkadzającym działaniem tych związków na krwinki czerwone, unieczynnienie witaminy B6, której niedobór jest pierwotną przyczyną niedokrwistości. Ponadto wśród ich negatywnego wpływu wymienia się też zahamowanie przyrostu masy ciała, które spowodowane jest zmniejszonym łaknieniem,a także wpływ na witaminę A, której obecność w organizmie jest niezbędna do prawidłowej budowy struktur komórkowych oraz syntezy białka. Azotany i azotyny są także prekursorami nitrozoamin, związków wykazujących działanie rakotwórcze i mutagenne [5].
Metoda riwanolowa do znaczanie małych ilości azotanów (III) i azotanów (V)
Rivanol (Riwanol, 6,9-diamino-2-etoksyakrydyna, Lactoacridine) znany również jako mleczan etakrydyny jest organicznym związkiem chemicznym należącym do grupy barwników akrydynowych. Tworzy pomarańczowo-żółte kryształki o charakterystycznym zapachu [8]. Rivanol jest żółtą substancją łatwo rozpuszczalną w wodzie, o pH w zakresie 5,5 – 7,5. Reaguje z mocnymi środkami utleniającymi, a stabilność wykazuje w normalnych warunkach otoczenia [7]. Związek ten wykazuje silne właściwości antyseptyczne, dlatego też w medycynie stosowany jest do niszczenia paciorkowców, gronkowców, grzybów i pierwotniaków. Ma zastosowanie doustne i zewnętrzne (płukanki, okłady, przemywanie). Przeciwwirusowe i przeciwbakteryjne działanie riwanolu spowodowane jest przyłączaniem etakrydyny do kwasów nukleinowych (DNA), przez co następują letalne mutacje [6].
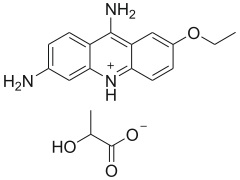
Zdjęcie: wzór riwanolu (mleczan etakrydyny), C18H21N3O4
http://zwiazki-chemiczne.rolnicy.com/component/content/article/68-zwiazek/3607-rywanol.html
Zasada metody riwanolowej polega nareakcji azotynów (III) z solą etakrydyny. W wyniku reakcji powstaje barwny związek. Zawartość azotynów (III) w próbce określa się spektrofotometrycznie metodą krzywej wzorcowej. W tym celu mierzy się absorbancję próbki badanej w zakresie długości fali od 580 do 600 nm. Metoda pozwala na oznaczanie zawartości azotanów (III) lub sumy azotanów (III) i azotanów (V) po wcześniejszej redukcji azotanów (V) do azotanów (III) kadmem metalicznym [2], [3], [4].
Wykonanie:
Jako materiał badawczy należy wykorzystać np. próbkę shomogenizowanego mięsa o masie 50 g.
Próbkę badaną należy przenieść do zlewki o poj. 500 cm3,po czym dodać ok. 300 cm3 wody wraz z 3 cm3 25% roztworu Na2CO3. Próbkę inkubować przez 30 minut (często mieszając). Po wymieszaniu zawartości zlewki należy przesączyć przez sączek karbowany, zbierając przesącz do kolby miarowej o pojemności 500 cm3. Otrzymaną próbkę dopełnić wodą destylowaną do kreski, dokładnie wymieszać i przenieść 50 cm3 do suchej zlewki (o poj. 100 cm3 ). Przeprowadzić redukcję azotanów (V) do azotanów (III) poprzez dodanie kadmu metalicznego (roztwór można również przepuścić przez kolumnę z kadmem). Otrzymany przesącz dokładnie wymieszać i przesączyć. Tak otrzymany roztwór należy przenieść do kolby miarowej (o pojemności 100 cm3 ) i uzupełnić wodą destylowaną do kreski. W przypadku oznaczania zawartości azotanów (III) cały etap redukcji próbki kadmem metalicznym można pominąć.
Otrzymany powyższym sposobem przesącz powinien być klarowny i bezbarwny. 20 cm3 przesączu przenieść do kolby miarowej o pojemności 50 cm3, dodać 1 cm3 10% roztworu kwasu solnego (HCl) oraz 5 cm3 0,1% roztworu soli etakrydyny. Całość próbki należy uzupełnić wodą destylowaną do kreski i dokładnie wymieszać. Ostatnim etapem jest pomiar absorbancji przygotowanego roztworu przy długości fali w zakresie 580 – 600 nm (mierzyć po 5 minutach) [2], [3], [4].
Przygotowanie krzywej wzorcowej do oznaczenia
Korzystając ze wzorca zaw. 100 ppm NO2- należy sporządzić roztwory wzorcowe, w taki sposób by stężenie końcowe azotanu (III) znajdowało się w zakresie od 0 do 10 ppm (4-5 roztworów wzorcowych wraz z próbę kontrolną- ślepa próba).
W tym celu do kolbki miarowej o poj. 50 cm3 należy dodać wcześniej wyliczoną ilość wzorca, 1 cm3 10% roztworu kwasu solnego oraz 5 cm3 0,1% roztworu etrakrydyny. Całość uzupełnić wodą destylowaną do kreski i dokładnie wymieszać. Zmierzyć absorbancję próbek po 5 minutach przy długości fali λ= 580-600 nm wobec próby ślepej (nie zawierającej jonów NO2-) [2], [3], [4].
Oznaczanie azotynów (V) w środowisku kwaśnym [5].
Azotyny w silnie kwaśnym środowisku (pH= 2.0 – 2.5) wchodzą w reakcję z kwasem sulfanilowym w wyniku czego tworzone są związki azoniowe:
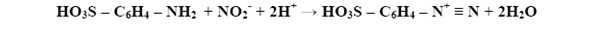
Związki azoniowe ulegają reakcji z 1-naftyloaminą w wyniku czego powstaje dwufazowy fioletowy barwnik. Natężenie barwy jest wprost proporcjonalna do stężenia azotu azotynowego w próbce. Ograniczeniem zastosowania tej metody jest oznaczanie próbki, w której obecne są czynniki przeszkadzające takie jak: aminy alifatyczne, chlor wolny i chlor związany. Opisana reakcja zachodzi wg zasady:
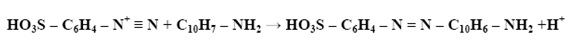
Pomiar absorbancji wykonuje się przy długości fali równej λ=520 nm. Zawartość azotu azotynowego w próbce odczytuje się z krzywej wzorcowej, a otrzymane danie podstawia się do odpowiedniego wzoru [5].
Metody kolorymetryczne opierają się na zdolności jonów NO2- oraz NO3- do tworzenia barwnych związków z różnymi odczynnikami. Zasada wykonywania metod spektrofotometrycznych opiera się na pomiarze absorbancji przy określonej długosci fali światła widzialnego w badanym roztworze. W wyniku reakcji z kwasem sulfanilowym i N-(1-naftylo)etylenodiaminą powstaje barwnik diazoniowy. Intensywność powstałej w wyniku reakcji czerwono-różowej barwy mierzy się przy długosci fali równej λ=538 nm. Oznaczenie zawartości azotanów(V) przeprowadza się w podobny sposób, jednak wcześniej należy przeprowadzić redukcję metalicznym kadmem jonów NO3- do NO2- [11].
Zastosowanie metody kolorymetrycznej do oznaczania azotanów (V) w wodzie z salicylanem sodu
Metoda oparta jest na reakcji azotanów (V) z salicylanem sodu, która zachodzi w środowisku stężonego kwasu siarkowego (Vl). W wyniku reakcji nitrowania powstaje kwas nitrosalicylowy, który po zalkalizowaniu przechodzi w postać zdysocjowaną, wykazując intensywne żółte zabarwienie. Zawartość w próbce azotanów(V) określa się spektrofotometrycznie przy przy długości fali równej λ= 410 nm. Metoda ma zastosowanie w oznaczaniu azotanów(V) w wodzie oraz ściekach przy stężeniu większym niż 0,1mg NO3-/dm3 [9].
Wykonanie:
1) Do parownicy należy odmierzyć 10 cm3 badanej wody. Do próbki dodać 2-3 krople 0,5% roztworu NaOH i 1 cm3 0,5% roztworu salicylanu sodu (C7H5O3Na).
2) Na wrzącej łaźni wodnej należy odparować zawartość parownicy, po czym do suchej pozostałości dodać 1 cm3 stężonego kwasu siarkowego (kwas rozprowadzić po ściankach parownicy z widocznym białym osadem).
3) Po ok. 10 min.inkubacji do próbki dodać 20 cm3 wody destylowanej, całość dokładnie wymieszać i przenieść roztwór ilościowo do cylindra Nesslera.
4) Do próby dodać 7 cm3 alkalicznego roztworu winianu sodowo-potasowego (tj. rozpuścić 400 g wodorotlenku sodu w 500 cm3 wody destylowanej (roztwór a) oraz rozpuścić 60 g winianu sodowo-potasowego NaK(C4H4O6) ∙ 4H2O w ok. 200 cm3 wody destylowanej (roztwór b), następnie zmieszać oba roztwory (a i b) w kolbie miarowej o pojemności 1 dm3 i uzupełnić wodą destylowaną do kreski).
5) Rozpuścić i uzupełnić wodą destylowaną do objętości 50 cm3.
6)Zmierzyć absorbancję barwnego roztworu przy długości fali λ=410 nm, stosując roztwór próby zerowej jako odnośnik [9].
Przygotowanie wzorcowego roztworu roboczego i podstawowego azotanu potasu (KNO3)
a) Roztwór wzorcowy podstawowy
W kolbie miarowej o pojemności 1 dm3 (wysuszonej do stałej masy w temp. 105°C) należy rozpuścić w wodzie destylowanej 0,7216 g azotanu (V) potasu, próbkę uzupełnić wodą destylowaną do kreski . Całość dokładnie wymieszać. 1 cm3 przygotowanego roztworu zawiera 0,1 mg azotu azotanowego [9].
b) Roztwór wzorcowy roboczy
Do parownicy należy odmierzyć 10 cm3 roztworu wzorcowego podstawowego, dodać 2-3 krople 0,5% roztworu wodorotlenku sodu oraz 20 cm3 roztworu salicylanu sodu. Na wrzącej łaźni wodnej odparować zawartość parownicy do sucha, po czym parownicę wystudzić. Do suchej pozostałości dodać 1 cm3 stężonego kwasu siarkowego (kwas rozprowadzić po ściankach parownicy z widocznym białym osadem). Po ok. 10-minutowej inkubacji do próbki dodać 30 cm3 wody destylowanej i dokładnie wymieszać. Przygotowany roztwór przenieść ilościowo do kolby miarowej o poj. 100 cm3, dopełnić wodą do kreski i wymieszać. 1 cm3 przygotowanego w ten sposób roztwóru zawiera 0,01 mg azotu azotanowego [9].
Przygotowanie krzywej wzorcowej (krzywa wzorcowa zależności mierzonej wartości absorbancji barwnego kompleksu w funkcji stężenia azotanów w mg NO3)
Przygotować 7 cylindrów Nesslera o poj.50 cm3, do których kolejno wprowadzić : 0,0 (próba zerowa); 0,3; 0,5; 0,7; 1,0; 2,0 oraz 4,0 cm3 roztworu wzorcowego roboczego azotanu potasu. Do każdego wzorca roboczego dodać po 7cm3 alkalicznego roztworu winianu sodowo-potasowego,po czym uzupełnić wodą destylowaną do kreski i dokładnie wymieszać. Przygotowane w ten sposób roztwory zawierają odpowiednio: 0,00; 0,003; 0,005; 0,007; 0,01; 0,02 oraz 0,04 mg azotu azotanowego. Zmierzyć absorbancję barwnego roztworu przy długości fali równej λ=410 nm, stosując roztwór próby zerowej jako odnośnik [9].
Obliczenie azotu azotanowego (V)
Zawarość azotu azotanowego (V) oblicza się w mg/dm3 wg wzoru:
X= (m*1000)/ V
Gdzie:
m - zawartość azotu azotanowego (V) w badanej próbce (mg)
V- objętość próbki użyta do oznaczania (cm3) [9].
Oznaczanie zawartości azotanów (V) i azotanów (III) w tkankach mięsa metodą kolorymetryczną z odczynnikiem Griessa
Odczynnik Griessa to roztwór kwasu sulfanilowego i α-naftyloaminy w kwasie octowym. Roztwór ten stosowany jest w kolorymetrycznej analizie azotynów (jonów NO2-). W wyniku reakcji z odczynnikiem powstaje barwnik azowy, który nadaje próbce różowy kolor (lub przy większym stężeniu azotynów- kolor czerwony).
Wykonanie:
Odważyć 12,5 g dobrze zhomogenizowanej próbki badanej (np. próbki mięsa) na wadze analitycznej z dokładnością (±0,01 g). Próbkę przenieść do kolby miarowej o poj. 250 ml, dodać 5 ml nasyconego roztworu tetraboranu sodu (Na2B4O7 ·10 H2O) i ok. 150 ml gorącej wody destylowanej. Całość dobrze wymieszać, po czym ogrzać na łaźni wodnej (temp. ok. 90-100°C) przez 15 minut. Po zakończeniu ogrzewania do próbki dodać kroplami 1 ml roztworu Carreza II (tj. 300 g siarczanu (VI) cynku w 1 dm3 wody) energicznie mieszając. Ochłodźić zawartość kolby i dodać wody destylowanej do kreski miarowej. Zimny roztwór należy przesączyć do szklanej zlewki, po czym za pomocą pipety przenieś 20 ml tego roztworu do kolby miarowej o pojemności 100 ml. Na koniec do próbki dodać 25 ml rozcieńczonego roztworu amoniaku (25% NH3 rozcieńczony w stosunku 1:4 wodą destylowaną) oraz 10 ml roztworu kwasu solnego (0,1 mol/dm3),dopełnić zawartość kolby miarowej do kreski za pomocą wody destylowanej [11].
Oznaczanie azotynów (III)
Należy przygotować roztwory do pomiarów bezpośrednio w kuwetach pomiarowych wg tabeli:
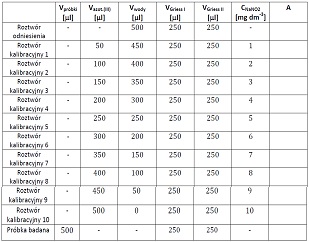
Zdjęcie: Kolejność dodawania odczynników do pomiaru absorbancji w oznaczaniu azotanów (III) metodą kolorymetryczną, [11].
Po dodaniu odczynników do poszczególnych kuwet (roztwór odniesienia- próba kontrolna, kuwety 1-10 oraz próbka badana) należy ich zawartość delikatnie wymieszać pipetą i pozostawić na 15 minut. Po upływie czasu inkubacji zmierzyć absorbancję roztworów przy długości fali λ=538 nm za pomocą spektrofotometru. Na podstawie uzyskanych wyników należy wykreślić krzywą kalibracyjną przedstawiającą zależnośc absorbancji od stężenia NaNO2. Z wykreślonej krzywej odczytać stężenie jonów azotanowych (III) w próbce i obliczyć zawartość azotanów (III) w wyjściowej próbce produktu mięsnego. Otrzymane wartości porównuje się z obowiązującymi normami [11].
Autor: Lidia Koperwas
Literatura:
[1]. Markowska A., Furmanek W., Gackowska L., Siwek B., 1999. Zawartość azotanów i azotynów w całodziennych racjach pokarmowych ludzi dorosłych. ROCZ.PZH, 1999, 50, NR 3, 299-306. http://books.google.pl/books?id=zVuQ3IaxpLEC&pg=PA297&lpg=PA297&dq=azotany+i+azotyny+oznaczanie&source=bl&ots=xuyqGfX6hY&sig=hFkg29B0rlkQyNxRQ2SlvXLFwuY&hl=pl&sa=X&ei=QfhdVPHdE9Xvat-3gbgB&ved=0CEQQ6AEwBjgK#v=onepage&q=azotany%20i%20azotyny%20oznaczanie&f=false
[2]. Ćwiczenia z Chemii Leków, Cześć I i II, Wyd. Akademii Medycznej w Krakowie, Kraków 1985
[3]. Tajner-Czopek A., Kita A., 2005. Analiza żywności - jakość produktów spożywczych, Wydawnictwo Akademii Rolniczej we Wrocławiu.
[4]. www.zcha.pwr.wroc.pl/chc4172l/cw11.doc
[5]. ununokt.ovh.org/share/APS/spr7.doc
[6]. http://www.luskiewnik.eu/antisepticum.htm
[7]. http://galfarm.com.pl/files/upload/etakrydyny_mleczan,_rivanol_-aktualizacja.pdf
[8].http://zwiazki-chemiczne.rolnicy.com/component/content/article/68-zwiazek/3607-rywanol.html
[9]. Monitoring i ocena środowiska. Badanie zawartości związków azotu (oznaczanie azotu azotanowego (V) metodą kolorymetryczną). http://www.chemia.uni.lodz.pl/kchogin/dydaktyka/monitoring_srodowiska/pdf/L2.pdf
[10]. Markowska A., Kotkowska A., Furmanek W., Gackowska L., Siwek B., Kacprzak-Strzałkowska E., Błonska A., 1995. Badania zawartości azotanów i azotynów w wybranych warzywach surowych oraz poddanych obróbce termicznej. ROCZ.PZH, 1995, XLVI, NR 4.
[11]. Oznaczanie azotanów (III) i azotanów (V) w produktach mięsnych metodą spektrofotometryczną. http://webcache.googleusercontent.com/search?q=cache:LBRjQWAUmbAJ:jniziol.sd.prz.edu.pl/file/MjMsNjcsMzc0NSxiaW9jaGVtaWFfYXpvdGFueV9pbnN0cnVrY2phLnBkZg%3D%3D+&cd=1&hl=pl&ct=clnk&gl=pl&client=firefox-a
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje