

|
Zamknij X
|
Największym źródłem azotanów w żywności są warzywa. Ich obecność jest zjawiskiem naturalnym wynikającym z procesu nawożenia azotowego roślin. Z racji tego, że azotany są szybko wydalane z organizmu, stanowią niewielkie zagrożenie dla człowieka. Ich szkodliwość wzrasta dopiero po redukcji do azotanów (III), co zazwyczaj ma miejsce po zbiorze warzyw, a także w przewodzie pokarmowym człowieka. Zawartość azotanów (III) i azotanów (V) w produktach spożywczych zależy od kilku czynników: gatunku rośliny,czynników środowiskowych,nawożenia azotowego, typu gleby czy terminu zbioru [1], [4].
Azotany (V) gromadzą się głównie w warzywach korzeniowych np. burak ćwikłowy, marchwi oraz w warzywach liściastych o krótkim okresie wegetacji, w tym np. w szpinaku [4]. Z kolei, azotany (III) w warzywach mogą tworzyć się podczas składowania i przechowywania w zamkniętych opakowaniach foliowych. Najczęściej powstają w warzywach przechowywanych w pomieszczeniach, które są niechłodzone lub w warzywach uszkodzonych (na skutek uszkodzenia tkanki) z zachodzącymi procesami gnilnymi [4]. Największe ilości azotanów występują w młodych roślinach. Jednym ze sposób zmniejszania zagrożeń zdrowotnych jest rozwój rolnictwa ekologicznego i zmiana nawyków żywieniowych. Co ciekawe, pomimo mniejszych ilości zanieczyszczeń chemicznych w roślinach pochodzących z gospodarstw ekologicznych niż konwencjonalnych, w porównaniu z dietą tradycyjną większe ilości azotanów wykrywane są w diecie wegetariańskiej [1].
Azotany (V) i (III) przedostają się do organizmu człowieka głównie z żywnością i wodą do picia. Związki te wpływają na wykorzystanie witamin, białek, węglowodanów i tłuszczów zawartych w pożywieniu [3]. W wodach powierzchniowych azotany występują zwykle w niewielkich stężeniach, stanowiąc najwyższy stopień utlenienia związków organicznych i nieorganicznych. W znacznych ilościach azotany identyfikowane są także w ściekach po biologicznym oczyszczeniu, z kolei obecność azotanów wodach powierzchniowych wiąże się z doprowadzeniem ze ścieków miejskich i przemysłowych, z odwodnień kopalń bądź wskutek spływu wody z pól, na których stosowano sztuczne nawożenie [8].
Droga azotanów i azotynów w organizmie
Przeprowadzone badania potwierdziły, że w oparciu o jonowe mechanizmy transportu aniony azotanowe oraz azotynowe mogą być wchłaniane w żołądku, jelicie, tarczycy oraz gruczołach ślinowych. Po wchłonięciu do krwi azotany oraz azotyny transportowane są do wątroby, gdzie ulegają utlenianiu do azotanów i w tej postaci zostają wydalone z organizmu. W przypadku np. infekcji bakteryjnej pęcherza moczowego, azotany i azotyny wydalane są z moczem w postaci azotynów. Jest jedyny przypadek kiedy to jon azotynowy może być wydalony z organizmu. Azotany i azotyny wchłonięte do organizmu ssaków mogą ulegać recylkulacji w następstwie przeniknięcia z krwi do gruczołów ślinowych, następnie ze śliną związki te ponownie przedostają się do odcinka żołądkowo-jelitowego w przewodzie pokarmowym, gdzie ulegają ponownemu wchłanianiu. Azotyny obok związków N-nitrozowych zostały sklasyfikowane jako czynniki, które zwiększają ryzyko raka żołądka i raka jelita grubego u ludzi [2].
Tlenek azotu (NO)
Analiza jonów NO2- i NO3- powstających w metabolizmie tlenku azotu, pozwala na badania nad jego uczestnictwem w wielu fizjologicznych i patofizjologicznych procesach, takich jak rozkurczanie mięśni gładkich,regulacje immunologiczne organizmu, arterioskleroza, nadciśnienie tętnicze czy cukrzyca. Tlenek azotu powstaje w organizmach żywych w małych ilościach i bardzo szybko zostaje utleniony do azotynów i azotanów. Dlatego też, bezpośrednie oznaczenie NO jest problematyczne, a jednym z elementów badań metabolizmu tlenku azotu w próbkach tkanek jest określanie stosunku NO2- /NO3- [5].
Tlenek azotu (NO) produkowany jest w organizmach zwierząt przez 3 odrębne formy enzymu znanego jako syntaza tlenku azotu (NOS). Tak więc, w organizmie powstają dwie konstytutywne formy tlenku azotu: neuronalna (nNOS — NOS I) i śródbłonkowa (eNOS — NOS III), które zależne są od jonów wapnia i stymulowane są za pośrednictwem kalmoduliny oraz tzw. forma indukowana (iNOS — NOS II) [6].
Tlenek azotu a kancerogeneza
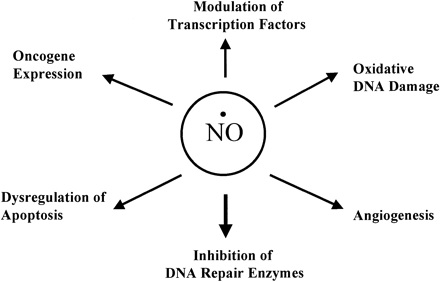
Zdjęcie: Rola tlenku azotu (NO) w karcinogenezie, http://ajpgi.physiology.org/content/281/3/G626
Obecność azotanów w wodach pitnych musi być ograniczona, ponieważ mogą one powodować wiele niekorzystnych zjawisk, w tym sinicę u niemowląt (methemoglobinemia) czy nowotwory układu pokarmowego u ludzi i zwierząt. W związku z tym, zawartość azotynów w wodach do picia musi być ściśle kontrolowana. Jednocześnie azotany i azotyny są wykorzystywane jako dodatki do produktów żywnościowych, które odpowiadają m.in. za zabezpieczenie żywności przed skażeniem biologicznym. Niestety związki te mogą też reagować in vivo z aminami tworząc kancerogenne nitrozaminy, co z kolei wymusza określanie zawartości azotynów i azotanów w żywności, podobnie jak w wodzie do picia. Powszechne występowanie w środowisku jonów NO2- i NO3- sprawia, że monitorowanie ich stężeń w próbkach wody jest dość trudne [5].
Analiza azotanów w wodzie
Wśród głównych metod oznaczania jonów NO2- i NO3- znajdują się te oparte na technikach spektroskopowych (podobnie jak klasyczna metoda Griessa). Niestety, procedury te są czasochłonne, a dodatkowo bardzo podatne na różnego rodzaju interferencje. Ponadto mogą być niemożliwe do zastosowania dla niektórych próbek żywności i próbek biologicznych, gdyż często wiąże się to z problemami związanymi z otrzymaniem klarownych roztworów do końcowego pomiaru. Problem stanowi też obecność innych jonów (np. chlorkowych) występujących zwłaszcza w próbkach biologicznych. Czułość metody w stosunku do jonów azotynowych jest stosunkowo niska, a śladowy poziom tych jonów w próbkach bardzo często jest niemożliwy do wykrycia. Dlatego też, bardzo przydatną metodą jest wysokosprawna chromatografia cieczowa (HPLC). HPLC jest metodą szybszą, czulszą i bardziej selektywną niż metody oparte na oznaczeniach kolorymetrycznych [5]. Na przestrzeni kilku lat opracowano wiele metod rozdzielania i detekcji anionów nieorganicznych z wykorzystaniem chromatografii jonowymiennej lub chromatografii odwróconych faz i par jonowych przy wykorzystaniu detekcji anionów za pomocą detektora konduktometrycznego, odwróconej detekcji UV, absorpcyjnych detektorów promieniowania UV czy detektorów chemiluminescencyjnych i detektorów elektrochemicznych. Analizę azotanów w wodzie pitnej najczęściej przeprowadza się stosując wysokosprawną chromatografię jonowymienną (IC-HCLP) [5].
Oznaczanie zawartości azotanów (V) i (III) metodą kolorymetryczną w próbkach pochodzenia roślinnego
W metodzie tej wykorzystywany jest odczynnik Griessa, a pomiar wykonywany jest przy długości fali równej λ=538 nm. W reakcji wykorzystywana jest bezpośrednia redukcja azotanów (V) do azotanów (III) za pomocą metalicznego kadmu. Na początkowym etapie oznaczania, próbę wytrząsa się z węglem aktywnym, w celu usunięcia zabarwienia pochodzącego z chlorofilu. W trakcie doświadczenia dokonuje się pomiaru pH w zhomogenizowanej miazdze (próbka roślinna) z wykorzystaniem pH-metru. Oznaczanie ekstraktu ogólnego wykonuje się metodą refraktometryczną [4].
Metoda kolorymetrycznego oznaczania azotanów w próbkach wody
Zasada metody:
W środowisku stężonego kwasu siarkowego jony azotanowe ulegają reakcji z salicylanem sodu. Produktem reakcji jest mieszanina kwasów: 3-nitrosalicylowego i 5-nitrosalicylowego, których sole w środowisku alkalicznym wykazują żółte zabarwienie. Bez konieczności rozcieńczania (bądź zatężania) próbki wody za pomocą metody kolorymetrycznej można oznaczać azotany znajdujące się w stężeniach: od 0,02 –4,5 mg/dm3 NNO3. W prawidłowym oznaczaniu azotanów przeszkadzają: mętność znajdująca się powyżej poziomu 30 mg/dm3 O2, żelazo w ilościach powyżej 5 mg/dm3 Fe oraz chlorki w stężeniach powyżej 200 mg/dm3 [9].
Przygotowanie roztworów wykorzystywanych podczas oznaczenia próbek wody
0,7216 g azotanu potasu wysuszonego wcześniej w 105°C do stałej masy należy rozpuścić w wodzie destylowanej,a dalej dodać 1 cm3 chloroformu. Kolbę dopełnić wodą destylowaną do 1 dm3. W 1 cm3 tak przygotowanego roztworu zawarte jest 0,1 mg azotu azotanowego (V) [9].
Z podstawowego roztworu wzorcowego azotanu (V) potasu pobrać 10 cm3 do parownicy, dodać 2-3 krople 0,5 % roztworu NaOH i 20 cm3 roztworu salicylanu sodu. Odparować mieszaninę w parownicy do sucha na łaźni wodnej. Do suchej pozostałości dodać 1 cm3 roztworu H2SO4 (rozprowadzić go po ściankach w miejscach z białym osadem). Inkubować 10 minut, a dalej do parownicy dodać ok. 30 cm3 wody destylowanej. Całość dokładnie wymieszać i przenieść ilościowo do kolby miarowej o poj. 100 cm3 (dopełnić wodą destylowaną do kreski). Przygotowany roztwór w 1 cm3 zawiera 0,01 mg azotu azotanowego (V) [9].
Przygotować 10 kolb miarowych, do których kolejno odmierzyć odpowiednie ilości roboczego roztworu wzorcowego azotanu (V) potasu, tj.: 0,0; 0,2; 0,3; 0,5; 0,7; 1,0; 2,0; 3,0; 4,0 i 5,0 cm3. Do każdej z kolb odmierzyć po 7 cm3 alkalicznego roztworu winianu i potasu. Całość dopełnić wodą destylowaną do kreski i dokładnie wymieszać . Przygotowane wzorce zawierają następujące ilości NNO3: 0,00; 0,002; 0,003; 0,005; 0,007; 0,01; 0,02; 0,03; 0,04; 0,05 mg.
Każdy z roztworów przelać kolejno do kuwety i dokonać pomiaru absorbancji (przy długości fali λ= 436 nm). W trakcie wykonywania oznaczenia jako odnośnik należy wykorzystać roztwór wzorcowy (przygotowany jako pierwszy – pierwsza kolba) [9].
W trakcie pomiaru absorbancji w zależności od wyników zawartości azotanów w próbce należy wykorzystywać kuwety pomiarowe o różnej grubości warstwy absorpcyjnej, i tak:
Wykonanie oznaczenia:
W parownicy porcelanowej umieścić taką ilość przygotowanej próbki wody, by zawartość w niej NNO3 mieściła się w granicach 0,002 –0,05 mg. Do próbki dodać 2 –3 krople 0,5% roztworu wodorotlenku sodu i 1 cm3 0,5% roztworu salicylanu sodu. Zawartość parownicy odparować do sucha na łaźni wodnej, pozostawić do ostygnięcia. Zwilżyć suchą pozostałość za pomocą 1 cm3 kwasu siarkowego (VI) (kwas należy rozprowadzić po ściankach parownicy w miejscach pokrytych osadem). Próbkę inkubować przez 10 minut, a dalej rozcieńczyć 20 cm3 wody destylowanej. Do próbki dodać 7 cm3 alkalicznego roztworu winianu sodu i potasu (tj.: 400 g NaOH i 60 g winianu sodu i potasu rozpuścić w wodzie destylowanej, ostudzić i rozcieńczyć do objętości 1 dm3 wodą destylowaną, dokładnie wymiesza). Całość przenieść ilościowo do kolby miarowej, uzupełnić wodą destylowaną do kreski i dokładnie wymieszać. Oznaczać absorbancję przy długości fali λ = 436 nm, stosując odpowiednią kuwetę, a jako odnośnik zastosować próbkę kontrolną (przygotowaną jak pierwszy wzorzec).
Zawartość azotu azotanowego (V) w badanej próbce należy odczytać z przygotowanej wcześniej krzywej kalibracyjnej, stanowiącej zależność zmierzonej absorpcji [AU] od ilości azotu azotanowego w próbce [mg].
Stężenie azotu azotanowego w wodzie obliczyć stosując poniższy wzór:
X= a * 1000 / V mg/dm3 NNO3
gdzie:
a - ilość azotu azotanowego w próbce określona na podstawie krzywej kalibracyjnej [mg]
V – objętość próbki wody użytej do oznaczania [cm3] [9].
Gotowy test do kolorymetrycznego oznaczania azotanów (wg instrukcji ze strony: http://www.perfectwater.com.pl/instrukcje/Testoval%20AZOTANY%20instrukcja.pdf)
Na rynku dostępne są gotowe testy do kolorymetrycznego oznaczania azotanów. Oznaczenie można wykonywać w zakresie od 0 do 20 mg/l NO3-. Testy te są niezwykle przydatne, ponieważ skracają całkowity czas pomiaru do kilku minut [10].
Wykonanie oznaczenia z wykorzystaniem gotowego zestawu odczynników (http://www.perfectwater.com.pl/instrukcje/Testoval%20AZOTANY%20instrukcja.pdf)
Szklaną probówkę napełnić badaną wodą do górnej podziałki o wartości 10 ml. Następnie dodać dwie czubate miarki (łyżeczka czerwona) odczynnika A oraz dwie pełne łyżeczki odczynnika B. Probówkę natychmiast zatkać korkiem i obracać probówkę przez 60 sekund (obracać ok. 30 razy probówką –korkiem w dół i do góry). Nie wstrząsać! Po upływie 1 minuty zamkniętą probówkę pozostawić na 6-minutową inkubację. Po tym czasie z kasetki kolorymetrycznej (dołączonej do zestawu) wyjąć kwadratowy pojemniczek, napełnić go wodą uprzednio wymieszaną z odczynnikami A i B, po czym pojemnik włożyć z powrotem do kasetki kolorymetrycznej (w celu porównania barw i odczytania wyniku)- w tym celu kasetkę ustawić pod światło lub na białym tle. Barwę ze środkowego pola należy porównać z polami zewnętrznymi, które oznaczone są różnymi wartościami. Wynikiem przeprowadzonego oznaczenia będzie wartość z pola zewnętrznego i najbardziej zbliżonego barwą do barwy pola środkowego [10].
W przypadku, gdy podczas przygotowywania próbki wody z odczynnikami w probówce pojawi się barwa mocno czerwona lub zmętnienie próbki oznacza to, że zawartość azotanów w badanej próbce przekracza zakres pomiarowy przyrządu [10]. W celu oznaczenia próbki należy postąpić następująco:
probówkę należy przemyć wodą destylowaną, po czym napełnić ją do wysokości 1 ml (na podziałce probówki) badaną próbką wody. Całą próbkę uzupełnić do poziomu 10 ml wodą destylowaną, po czym dodać odczynniki A i B (w ilości jak wyżej). Wszystkie pozostałe czynności wykonywać w identyczny sposób jak opisano powyżej [10]. W przypadku występowania w próbce ilości azotanów przekraczających zakres pomiarowy przyrządu wynik pomiaru należy pomnożyć przez liczbę 10 (wówczas oznaczy się właściwą zawartość azotanów w badanej próbce wody) [10].
Zespół wstrzykowych analizatorów przepływowych do równoległego oznaczania azotynów i azotanów (zestaw firmy MLE)
Oprócz gotowych zestawów odczynników na rynku dostępne są specjalnie zaprojektowane analizatory wykorzystywane do równoległego oznaczania azotynów i azotanów w próbce. Analizatory mają konstrukcję modułową i kompaktową, wyposażone są w ośmioportowe zawory wstrzykowe z dwiema pętlami o różnych pojemnościach oraz sześciokanałowe pompy perystaltyczne i fotometry z dwoma sensorami. Cała zaawansowana konstrukcja analizatora zapewnia dużą stabilność sygnału analitycznego. Wstrzykowe analizatory przepływowe pozwalają na oznaczenie w prosty, a zarazem równoległy sposób stężenia azotanów i azotynów mieszczące się w zakresie od 0,2 mg/L N-NO2 i N-NO3.
Zasada metody oznaczania azotynów polega na tworzeniu soli diazowej, która powstaje w wyniku reakcji azotynów z sulfanilamidem. Sól diazowa ulega sprzężeniu z N-(1-naftylo-)-etylenodiaminą w wyniku czego powstaje barwnik azowy. Oznaczanie azotanów w próbce polega na ich wcześniejszym oddzieleniu od matrycy na membranie dializatora, a następnie redukcji w kolumnie kadmowej do azotynów. Reakcja zachodzi w środowisku buforu imidazolowego w pH=7,5. Azotyny oznaczane są w sposób opisany powyżej [12].
Próba fenoloftaleinowa na wykrywanie HNO3 i jego soli [11].
Jony azotanowe NO3- odbarwiają fenoloftaleinę zabarwioną w kwasie siarkowym, z kolei sole kwasu azotowego przeprowadzają powyższą reakcję w obecności nadtlenku wodoru (H2O2). Wykorzystując tę zasadę możliwe jest oznaczanie śladowych zanieczyszczeń w kwasie siarkowym lub innych substancjach pochodzących od kwasu azotowego i azotynów, a oznaczenie można przeprowadzać w stosunku 1: 1500 000. Z wykorzystaniem tej próby możliwe jest również oznaczanie mniejszych zanieczyszczeń, co ujawnia się nie całkowitym, a częściowym odbarwieniem fenoloftaleiny [11].
Wykonanie:
1 g azotynu rozpuścić w 500 ml wody, a y otrzymanego roztworu pobrać 1 kroplę i wprowadzić do 100 ml stężonego kwasu H2SO4. Z tak zanieczyszczonego roztworu kwasu pobrać kolejne 4 ml (przed każdym pobraniem wytrząsnąć roztwór macierzysty) i dodać do nich 1 kroplę 0,05% alkoholowego roztworu fenoloftaleiny. Powstająca w próbce różowa barwa fenoloftaleiny znika po dodaniu 1 kropli 0,25% roztworu nadtlenku wodoru (H2O2) [11].
Stężony roztwór nadtlenku wodoru może i bez pomocy azotynu odbarwić fenoloftaleinę (np. kropla 15% H2O2 odbarwia ją po 2 godzinach) dlatego ważne jest dobranie takich rozcieńczeń nadtlenku wodoru, które nie mogą samodzielnie przeprowadzić opisanej reakcji. Czułość opisanej próby fenoloftaleinowej na wykrywanie kwasu HNO3 i jego soli wzrasta dzięki zastosowaniu w doświadczeniu H2O2. W tym celu najlepiej przygotowywać odczynnik do wykrywania śladowych zanieczyszczeń HNO3 i jego soli w H2SO4 wg przepisu: 50 ml 0,05% alkoholowego roztworu fenoloftaleiny zmieszać z 1 kroplą perhydrolu. Dzięki temu przeprowadzona próba jest czulsza od niespecyficznej próby dwufenyloaminowej, ponieważ 1 kropla odczynnika (odbarwienie) może wykryć w obj. 4 ml kwasu siarkowego około 0,00005% HNO3 lub jego soli. Niestety powyższe oznaczenie nie może być wykorzystywane do oznaczania azotynów i azotanów w substancjach zabarwiających stężony kwas siarkowy [11].
Oznaczanie azotynów i azotanów (wg Garbuliński T., 1955)
Jeżeli barwa w próbce zniknie przed dodaniem nadtlenku wodoru oznacza to, że w badanej substancji obecne są azotany [11].
Jeżeli chcemy oznaczyć azotyny lub azotany w zanieczyszczonym kwasie siarkowym możliwe jest przeprowadzenie próby bezpośrednio na próbce zanieczyszczonego kwasu (nie jest konieczne stosowanie chemicznie czystego kwasu). Wówczas do 5 ml kwasu należy dodać 1 kroplę 0,05% alkoholowego roztworu fenoloftaleiny oraz 1 kroplę 0,25% roztworu H2O2. Większe stężenia azotanów w kwasie siarkowym blokują powstawanie różowego zabarwienia fenoloftaleiny. W przypadku obecności w próbce azotanów i azotynów pojawiające się w próbce zabarwienie można usunąć dodatkiem nadtlenku wodoru [11].
Autor: Lidia Koperwas
Literatura:
[1]. Murawa D., Banaszkiewicz T., Majewska E., Błaszczuk B., Sulima J., 2008. Zawartość azotanó (III) i (V) w wybranych gatunkach warzyw i ziemniakach dostępnych w handlu w Olsztynie w latach 2003-2004. BROMAT. CHEM. TOKSYKOL. – XLI, 2008, 1, str. 67–71. http://www.ptfarm.pl/pub/File/wydawnictwa/b_2008/1_2008/Artykul%2010%20Bromatologia%201-2008.pdf
[2]. Grudziński I.P., 1998. Effect of nitrates and nitrites of small intestine. ROCZN.PZH. 1998, 49, 321-330. http://www.google.pl/books?hl=pl&lr=&id=UWLSBa8tPYkC&oi=fnd&pg=PA321&dq=azotany+i+azotyny+w+%C5%BCywno%C5%9Bci&ots=Cxr8zRwMqF&sig=i2um3jEvClKxxWcacZcSxlhkdUo&redir_esc=y#v=onepage&q=azotany%20i%20azotyny%20w%20%C5%BCywno%C5%9Bci&f=false
[3]. Śmiechowska M., Przybyłowski P., 1999. Zawartość azotanów (V) i (III) w racjach pokarmowych studentów wyższej szkoły morskiej w Gdyni. ROCZ.PZH, 1999,NR 4, 385-390. http://books.google.pl/books?id=mHlhSpqkIi4C&pg=PA390&lpg=PA390&dq=azotany+i+azotyny+w+%C5%BCywno%C5%9Bci&source=bl&ots=w45k8jfwFX&sig=ujKNBaixUZDcPnTHnIh7XBrpI74&hl=pl&sa=X&ei=b0lfVPzxJsXsaMjOgcgF&ved=0CEgQ6AEwBzgK#v=onepage&q=azotany%20i%20azotyny%20w%20%C5%BCywno%C5%9Bci&f=false
[4]. Biegańska-Marecik R., Walkowiak-Tomczak D., Radziejewska-Bubzdela E., 2008. Zmiany zawartości azotanó (V) i (III) w szpinaku mało przetworzonym, pakowanym i przechowywanym w atmosferze modyfikowanej. ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2008, 4 (59), 251 – 260. http://www.pttz.org/zyw/wyd/czas/2008,%204%2859%29/29_Bieganska.pdf
[5]. Gierak A., Leboda R., 1999. Analiza azotanów i bromianów powstających podczas dezynfekcji wody ozonem. Ochrona Środowiska, (4)75, 1999. http://www.os.not.pl/docs/czasopismo/1999/Gierak_4-1999.pdf
[6]. Sokołowska M., Włodek L., 2001. Dobre i złe strony tlenku azotu. Artykuł poglądowy. Folia Cardiol. 2001, tom 8, nr 5, 467–477 Copyright © 2001 Via Medica ISSN 1507–4145. http://czasopisma.viamedica.pl/fc/article/viewFile/24687/19754
[7]. Jaiswal M., LaRusso N.F.,Gores G.J., 2001. Nitric oxide in gastrointestinal epithelial cell carcinogenesis: linking inflammation to oncogenesis. American Journal of Physiology, Gastrointestinal and Liver Physiology. http://ajpgi.physiology.org/content/281/3/G626
[8]. http://www.wbns.uksw.edu.pl/sites/default/files/Cw_7_oznaczanie_anionow.pdf
[9]. Kolorymetryczne oznaczanie azotanów, fluorków i fosforanów. Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. http://www.chemia.uni.lodz.pl/kchs/index_pliki/Dokumenty/4.pdf
[10]. http://www.perfectwater.com.pl/instrukcje/Testoval%20AZOTANY%20instrukcja.pdf
[11]. Garbuliński T., 1955. Wykrywanie śladowych azotynów i azotanów przy użyciu fenoloftaleiny, nadtlenku wodoru i kwasu siarkowego. Notatki laboratoryjne. Roczniki Chemii 29, 1109 (1955). http://www.tadeusz-garbulinski.wroclaw.pl/files/002-55.pdf
[12].http://cctw.gig.eu/cscore/files/aparatura_cctw/wyposazenie_SC/Przebudowa%20zestawu%20analizatorow%20FIA_SC_opis.pdf
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje