Białka należą do najważniejszych składników pokarmowych. Ponadto, są jednym z głównych składników budulcowych wszystkich tkanek oraz związków biologicznie czynnych, w tym np. enzymów, hormonów czy elementów układu odpornościowego. Synteza białek odbywa się przy dostępie odpowiednich aminokwasów, których głównym źródłem są procesy trawienia i wchłaniania białek pokarmowych [5].Słowa kluczowe: aminokwasy, grupa karboksylowa, grupa aminowa, hydroliza kwasowa aminokwasów, drobnoustroje chorobotwórcze, białka, błona zewnętrzna, izolacja białek błony zewnętrznej bakteriiBiałka są cząsteczkami, których głównym elementem budulcowym są aminokwasy. Białka wszystkich gatunków zbudowane są z tych samych 20 standardowych aminokwasów, tak więc są one takie same u człowieka czy bakterii. Aminokwasy są cząsteczkami amfoterycznymi, a to ze względu, że w ich cząsteczkach wyróżnia się zarówno grupy karboksylowe jak i aminowe, przez co ich charakter uzależniony jest od stężenia jonów wodorowych w środowisku [2], [3], [4].
W cząsteczce aminokwasu wyróżnia się centralnie położony atom węgla tzw. atom α. Do centralnego atomu kowalencyjnie są przyłączone grupa karboksylowa i aminowa, przez co zawdzięczają swoją nazwę ( α-aminokwasy), ponadto łączy się z atomem wodoru i łańcuchem bocznym. Wszystkie z 20 występujących aminokwasów mają bezbarwny kolor. Ponadto, w organizmach wyróżnia się także aminokwasy, który nie biorą udziału w budowie białek, jednakże ich rola polega na braniu udziału w skomplikowanych przemianach zachodzących w organizmie. Do takich równie ważnych aminokwasów zalicza się ornitynę oraz cytrulinę, które biorą udział w syntezie argininy (α-aminokwasu występującego w białkach). Podobny charakter mają tyroksyna i trójjodotyronina (znane hormony tarczycy) [4].
Wszystkie standardowe aminokwasy różnią się między sobą tylko strukturą łańcucha bocznego, dzięki czemu możliwy jest ich podział na grupy. Poszczególne aminokwasy wykazują różne właściwości fizyczne, co wynika właśnie z ich różnej budowy łańcucha bocznego [2], [3].
W roztworach wodnych aminokwasy występują tylko w znikomej ilości, stanowią one ok. 1%, i są cząsteczkami elektrycznie nienaładowanymi, jednak w przeważającej większości aminokwasy są jonami, które w zależności od oddziaływania środowiska mogą mieć charakter albo kwasowy albo zasadowy. Aminokwasy znajdujące się w środowisku kwasowym mają zdolność przyłączania protonu, przez co stają się kationem, z kolei w środowisku zasadowym- oddają proton przez co zachowują się jak anion [2], [3].
Aminokwasy są naładowane dodatnio gdy znajdą się w środowisku silnie kwasowym, wtedy to w polu elektrycznym wędrują w kierunku katody i zachowują się jak kwas. Występująca w budowie aminokwasów grupa karboksylowa i aminowa mogą być dawcami protonów. Z kolei, w środowisku zasadowym ładunek aminokwasów zmienia się na ujemny, przez co w polu elektrycznym wędrują w kierunku anody (zachowując się tym samym jak zasady, ponieważ zdysocjowane grupy karboksylowe i aminowe mogą przyłączać protony) [3].
W rozmaitych badaniach i doświadczeniach coraz częściej przeprowadza się analizę składu aminokwasowego danego białka. Ponadto, ważnymi obszarami zastosowań analizy aminokwasów jest analityka medyczna i farmacja, ponieważ oznaczanie ilości i rodzaju aminokwasów w płynach ustrojowych stanowi narzędzie wczesnej diagnostyki wrodzonych chorób metabolicznych. Tak, więc dzięki temu możliwe jest diagnozowanie fenyloketonurii, alkaptonurii lub bielactwa. Co za tym idzie, możliwe jest wyeliminowanie z żywności aminokwasów, powodujących wystąpienie wyżej wymienionych chorób [5].
Wybór metody za pomocą, której oznaczane będą aminokwasy obecne w żywności lub suplementach diety uzależniony jest od wielu czynników m.in. od rodzaju użytej matrycy czy przewidywanego stężenia aminokwasów w próbce. Analiza zawsze obejmuje dwa główne etapy postępowania tj. przygotowanie próbki do badania oraz właściwe oznaczenie aminokwasów. Etap przygotowania próbki do oznaczenia obejmuje ekstrakcję analitów z próbki, oczyszczenie ekstraktu oraz w większości przypadków przekształcenie aminokwasów w odpowiednie pochodne. W przypadku, gdy przeprowadza się oznaczenie całkowitej zawartości aminokwasów, konieczne jest przeprowadzenie wcześniejszej hydrolizy białek. Końcowym etapem jest rozdzielenie mieszaniny aminokwasów i analiza ilościowa poszczególnych związków badanego materiału [5].
Wśród najczęściej stosowanych ekstrahentów wolnych aminokwasów z nierozpuszczalnych w wodzie stałych matryc np. zbóż, mięsa czy ryb, wyróżnia się rozcieńczony tj. 1M roztwór HCl. Ponadto, stosuje się również stężone roztwory mocnych kwasów np. 5% kwas trichlorooctowy, 4% kwas 5-sulfosalicylowy, a także roztwory alkoholowe, które zawierają co najmniej 75% etanol lub metanol. Wyekstrahowane aminokwasy oddzielane są od pozostałych składników próbki, dzięki zastosowaniu wirowania w warunkach obniżonej temperatury tj. w 4°C, a następnie filtrację przez włókno szklane. W przypadku, gdy pracuje się z próbkami ciekłymi np. sokami, etap ekstrakcji może być pominięty. Z kolei, oczyszczanie próbki jest niezbędnym etapem mającym na celu uniknięcie ewentualnych interferencji analitycznych, które mogą być wywołane obecnością w ekstrakcie substancji takich jak białka, polipeptydy, węglowodany czy tłuszcze [5].
Wśród metod hydrolizy białek wyróżnia się hydrolizę kwasową, zasadową i enzymatyczną, przy czym najczęściej stosowana jest hydroliza kwasowa. Polega ona na długotrwałym trawieniu białek kwasem mineralnym – najczęściej jest nim 6M roztwór kwasu solnego. Trawienie zachodzi w temperaturze ok. 110°C przez 20 do 96 godzin, lub w 145°C przez 4h. Proces ten musi być prowadzony w warunkach beztlenowych (w atmosferze azotu) w zamkniętym naczyniu, by zmniejszyć możliwość degradacji niektórych aminokwasów. Z kolei, w celu zminimalizowania strat aminokwasów, które są najbardziej labilne np. tyrozyna, seryna, treonina, zaleca się by inkubować próbki w roztworze kwasu z dodatkiem substancji przeciwutleniającej (np. fenol, siarczan(IV)sodu) [5].
Do oznaczania specyficznych aminokwasów np. tryptofanu, metioniny czy cysteiny, stosuje się bardziej skomplikowane metody hydrolizy, w których próbki przeznaczone do oznaczania aminokwasów siarkowych przed hydrolizą kwasem chlorowodorowym, traktuje się mieszaniną 30% nadtlenku wodoru i 88% kwasu mrówkowego. W badaniach tryptofanu, zaleca się zastosowanie hydrolizy alkalicznej ( w 4M roztworze wodorotlenku sodu, potasu litu lub baru, przeprowadzanej w temp. 110°C prze 18 h) [5]. W celu analizy specyficznych sekwencji aminokwasów obecnych w białku zaleca się stosowanie hydrolizy enzymatycznej, która zachodzi pod wpływem enzymów proteolitycznych takich jak trypsyna czy chymotrypsyna [5].
Wśród metod najczęściej stosowanych w analizie żywności do rozdzielania mieszaniny aminokwasów są chromatografia kationowo-wymienna oraz wysokosprawna chromatografia cieczowa z odwróconym układem faz. Z kolei, wśród metod alternatywnych wymienia się kapilarne techniki elektromigracyjne np. elektroforeza strefowa, elektroforeza kapilarna sprzężona ze spektrometrią mas z jonizacją poprzez elektrorozpraszanie [5].
Izolacja białek błony zewnętrznej bakteriiDrobnoustroje chorobotwórcze posiadają odporność na substancje chemiczne, dzięki obecności w ich błonie zewnętrznej specyficznych białek, określanych jako białka błony zewnętrznej (OMP), które są niezbędnymi elementami odporności drobnoustrojów. Białka budujące ścianę zewnętrzną bakterii Gram ujemnych (G-) stanowią aż 50% błony zewnętrznej [1].
Zdolność do penetracji błony zewnętrznej jest niezbędnym warunkiem by doprowadzić do zahamowania podziału bakterii lub ich zabicia. Jedną z głównych cech błony zewnętrznej bakterii G- jest jej przepuszczalność. Przepuszczalność błony warunkowana jest przez tzw. poryny, które odgrywają bardzo ważną rolę tzw. determinantów patogenności. W wyniku redukcji poryn w ścianie komórkowej bakterii, dochodzi do obniżenia oporności bakterii na antybiotyki β-laktamowe, a także wiele innych antybiotyków [1].
Białka błony zewnętrznej odgrywają bardzo ważną rolę w budowie i funkcjonowaniu komórki bakteryjnej. Jedną z ich funkcji jest uczestniczenie w stabilizacji struktury błony zewnętrznej, Ponadto, wpływają one na adhezję komórki do innych komórek, a także służą jako receptory dla bakteriofagów. Ich ważną funkcją jest również przekazywanie sygnałów komórkowych i udział w transporcie oraz procesach przetwarzania energii, których zadaniem jest warunkowanie prawidłowego działania komórki [1].
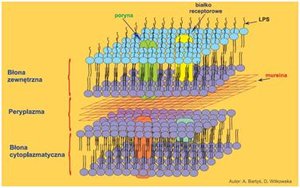
Zdjęcie: Budowa błony zewnętrznej bakterii,
http://www.phmd.pl/images/ryciny/20090727114628.jpg [1].
Ostatnie badania wskazują, że wiele schorzeń związanych jest z białkami błony zewnętrznej bakterii. W związku z tym, w celu zrozumienia funkcji tych specyficznych białek konieczne jest poznanie ich budowy, dzięki czemu możliwe stałoby się opracowanie bardziej skutecznych leków przeciwbakteryjnych. Dlatego też, całkowicie uzasadnione staje się poszukiwanie odpowiednich metod izolacji oraz oczyszczania białek bakteryjnych wchodzących w skład dwuwarstwy lipidowej [1].
Niektóre białka bakteryjne, w tym głównie białka peryferyjne można w łatwy sposób rozpuścić i oddzielić od reszty błony komórkowej, używając w tym celu stosunkowo łagodnych środków, w tym np. 1 M roztworu chlorku sodu [1].
Ze względu na fakt, że białka błonowe silnie oddziałują z węglowodorowymi łańcuchami lipidów błonowych, można je od nich oddzielić używając w tym celu jedynie detergentów [1].
Jednym z pierwszych i jednocześnie najważniejszych etapów w ekstrakcji białek błonowych jest ich solubilizacja ze środowiska lipidowego. Solubilizacja zależy od użytego w tym celu detergentu i jego stężenia, jest to szczególnie ważne w momencie, gdy chcemy oczyścić białka znajdujące się w formie natywnej. Witkowska i wsp. w swoich badaniach wykorzystali wprowadzoną przez Schnaitmanna i zmodyfikowaną w toku badań metodę izolacji białek błony zewnętrznej bakterii chorobotwórczych [1].
Jedną z najdłużej stosowanych metod izolacji białek OMP jest już wspomniana procedura opracowana wg Schnaitmanna z wprowadzonymi modyfikacjami.Tak więc, w doświadczeniu (Witkowska i wsp.), w procedurze izolacji białek błonowych jako niejonowy detergent zastosowali Triton X-100. Po rozbiciu komórek bakteryjnych oraz usunięciu ich zbędnych fragmentów, stosuje się Triton X-100 (o stężeniu 2% w buforze Tris-HCl o pH=7,6) z 10 mM MgSO4 w obecności 5 mM EDTA (czynnik chelatujący), dzięki czemu możliwe jest uzyskanie po ultra wirowaniu białek OMP w postaci rozpuszczonej [1].
Autor: Lidia KoperwasLiteratura:[1]. Witkowska D., Bartyś A., Gamian A., 2009. Białka osłony komórkowej pałeczek jelitowych i ich udział w patogenności oraz odporności przeciwbakteryjnej. Postępy Hig Med. Dosw. (online), 2009; 63: 176-199.
[2]. Hames D.B., Hooper N.M., 2009. Biochemia-krótkie wykłady. Wydawnictwo Naukowe PWN, s.23-25
[3].Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 232-235
[4]. Derlacz R.,Girstun A., Kowalska-Loth B i wsp., 2008. Podstawy Biochemii Dla Ochrony Środowiska. UW, Wydz. Biologii, Instytut Biochemii 2008. s. 1-2
[5]. Gałkowska D., Gałkowska-Pachota M, 2010. Oznaczanie aminokwasów w żywności i suplementach diety. Przygotowanie próbek. LABORATORIUM 9-10/2010. www.laboratorium.elamed.pl



Recenzje