Tlenek azotu pełni bardzo ważną rolę w ludzkim organizmie, dlatego bardzo ważne jest poznanie tej cząsteczki lepiej. Niniejsza publikacja opisuje historię odkrycia tej ważnej molekuły jak i jej właściwości chemiczne i biologiczne.
Słowa kluczowe tlenek azotu(II), rodnik tlenowy, RNS
SkrótyEDRF - czynnik rozszerzający naczynia (ang. endothelium-derived relaxing factor)
RNS – reaktywne formy azotu (ang. reactive nitrogen species)
WprowadzenieReaktywne formy azotu (RNS) często zaliczane są do rodnikowych związków tlenu. Wyróżnia się w nich formy długożyjące (T_(1⁄2)≈1s; duży zasięg oddziaływań) i krótkożyjące ( T_(1⁄2)≪1s; mały zasięg oddziaływań. Cząsteczka ta zawiera jeden niesparowany elektron, wykazując tym samym właściwości paramagnetyczne oraz dużą aktywnością chemiczną. Tlenek azotu(II) nie jest obdarzony ładunkiem.
Krótka historiaTlenek azotu(II) został odkryty w 1977 przez F.Murad. Naukowiec ten wykazał, że nitrogliceryna (oraz podobne leki nasercowe) powoduje wytwarzanie się tlenku azotu, co z kolei prowadzi do powiększenia średnicy naczyń krwionośnych i większego przepływu krwi. W roku 1980 R.F.Furchgott stwierdził, że nieuszkodzony śródbłonek naczyń krwionośnych uwalnia pod wpływem acetylocholiny czynnik rozszerzający naczynia (endothelium-derived relaxing factor, EDRF). Dopiero w 1987 L.J. Ignarro zidentyfikował EDRF jako tlenek azotu(II) NO. Tlenek azotu został Cząsteczką roku 1992, a jego odkrycie zostało uznane za jedno z największych odkryć biologicznych XX wieku. Naukowcy, którzy tego dokonali dostali w 1998r. Nagrodę Nobla w dziedzinie medycyny.
Właściwości chemiczneCząsteczka tlenku azotu(II) - NO jest rodnikiem posiadającym jeden niesparowany elektron (S=1/2), dzięki czemu jest niezwykle reaktywna. Pomimo niesparowanego elektronu, połówkowej liczby spinowej i niezerowego momentu pędu, w stanie podstawowym nie jest to cząsteczka paramagnetyczna. Ta dwuatomowa cząsteczka posiada 15 elektronów o konfiguracji elektronowej K2L5 – 2s2(σ) 2s2(σ*) 2p4(π) 2p2(σ) 2p1(π*). Niesparowany elektron zlokalizowany jest na antywiążącym orbitalu π*. Gęstość elektronowa jest równomierna i posiada rotacyjną oś symetrii. Liczby kwantowe S (spinowy moment pędu) i L (orbitalny moment pędu) spełniają warunek J=S+L i są dobrze zdefiniowane (Ω=Λ+Σ). Wolny NO posiada Σ =1/2 i Λ=1. W polu magnetycznym wektory magnetycznego momentu pędu NO ulegają uporządkowaniu. Część z nich ustawia się równolegle (zwrot zgodny ze zwrotem przyłożonego pola magnetycznego), a część antyrównolegle (zwroty przeciwne). Wektory magnetycznego momentu pędu NO ustawione równolegle mają niższą energię o 124.2cm-1 (~15meV) [1]. Wyliczony współczynnik żyromagnetyczny g = 0 [2], stąd też brak paramagnetyczności gazowego NO. Jednak współczynnik żyromagnetyczny NO rozpuszczonego w roztworze w temperaturze pokojowej wynosi g=4/5 dla 70% cząsteczek, stad też jego detekcja jest możliwa metodą EPR. Roztwór taki umieszczony w polu magnetycznym (9100 G) potraktowany falą o częstotliwości ~10GHz (zakres X) daje sygnał EPR z efektem Zeemana – 9 linii o szerokości 250 G, jest to triplet tripletów (3:4:3). Rodnik ten często wchodzi w skład paramagnetycznych kompleksów metali tj. kobalt, żelazo.
Rodnik ten jest bardzo nie trwały ulega przekształceniu w azotyny:
NO∙ + ∙OH → HNO2 (1)
W obecności anionów ponadtlenkowych może przekształcać się peroksyazotyn:
NO∙ + O2∙- → ONOO- (2)
W powietrzu reaguje z tlenem, tworząc trujący tlenek azotu(IV) NO2. NO jest gazem bezbarwnym, ale z wyraźną absorpcją przy 1878cm-1 = 0.233eV (zakres podczerwieni) [3]. Ta charakterystyczna absorpcja odpowiada długości fali 5,3 μm i jest używana do detekcji pikomolarnych stężeń gazowego NO w próbkach biologicznych [4].
Ma działanie antyoksydacyjne gdyż, jest:
Zmiataczem wolnych rodników
Hamuje peroksydacje lipidów
2NO• + 2ROO• → 2ROONO (3)
2ROONO → 2RO• + 2NO2• (4)
RO• + NO2• → RONO2 (5)
RO• + NO• → RONO (6)
NO2• + NO• → N2O3 (7)
4NO2• + 2ROO• + H2O → 2HNO2 +RONO2 +RONO (8)
Związkiem ochronnym - reakcjia nitrozylacji
tworzenie kompleksów z hemoglobiną i mioglobiną (Hb-NO) zapobiega patogennym reakcjom:
Fe2+ + O2 → Fe-O2 → Fe3+ + O2•- (9)
Hb-Fe3+ +H2O2 → •Hb-Fe4+=O + H2O (10)
Zapobiega reakcji Fentona i Habera-Weissa przez nitozylację żelaza
(Fe2+-NO)
Fe2+-NO + t-BuOOH + H2O → Fe3+ + t-BuOH +HNO2 +OH- (11)
Biochemia tlenku azotu(II)Cząsteczka NO pełni ważną rolę w wielu procesach biologicznych u zwierząt i roślin [5]. Jest neuroprzekaźnikiem, czynnikiem rozkurczajacym mięśnie gładkie naczyń krwionośnych, bierze udział w krzepnięciu krwi, uczestniczy w metabolizmie żelaza i warunkuje aktywność cytotoksyczną makrofagów oraz ich zdolność do niszczenia pasożytów [6,7].
Tlenek azotu jest produkowany w organizmie z L-argininy (Rys.1).
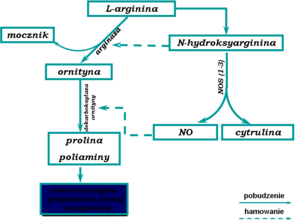
Rys. 1. Synteza tlenku azotu(II) w organizmie.
Reakcja syntezy NO prowadzona jest przez wyspecjalizowane enzymy, syntazy tlenku azotu (NOS - Tab.1):
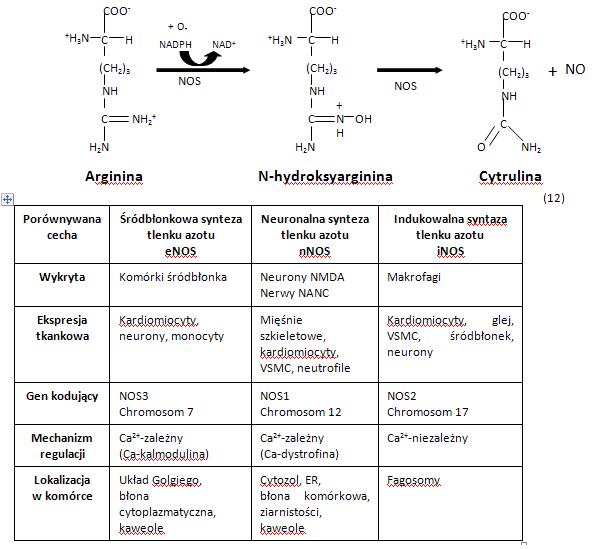
Tab1. Syntetazy tlenku azotu(II)
Cząsteczka NO ma małą masę, co w warunkach temperatury organizmów stałocieplnych i stałej średniej energii kinetycznej wszystkich cząstek go budujących sprawia, że ma ona relatywnie dużą prędkość, i może w tkankach dyfundować na stosunkowo daleki dystans (około 500 µm). Ponadto, obojętny ładunek elektryczny ułatwia dyfuzję w roztworach wodnych i przez spolaryzowane błony biologiczne. Jednak w układach biologicznych NO nie jest trwały. W stężeniach fizjologicznych (10 nM – 5 µM) czas półtrwania (t1/2) cząsteczki NO wynosi 1-30 s. W organizmach NO posiada bardzo duże powinowactwo do żelaza, zarówno labilnego, jak i związanego przez białka (np. ferrytyna [ 8]), oraz bezpośrednio wchodzącego w strukturę białek (białka zawierające klaster [Fe-S] [9, 10 ] i pierścieni porfirynowych [11 ,12 ], tworząc DNIC.
Inne tlenki azotu tlenek azotu(I) (N2O), podtlenek azotu, tlenek diazotu, gaz rozweselający
tlenek azotu(II) (NO), monotlenek azotu
tlenek azotu(III) (N2O3), w którym jeden atom azotu jest na formalnym stopniu utlenienia +4 a drugi +2.
tlenek azotu(IV) (NO2), ditlenek azotu (tworzy on również dimer - tetratlenek diazotu N2O4)
tlenek azotu(V) (N2O5), pentatlenek diazotu
tlenek azotu(VI) (NO3), nietrwały gaz w kolorze niebieskim, jego rozkładowi termicznemu towarzyszy luminescencja; wykazuje własności utleniające, nie zawiera wiązania nadtlenkowego -O-O-
heksatlenek diazotu (N2O6), nietrwały związek z wiązaniem nadtlenkowym, O2N-O-O-NO2
PodsumowanieRodnik tlenku azotu ma specyficzne właściwości w stosunku do innych rodników. Ma ogromne znaczenie w fizjologii organizmów żywych. Nie tylko w regulacji skurczów naczyń krwionośnych, ale także w ochronie przeciw oksydacyjnej.
Autor: Karolina WójciukLiteratura:[1 ] Whittaker J. 1991. Molecular paramagnetic resonance of gas-phase nitric oxide. J. Chem. Edu. 68: 421-423
[2 ] Jevons W. 1932. Band spectra of diatomit molecules. Cambridge University Press. London
[3] Pope R., Wolf P. 2001. Rare gas pressure broadening of the NO fundamental vibrational band. J.Mol. Spectrosc. 208: 153-160
[4] Danser H., Horstjann M., Suschek C., Hering P., Murtz M. 2004. Online monitoring of biogenic nitric oxide with a QC laser-based Faraday modulation technique. Appl. Phys. B. 78: 513-517
[5] Monada S., Palmer R.M.J., Higgs E.A. 1991. Nitric oxide: physiology, pathysiology and pharmacology. Pharmacol. Rev. 43: 109-142
[6] Natan C.F., Hibbs Jr.J.B. 1991. Role of nitric oxide synthases in macrophages antimicrobial activity. Curr. Opin. Immunol. 3: 109-142
[7] Richardson D.R., Ponka P. 1996. Effects of nitrogen monoxide on cellular iron metabolism. In Nitric Oxide Synthase: Characterization & Functional Analysis (Maines M.D., ed.) Academic Press, San Diego ss. 329-343
[8] Lee M., Arosio P., Cozzi A., Chasteen N.D. 1997. Identification of the EPR-active iron-nitrosyl complexes in mammalian feerodoxin. Biochemistry 39: 3679-3687
[9] Cairo G., Ronchi R., Recalcati S., Campanella A., Minotti G. 2002. Nitric oxide and peroxynitrite activate the iron regulatory protein-1 of J774A.1 macrophages by direct dissembly of the Fe-S cluster of cytoplasmic aconitase. Biochemistry 41: 7435-7442
[10] Soum E., Brazzolotto X., Goussias C., Bouton C., Moulis J.-M., Mattioloi T.A., Drapier J.-C. 2003. Peroxynitrate and nitric oxide differently target the iron-sulfur cluster and amino acid residues of human iron regulatory protein 1. Biochemistry 42: 7648-7654
[11] Ignarro L.J. 1991. Heme-dependent activation of guanylate cyclase by nitric oxide: a novel signal transduction mechanism. Blood Vessels 28: 67-73
[12] Griscavage J.M., Fukuto J.M., Komori Y., Ignarro L.J. 1994. Nitric oxide inhibits neuronal nitric oxide synthase by interacting with the heme prosthetic group. Role of tetrahydrobiopterin in modulating the inhibitory action of nitric oxide. J. Biol. Chem. 269:21644-21649
ARTYKUŁ DO POBRANIA: Laboratoria.net - Rodnik tlenku azotu (II)



Recenzje