StreszczenieWszystkie aminokwasy dzielimy na proteinogeniczne, nie-standardowe oraz nie tworzące białek. Do pierwszej grupy zaliczamy dwadzieścia dwa aminokwasy tworzące polipeptydy naszego organizmu, stanowiąc jego część strukturalną. Dwadzieścia z nich zapisanych jest w kodzie genetycznym i pełnią różnorakie funkcje. Do nich należą histydyna i tyrozyna – aminokwasy aromatyczne opisane w niniejszej pracy.
Słowa kluczowe: aminokwasy, peptydy, białka, histydyna, tyrozyna  Wstęp
WstępBiałka są wielokcząsteczkowymi polimerami, gdzie monomerami są aminokwasy połączone ze sobą wiązaniem peptydowym. Wiązanie peptydowe ma charakter kowalencyjny, w którym do grupy karboksylowej zamiast amoniaku została przyłączona jego acylowa pochodna. Przyjmuje się, że jeśli wiązaniem tym połączone jest do 100 aminokwasów są to peptydy. Układ zawierający powyżej 100 jednostek nazywamy białkami [1].
W białkach występuje do 20 różnych rodzajów aminokwasów. Rodzaj, liczba aminokwasów oraz kolejność ich ułożenia determinuje właściwości oraz budowę białka. Każda cząsteczka aminokwasu posiada grupę aminową –NH2 i karboksylową –COOH ponadto może posiadać dodatkowe grupy funkcyjne w łańcuchach bocznych np.: grupy karboksylowe (kwas asparaginowy), grupy aminowe (lizyna), grupy amidowe (glutamina, wiązanie peptydowe), grupy hydroksylowe (seryna), grupy tioeterowe (metionina) i tiolowe (cysteina) [2]. Znane są też aminokwasy niebiałkowe (ornityna, cytrulina, 3-alanina), czyli te, które nigdy nie zostały wykryte w produktach hydrolitycznego rozpadu białek. Aminokwasy te różnią się od białkowych tym iż grupa aminowa znajduje się w położeniu β [3]. Aminokwasy niebiałkowe występują w organizmach roślinnych i niższych organizmach zwierzęcych, jako produkty przemiany materii.
Znaczenie biologiczne aminokwasów, peptydów i białekOrganizmy roślinne i drobnoustroje, które przekształcają azot mineralny w organiczny mogą wytwarzać aminokwasy, peptydy lub białka ze związków nieorganicznych. Organizmy zwierzęce, w tym człowiek, do wytworzenia niezbędnych ustrojowi białek muszą dostarczać w formie pożywienia obcych białek, które są przerabiane zgodnie z potrzebami organizmu. Jednak ustrój ludzki nie może syntetyzować dowolnych aminokwasów. Aminokwasami egzogennymi dla człowieka są: walina, leucyna, izoleucyna (o łańcuchach rozgałęzionych); fenyloalanina, tyrozyna, tryptofan (z pierścieniem aromatycznym); oraz lizyna, metionina, treonina (pochodzące biogenetycznie od kwasu L-2-amino-3-fenylopropionowego). Lista tych aminokwasów zmienia się w zależności nie tylko od gromady, lecz nawet od gatunku zwierzęcia.
Związki o charakterze peptydów pełnią w organizmach żywych rolę koenzymów i hormonów. Ponadto większość antybiotyków i trucizn pochodzenia grzybiczego bądź roślinnego występuje w postaci peptydów.
Białka pełnią wiele funkcji w zależności od ich rzędowości struktury. Białka pierwszorzędowe proste globularne pełnią funkcję enzymów i antygenów, włókniste stanowią białka strukturalne i podporowe a wyższe rzędy hormonalne i warunkujące trwanie gatunku: (helisy DNA i RNA) [1].
Budowa chemiczna i znaczenie biologiczne histydyny i tyrozyny HistydynaHistydyna (His) jest białkowym α-aminokwasem i zalicza się do aminokwasów silnie zasadowych ze względu na występowanie dodatkowych grup aminowych w heterocyklicznym pierścieniu imidazolowym. Możliwość protonowania powoduje, że jest ona silnie polarna.
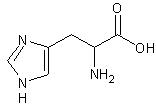 Rys. 1 Histydyna (kwas L-2-amino-3-imidazolilopropanowy).
Rys. 1 Histydyna (kwas L-2-amino-3-imidazolilopropanowy).Dla ludzkiego organizmu jest ona aminokwasem endogennym i nie posiada ona swojej rodziny biogenetycznej. Syntetyzowana ona jest z: adenozyno-trójfosforanu i 5-fosforanu rybozy. Pełni ona bardzo ważne funkcje w hydrolizie estrów prowadzonych przez żywe organizmy. Hydroliza ta zachodzi najszybciej przy pH fizjologicznym (pH = 7.4), jednak wiadomo, że estry hydrolizują także przy niskich i wysokich wartościach pH. Proces ten stabilizowany jest właśnie przez histydynę, która występuje jako „wolna” zasada w roztworach zasadowych oraz sprotonowana zasada w roztworach kwaśnych. Dzięki tym właściwościom pełni rolę bufora stabilizując pH środowiska [4]:
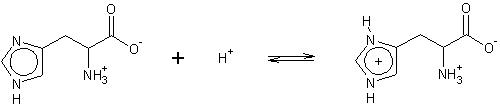 Rys.2 Proces biochemiczny stabilizujący hydrolizę estrów wg Morisson’a i Boyd’a. 1990 [4].
Rys.2 Proces biochemiczny stabilizujący hydrolizę estrów wg Morisson’a i Boyd’a. 1990 [4].pH środowiska w którym znajduje się His warunkuje możliwość tworzenia przez nią wiązań wodorowych, może być ona akceptorem i donorem (nie jednocześnie) w różnych pH [5].
L-(-)-histydyna jest niezbędna w okresie wzrostu zwierząt i człowieka, dorosły organizm syntezuje ją w wystarczających ilościach (Filipowicz B., Więckowski W. 1983). Pełni też bardzo ważną rolę w strukturze hemoglobiny i powinowactwie hemu do kationów wodorowych i tlenu cząsteczkowego. Stanowi wewnętrzną polarną część mioglobiny. Bierze ona udział w różnego rodzaju biosyntezach [5].
TyrozynaTyrozyna (Tyr) jest aminokwasem amfoterycznym o małej polarności posiadającym w swojej budowie pierścień aromatyczny. Ze względu na jego obecność jest uważana za aminokwas egzogenny jednak może być ona wytwarzana w organizmach przez hydroksylację fenyloalaniny, jeśli aminokwas ten występuje w tkance w dostatecznej ilości.
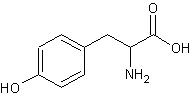 Rys.3 Tyrozyna (kwas L-2-amino-3-hydroksyfenylopropionowy)
Rys.3 Tyrozyna (kwas L-2-amino-3-hydroksyfenylopropionowy)Tyrozyna należy do rodziny szikimianowej, czyli syntetyzowana jest z 4-P-ertozy (podobnie jak tryptofan i fenyloalanina). Jako aminokwas aromatyczny ma zdolność pochłaniania światła w zakresie UV (260-290nm), co jest wykorzystywane w określaniu obecności białek w roztworach. Ulega także reakcji ksantoproteinowej [1].
Jest ona prekursorem wielu związków ważnych dla organizmu np. hormonu adrenaliny. Występuje w wielu białkach, szczególnie obficie u roślin. Wykryto ją w organizmach także w stanie wolnym [3, 4]. Stanowi polarną jak i niepolarną część mioglobiny. Umożliwia tworzenie wiązań stabilizujących drugo- i trzeciorzędową strukturę białek hemoglobiny. Podobnie jak histydyna, może być donorem i akceptorem wiązań wodorowych (w zależności od pH środowiska). Wiązania peptydowe tyrozyny rozrywane są przez specyficzny enzym chymotrypsyne. Tyrozyna jako jeden z nielicznych aminokwasów jest zarówno ketogenna jak i glukogenna [5].
Literatura:- Kączkowski J. 1996. Podstawy biochemii. Wydawnictwo Naukowo-Techniczne. Warszawa. s.352.
- Creighton T.E. 1997. Chemical properties of polypeptides. Proteins. Struktures and Molecular Properties. New York. W.H. Frejman and Company:1 Oxidation. Oxford university Press. Oxford, New York, Tokyo. s.443
- Filipowicz B., Więckowski W. 1983. Biochemia. Tom I. Rozdz. Białka i aminokwasy. Państwowe Wydawnictwo Naukowe. Warszawa-Łódź. ss.123-243
- Morrisom R.T., Boyd R.N. 1990. Chemia organiczna. Tom 2.Aminokwasy i białka. Państwowe Wydawnictwo Naukowe. Warszawa. ss.357-388
- Stryer L. 1986. Biochemia. PWN. Warszawa. s.1003


 Wstęp
Wstęp


Recenzje