Zdjęcie: Oczyszczanie białek za pomocą HIC, [7]
Zalety HIC:
- w technice gradientowej objętość próbki nanoszonej na kolumnę może być wielokrotnie większa od objętości kolumny, a stężenie separowanych substancji może być bardzo niskie;
- HIC pozwala na wielokrotne zatężenie wyjściowego materiału;
- pojemność kolumny jest zwykle bardzo duża;
- rozdzielczość metody jest wysoka.
Wady:
- składniki eluowane w solwencie o dużym stężeniu soli muszą być dializowane bądź poddawane etapowi re-chromatografii techniką filtracji żelowej, co ma na celu usunięcie nadmiaru soli [6].
α–laktoalbuminy jest białkiem charakteryzującym się dużą odpornością na wysoką temperaturę.
Odmiennie od albumin surowicy krwi, α -laktoalbumina zawiera oligosacharyd, który jest przyłączony do łańcucha polipeptydowego przez grupę b-karboksylową reszty kwasu asparaginowego. Ludzka α- laktoalbumina (o masie cząsteczkowej 14 176 Da) zbudowana jest ze 123 aminokwasów. Ponadto, w jej składzie występują 4 mostki disiarczkowe. Dodatkowo, pierwszorzędowa struktura α-laktoalbuminy jest zgodna ze strukturami α - laktoalbumin u innych gatunków ssaków. Białko to pochodzące z mleka krowiego wykazuje duże podobieństwo w budowie do α-laktoalbuminy pochodzenia ludzkiego [8].
Rozdzielanie α-laktoalbuminy i β-laktoglobuliny z zastosowaniem złoża Phenyl Sepharose (L. Lindahl)
W obecności jonów metali wiele białek podlega znacznym zmianom konformacyjnym. Zmiany te mają wpływ na zmianę właściwości hydrofobowych. Zjawisko to jest wykorzystywane do izolowania i oczyszczania białek wiążących się z jonami metali. Proteiny obecne w mleku, a mianowicie α-laktoalbumina i β-laktoglobulina, mają zdolność do wiązania jonów wapnia (Ca2+). Obecność jonów miedzi powoduje, że α-laktoalbumina jest mniej hydrofobowa niż w środowisku ubogim w te jony. Właściwości hydrofobowe β-laktoglobuliny są słabo zależne od obecności jonów miedzi, dzięki temu stosunkowo łatwo można dokonać separacji tych dwóch białek. W tym celu najczęściej wykorzystuje się złoże Phenyl Sepharose [1], [2].
W pierwszym etapie chromatografii przez kolumnę chromatograficzną przepuszcza się mieszaninę badanych białek w obecności EDTA. W takich to warunkach α-laktoalbumina wiąże się ze złożem, podczas gdy β-laktoglobulina przepływa przez kolumnę prawie bez oddziaływań z nią [1], [2].
W drugim etapie chromatografii pzreprowadza się elucję zaadsorbowanych białek, korzystając z buforu, który w swym składzie zawiera jony wapnia [1].
Wykonanie:
Należy zmieszać po 500 µl (2 mg/ml) α-laktoalbuminy z 500 µl β-laktoglobuliny (2 mg/ml), po czym do próbki dodać 1 ml buforu Tris-HCl – 0,2 M EDTA (pH=7,5). Próbkę inkubować w temperaturze pokojowej przez 30 minut.
W trakcie inkubacji, pobrać 5 ml złoża Phenyl Sepharose 6FF, przemyć je 3 krotnie 20 ml wody, po czym upakować w plastikowej kolumnie. Przez tak przygotowaną kolumnę przepuścić 50 ml buforu Tris-HCl – EDTA.
Na przygotowaną w ten sposób kolumnę nanieść próbkę mieszaniny białek i rozpocząć zbieranie materiału wypływającego z kolumny, w postaci 2 ml frakcji. Po wsiąknięciu naniesionej próbki w złoże , należy kolejno przepuścić przez kolumnę :
- 15 ml buforu Tris-HCl- EDTA
- 50 ml buforu Tris-HCl- CaCl2 (ciągle zbierając wypływające z kolumny 2-ml frakcje i oznaczając w nich spektrofotometrycznie zawartość białka).
W powyższych warunkach β-laktoglobulina powinna opuścić kolumnę bez oddziaływania z nią, i znaleźć się we frakcjach o numerach 2 i 3. Α-laktoalbumina powinna być wyeluowana w momencie, kiedy EDTA zostanie usunięte z kolumny, a jego miejsce zajmą jony Ca2+ (tj. we frakcji nr 8) [1], [2].
Po skończonym rozdziale kolumnę należy przemyć 50 ml wody destylowanej oraz 20% etanolem (15 ml). Tak przygotowaną kolumne można przechowywać w temperaturze pokojowej- chroniąc przed nadmiernym nasłonecznieniem, zaś przed kolejnym użyciem wystarczy ją przemyć 50 ml wody [1], [2], [6].
Co ważne:
- Wszystkie bufory , które będą stosowane do chromatografii cieczowej oraz nanoszone próbki należy filtrować przed użyciem. Próbki zamiast filtrowania można poddać wirowaniu w warunkach: 5000 x g, 10 min, co ma na celu zabezpieczenie kolumny przed zatkaniem.
- Bufory dobrze jest przygotować na kilka godzin przed użyciem. Z kolei, bezpośrednio przed ich zastosowaniem należy sprawdzić wartość pH (i w razie konieczności ponownie doprowadzić do potrzebnej wartości) [1].
Izolowanie enzymów z mieszaniny z wykorzystaniem złoża Phenyl Sepharose (L. Szepesy).
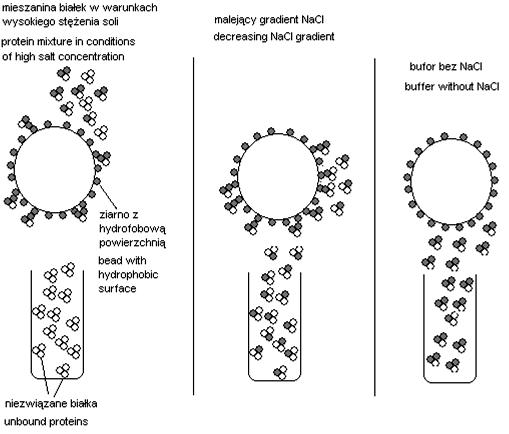
Obecność dużych stężeń soli w roztworze białek przyczyniają się do pojawienia się licznych zmian konformacyjnych w tych białkach. W krańcowych przypadkach zmiany te moga spowodować wytrącenie białek z danego roztworu. Zjawisko wysalania białek bardzo często stosowane jest w celu szybkiej i wstępnej separacji białek. Pozostałe w roztworze białka wykazują silne właściwości hydrofobowe, dzięki czemu można je rozdzielać stosując w tym celu technikę chromatografii oddziaływań hydrofobowych (HIC) [1], [3].
Po niesieniu na kolumnę próbki (mieszaniny białek) znajdujących się w środowisku o dużym stężeniu soli, dochodzi do oddziaływań hydrofobowych fragmentów tych białek z hydrofobowymi łańcuchami ligandów, które są trwale związane z nośnikiem. Po odmyciu niespecyficznie zaadsorbowanych białek można eluować związane białka w zależności od ich hydrofobowości, stosując w tym celu eluenty o malejącym stężeniu soli [1], [3].
Wykonanie:
W buforze fosforanowym (zawierającym 1,7 mol/l (NH4)2SO4) mieszaninę białek standardowych tj.:
- cytochrom c o stężeniu 2 mg/ml
- mioglobinę o stężeniu 4 mg/ml
- rybonukleazę o stężeniu 10 mg/ml
- chymotrypsynogen A o stężeniu 3 mg/ml [1], [3].
Należy pobrać 5 ml złoża Phenyl Sepharose 6FF, następnie przemyć je za pomocą wody destylowanej (3-krotnie, po 20 ml). Przygotowane w ten sposób złoże upakować w plastikowej kolumnie, zaś kolumnę zrównoważyć 50 ml buforu fosforanowego (zawierającym 1,7 mol/l (NH4)2SO4).
Korzystając z wyjściowych buforów należy przygotować 15-ml porcje buforu fosforanowego o malejącym stężeniu (NH4)2SO4 tj.: 1,3; 1,1; 0,8 oraz 0,3 M [1], [3].
Przygotowaną mieszaninę białek należy odwirować, a otrzymany po wirowaniu supernatant w objętości 1 ml nanieśc na kolumnę. Po wniknięciu w kolumnę próbki, należy przepuścić przez nią 15 ml buforu fosforanowego , zawierającego 1,7 mol/l (NH4)2SO4, po czym rozpocząć zbieranie wypływającego z kolumny materiału w postaci 2 ml frakcji [1], [3].
Następnie, wymywać z kolumny związane z nią białka, stosując w tym celu wcześneij przygotowane eluenty w objętości 15 ml każdy. Eluenty stosować w kolejności malejącego stężenia (NH4)2SO4.
Po zakończeniu rozdziału chromatograficznego, kolumnę przemyć 50 ml wody oraz 15 ml 20% etanolu. Kolumna może być przechowywana do kolejnego użycia w temperaturze pokojowej.
Zbierane podczas rozdziału frakcje należy oznaczyć spektrofotometrycznie przy λ=280 nm.
Po analizie należy wykonać wykres zależności gęstości optycznej poszczególnych frakcji od objętości elucji [1], [3].
Podczas rozdziału wymywane są białka w następującej kolejności:
- cytochrom c
- mioglobina
- rybonukleaza
- chymotrypsynogen A (jako ostatni składnik) [1], [3].
Literatura:
[1]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 166-172
[2]. Lindahl L., Vogel H.J., 1984. Metal-ion-dependent hydrophobic-interaction chromatography of α-lactoalbumins. Anal. Biochem., 140: 394 – 402
[3]. Szepesy L., Horvath C., 1988. Species salt effects in hydrophobic interaction chromatography of proteins. Chromatographia, 28: 13-18.
[4]. Jing Jin, 2010. Lipid foulant interactions during the chromatographic purification of virus-like particles from Saccharomyces cerevisiae. http://discovery.ucl.ac.uk/1302065/1/1302065.pdf
[5].http://www.gelifesciences.com/webapp/wcs/stores/servlet/catalog/pl/GELifeSciences/products/AlternativeProductStructure_17430/17097303
[6]. http://www.biofizyka.p.lodz.pl/ch6.pdf
[7]. http://www.pttz.org/zyw/wyd/czas/2005,%203%2844%29/01_Rosinski.pdf
[8].http://www.pg.gda.pl/chem/Katedry/Inzynieria/images/data/mk/dydaktyka/trm/l/TRM_cw_1.pdf
opracowała: Lidia Koperwas


Recenzje