

|
Zamknij X
|
 Ceruloplazmina (Cp) jest niebieską, wiążącą miedź glikoproteiną, która w swojej cząsteczce zawiera sześć atomów miedzi i stanowi ponad 95% całkowitej miedzi krążącej w organizmie zdrowych dorosłych osób. Ceruloplazmina jako enzym należy do oksydaz. Mutacje w genie ceruloplazminy, określane mianem aceruloplasminemii (np. choroba Wilsona) prowadzą do upośledzenia produkcji ceruloplazminy i zaburzeń metabolizmu żelaza (Harris i wsp., 1995) [1].
Ceruloplazmina (Cp) jest niebieską, wiążącą miedź glikoproteiną, która w swojej cząsteczce zawiera sześć atomów miedzi i stanowi ponad 95% całkowitej miedzi krążącej w organizmie zdrowych dorosłych osób. Ceruloplazmina jako enzym należy do oksydaz. Mutacje w genie ceruloplazminy, określane mianem aceruloplasminemii (np. choroba Wilsona) prowadzą do upośledzenia produkcji ceruloplazminy i zaburzeń metabolizmu żelaza (Harris i wsp., 1995) [1].
Aktualne, znane są różne metody oczyszczania ceruloplazminy pochodzącej z różnych źródeł osocza (np. osocza ludzkiego czy szczurzego), które pojawiały się w literaturze już wcześniej ( np. w badaniach Linder and Moor, 1977; czy Essamadi et al., 2002; Calabrese et al., 1981), co świadczy o tym, że próby otrzymania dobrej jakości preparatu podejmowano już wielokrotnie. Najbardziej popularne metody oczyszczania Cp są wieloetapowe, i zazwyczaj opierają się na wykorzystaniu soli amonowych [1].
Denaturacja ceruloplazminy za pomocą mieszaniny etanol: chloroform [7].
Wykonanie:
Do roztworu ceruloplazminy należy powoli wkropić 3 objętości mieszaniny etanol:chloroform (w stosunku 9:1), próbkę ciągle mieszać przez okres ok. 60 minut. Wkraplanie przeprowadzać w temperaturze pokojowej. Po wkropleniu całej objętości mieszaniny, próbkę inkubować przez 100 minut w temperaturze pokojowej- w ciemnym miejscu.W trakcie inkubacji wytrąci się osad białek, zaś po jej upływie próbkę odwirowuje się przy 3000 obr./minutę przez 10 minut. Następnie, po wirowaniu należy zdekantować płyn (dokładnie osuszyć ścianki probówki za pomoca bibuły), zaś powstały po wirowaniu błękitny osad rozprowadzić w 15- 20 ml 0,9% NaCl (o pH=7). Próbkę mieszać na mieszadle magnetycznym przez 5 minut, po czym ponownie odwirować zwiększając obroty i czas wirowania tj.: 16000 obr./min przez 60 minut. Po wirowaniu otrzymuje się niebiski supernatant- zawierający ceruloplazminę, który należy przenieść do woreczka dializacyjnego, gdzie przeprowadza się dializę wobec 0,9% roztworu NaCl (pH=7) w ciągu kilkunastu godzin. Dializa ma na celu usunięcie pozostałości etanolu i chloroformu z preparatu [7].
Wysalanie ceruloplazminy siarczanem (VI) amonu (sposób nr 2):
Wykonanie:
Do 1 litra osocza krwi świni (pobranego do naczynia z antykoagulantem) małymi porcjami wkrapla się 400 ml nasyconego roztworu (NH4)2SO4 (nasyconego w temperaturze pokojowej). Próbkę w trakcie wkraplania należy stale mieszać, a po upływie 15 minutowej inkubacji w temperaturze pokojowej, zawiesinę odwirowuje się przy 3000 obr./min. przez 10 minut. Otrzymany po wirowaniu osad rozpuszcza się w wodzie, której objętość oblicza się biorąc pod uwagę przyrost objętości po rozpuszczeniu osadu w wodzie – tak więc będzie to objętość osadu. Roztwór rozcieńcza się w wodzie do końcowej objętości równej 50-krotnej objętości osadu. A więc, gdy po rozpuszczeniu osadu w 300 ml wody otrzyma się objętość 350 ml,będzie to wskazywało, że objętość osadu w tym przypadku wynosi 50 ml, a co za tym idzie cały roztwór należy rozcieńczyć do końcowej objętości równej 2500 ml (50ml osadu x 50-krotne rozcieńczenie) [7].
W 1948 Holmberg i Laurell samodzielnie wyizolowali z surowicy świń duże ilości białka zawierającego miedź, które nazwali ceruloplazmina lub „błękitnym białkiem”. W tym samym roku odkryto, że zwyrodnienie wątroby w chorobie Wilsona spowodowane jest nadmiernym gromadzeniem się miedzi. Po tych odkryciach zaobserwowano, że stężenie ceruloplazminy zmniejsza się w chorobie Wilsona, co z kolei doprowadziło do powstania testu diagnostycznego dla tej choroby. Dalsze badania ujawniły charakter tego białka i pozwoliły na zidentyfikowanie osób z dziedzicznymi różnicami w stężeniu ceruloplazminy w osoczu. Analiza przeprowadzona w jednej z takich rodzin ujawniła tę zmianę jako dziedziczną hiperceruloplasminemię. Miejscem syntezy ceruloplazminy są hepatocyty [2].
Biological Assembly Image for 1KCW , X-RAY CRYSTAL STRUCTURE OF HUMAN CERULOPLASMIN AT 3.0 ANGSTROMS. Protein chains are colored from the N-terminal to the C-terminal using a rainbow (spectral) color gradient, http://www.pdb.org/pdb/explore.do?structureId=1KCW
Określanie optymalnego pH dla ceruloplazminy
Ceruloplazmina wykazuje optymalne działanie przy pH w granicach 5,5 – 5,8. Pomiar aktywności oksydacyjnej Cp opisali Lehmann, Schosinsky i wsp. (1974), wykorzystując w doświadczeniu chlorowodorek O-dianizydyny (dichlorowodorek-4,4'-diamino-3,3'-dimetoksybifenyl) jako substratu. Reagent ulega przekształceniu w żółto-brązowy produkt reakcji pod wpływem działania Cp i tlenu w pH=5. Zakwaszenie roztworu zatrzymuje reakcję enzymatyczną, w wyniku czego powstaje stabilny fioletowo-czerwony roztwór, którego maksimum absorpcji przypada przy 540 nm. Optymalne pH dla ceruloplazminy określa się przez zmianę stężenia i pH zastosowanych buforów [1].
W swoich doświadczeniach (Lehmann i wsp. 1974) opisali metodę obliczania zdolności absorpcyjnej barwnego roztworu otrzymanego w trakcie oksydacji (utleniania) dichlorowodorku o-dianizydyny z zastosowaniem znanych ilości nadtlenku wodoru (H2O2). W trakcie przeprowadzonych badań stwierdzono, że molowy stosunek reakcji o-dianizydyny do nadtlenku wodoru wynosi 2:1. Metoda ta jest bardziej wrażliwa i mniej podatna na utlenianie nieenzymatyczne substratu, niż w przypadku procedur, gdzie do oznaczenia wykorzystuje się np. p-fenylenodiaminę. Enzymatyczne utlenianie o-dianizydyny skutkuje powstaniem zielono-brązowego produktu reakcji, który w wyniku zakwaszenia przekształca się w stabilny (purpurowo-czerwony) związek, dla którego maximum absorbancji przypada przy 540 nm [5].
W przeprowadzonych badaniach Lehmann i wsp. (1974) zaznaczyli, że absorbancja końcowego kolorowego roztworu zależy od ilości o-dianizydyny użytej w procedurze, i procedura ta pozwala na określenie aktywności ceruloplazminy w surowicy, z kolei aktywnośc podawana jest w U (jednostkach międzynarodowych) [5].
Procedura pomiaru aktywności oksydacyjnej ceruloplazminy osocza z wykorzystaniem o-dianidyzyny jako substratu (metoda opisana przez Lehmannn i wsp. 1974 ) [5].
Pomiar aktywności oksydacyjnej w skrócie przebiega w następujących etapach:
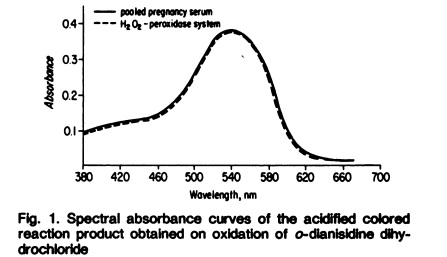
Zdjęcie: Lehmann H.P., Schosinsky K.H., Beeler M.F., 1974. Standardization of Serum Ceruloplasmin Concentrations in International Enzyme Units with o-Dianisidine Dihydrochioride as Substrate. CLINICALCHEMISTRY, Vol. 20, No. 12, 1974.
o-Dianizydyna utlenia się przez dodanie 0,05 ml nadtlenku wodoru i 0,01 mg peroksydazy do 0,75 ml buforu octowego (pH=5) i 0,2 ml odczynnika o-dianidyzyny. Roztwór inkubuje się w 30 st.C do momentu zakończenia reakcji (2 min). Następnie, dodaje się 2 ml 9mol/L kwasu siarkowego, w wyniku czego otrzymuje się kolorowy roztwór, którego absorbancję mierzy się przy 540 nm w 1-cm kuwetach względem blanku z dejonizowanej wody [5].
W trakcie badań przeprowadzonych przez Park Y. I wsp. (2009) określono aktywność oczyszczonej ceruloplazminy, która była optymalna w 100 mM buforze octanowym w pH=5.0. Oczyszczona ceruloplazmina wykazywała aktywnośc oksydazy równą 200 U/L w przeliczeniu metodą Lehmann i wsp. (1974) [1].
Metodą stosowaną rutynowo do pomiaru ceruloplazminy jest manualny test z O-dianizydyną, którego czułość wynosi ok. 6U/L (ze zmianą absorbancji 0,01) oraz górną granicą pomiaru wynoszącą 400 U/L. Detekcję wykonuje się przy długości fali równej 540 nm oraz w temperaturze 30st.C [3].
U ludzi ceruloplazmina wykorzystywana jest w celach diagnostycznych do wielu różnych schorzeń , w tym: reumatoidalnego zapalenia stawów, chorób wątroby, chronicznych infekcji czy chorób genetycznych (wspomnianej już choroby Wilsana) i nowotworów.
U zwierząt domowych, ceruloplazmina służy do określania stopnia niedoboru miedzi. Zwierzęta ze zdiagnozowanym niedoborem miedzi traktowane preparatami z miedzią wykazują zwiększoną aktywność ceruloplazminy oraz stężeniem miedzi we krwi [6].
Blakley B.R i Hamilton D.L. (1985) przedstawili metodę pomiaru aktywności oksydacyjnej ceruloplazminy w osoczu lub surowicy za pomoca metody kolorymetrycznej. Utlenianie p-fenylenodiaminy przez ceruloplazminę mierzono w próbkach, które poddano 1-godzinnej inkubacji w temperaturze 37 st.C w pH=6.0. Po upływie czasu inkubacji, reakcję zatrzymano przez dodanie azydku sodu. Następnie, aktywność enzymu określono przez zmierzenie absorbancji utlenionego produktu, wykorzystując w tym celu spektrofotometr [6].
W cząsteczce ceruloplazminy występuje od 6 do 7 atomów miedzi(II), które występują w 3 typach. Każdy typ różni się sposobem wiązania z resztami aminokwasowymi, co ma swoje pzrełożenie na różnice we właściwościach centrów miedziowych.
Aktualnie, znanych jest trzy rodzaje atomów występujących w cząsteczce ceruloplazminy, które opisano:
Oznaczanie zawartości miedzi związanej z cząsteczką enzymu, wykorzystywane jest do charakterystyki danego preparatu pod kątem jego czystości. Biorąc pod uwagę fakt, że ze wszystkich białek, które mogą występować w danej próbce, tylko ceruloplazmina zawiera miedź, jej określenie będzie świadczyć o czystości Cp. Jednakże, należy brać pod uwagę możliwość wystąpienia w preparacie miedzi pochodzącej z zanieczyszczeń, która nie będzie związana z cząsteczką enzymu, jednak będzie obecna w preparacie. Tego typu miedź na szczęście daje się łatwo usunąć ( przepuszczenie preparatu przez złoże jonowymieniacza Chelex-100). Zaletą tego typu jonowymieniacza jest to, że nie narusza on miedzi związanej z cząsteczką ceruloplazminy, gdyż atomy miedzi z Cp można usunąć dopiero, gdy próbkę zawiesi się w silnie kwaśnym środowisku (np. 1 M kwas solny czy CCl3COOH) [7].
Oznaczanie miedzi w ceruloplazminie [7].
Jak już wspomniano, w silnie kwaśnym środowisku 1M roztworu HCl dochodzi do odszczepienia miedzi z cząsteczki ceruloplazminy, w wyniku czego powstaje dietyloditiokarbaminian sodu (określany w skrócie jako Na-DDTK). Na-DDTK w środowisku zasadowym tworzy żółto zabarwiony kompleks. Powstające żółte zabarwienie kompleksu jest proporcjonalne do zawartości miedzi.
Wykonanie:
Jako materiał badany wykorzystuje się roztwór ceruloplazminy (3ml), do którego należy dodać 3ml 2M roztworu kwasu solnego (HCl), zaś po 20-minutowej inkubacji do próbki dodaje się 3 ml 20% CCl3COOH. Po upływie 10 minut próbke należy przesączyć, a do 3 ml otrzymanego przesączu dodać następująco:
W tak przygotowanej próbce oznaczyć wartość absorbancji (A) przy długości fali równej λ=440 nm, używając w tym celu kuwet o d=5 cm wobec wody (zastosowanej jako odnośnik w trakcie pomiarów). Następnie, po odjęciu wartości absorbancji (A) dla próby kontrolnej odczytuje się liczbę µg miedzi (Cu) z wykorzystaniem krzywej kalibracyjnej (bądź oblicza się tą ilość miedzi wykorzystując współczynnik kalibracji) [7].
Przygotowanie krzywej kalibracyjnej: do probówek odmierzyć po 0,2; 0,4; 0,6; 0,8 i 1 ml wzorcowego roztworu o stężeniu 5 µg Cu/, następnie uzupełnić je wodą do objętości 1,5 ml, po czym do każdej dodać: 1ml 2M HCl, CCl3COOH, 1ml stężonego roztworu NH3 i 0,5 ml roztworu DEDK. W próbkach oznacza się absorbancję (przy A440 nm) wobec wody. Po odjęciu wartości absorbancji dla próbki kontrolnej, należy wykreślić krzywą kalibracyjną (gdzie na osi x odkłada się liczbę µg miedzi) [7].
Kontrola: Jako kontrolę przygotowuje się próbkę zawierającą: 1ml 2 M HCl, 1ml 20% CCl3COOH, 1,5 ml H2O, 1 ml NH3, 0,5 ml 0,1% DEDK. W próbce tej oznacza się absorbancję przy 440nm względem wody (odnośnik) [7].
Dostępna obecnie wiedza o strukturze ceruloplazminy, pozwoliła na wyodrębnienie wielu znaczących fizjologicznych funkcji tego enzymu:
Ceruloplazmina wykazuje maksimum absorbancji przy 610 nm. Jest miedzioproteiną (zawierającą w cząsteczce miedź typu 1) o charakterystycznym niebieskim zabarwieniu. Białka wykazują zdolność do absorpcji przy 280 nm, co uwarunkowane jest obecnością w ich cząsteczkach aminokwasów aromatycznych. Wskaźnik stosunku absorbancji przy λ=610 nm do wartości A przy długości fali równej 280 nm (A610/ A280) jest bardzo odbrym kryterium określania czystości preparatów , w związku z czym stosunek ten z powodzeniem może być wykorzystywany rónież do pomiaru czystości preparatów ceruloplazminy, dla której w przypadku ceruloplazminy ludzkiej stosunek ten wynosi 0,046, zaś dla Cp śini i krowy mieści się w granicach 0,050 do 0,052 [7].
Peparat ceruloplazminy może być rozdzielony elektroforetycznie w żelu poliakrylamidowym, dzięki czemu możliwe jest określenie jego czystości. W celu wykrycia obecności białka w preparacie, żel poliakrylamidowy barwi się barwnikiem Coomassie , zaś w celu określenia aktywności oksydazowej - żele barwi się o-dianizydyną. Co więcej, żele wybarwiane Coomassie już po upływie 30 minut wykazują obecność niebieskich pasm białkowych (na jasnobrązowym tle).
Barwienie Coomassie nie wymaga odbarwiania żelu. Jeżeli chcemy wykryć aktywność oksydazową, przygotowany żel poliakrylamidowy umieszcza się w specjalnej mieszaninie reakcyjnej składającej się z 1ml 5% roztworu chlorowodorku o-dianizydyny i 3 ml 0,4 M buforu octanowego (o pH=5,5) z dodatkiem 6 ml etanolu. Po 60-minutowej inkubacji, żel płucze się wodą.
W tym przypadku na białym tle żelu powinny występować brązowo-czerwone pasma w miejscu występowania ceruloplazminy. Jeżeli bada się świńską ceruloplazminę, należy spodziewać się na żelu 4 pasm niebieskich (przy barwieniu barwnikiem Coomassie) oraz 4 pasm czerwonych (żele wybarwione o-dianizydyną), które będą występować w tych samych miejscach co pasma niebieskie [7].
Autor: Lidia Koperwas
Literatura:
[1]. Youmie Park, In Sun Lee, Eun Ji Joo E.J.,Bum-Soo Hahn, Yeong Shik Kim, 2009. A Novel and One-Step Purification of Human Ceruloplasmin by Acharan Sulfate Affinity Chromatography.
[2]. Harris Z. L., Takahashi Y., Miyajima H., Serizawa M., Mac Gillivray R.T.A., Gitlin J.D., 1995. Aceruloplasminemia: Molecular Characterization of this disorder of iron metabolism. Proc. Natl. Acad.Sci. USA Vol.92, pp. 2539-2543, March 1995 Medical Sciences
[3]. Fleming J.J., Santhosh S., Selvakumar R, Jose A., Eapen C.E., 2009. USEFULNESS OF FERROXIDASE ACTIVITY OF CERULOPLASMIN IN THE DIAGNOSIS OF WILSON’S DISEASE. Indian Journal of Clinical Biochemistry, 2009 / 24 (1) 15-22
[4]. http://www.chm.bris.ac.uk/motm/caeruloplasmin/caeruloplasmin/
[5]. Lehmann H.P., Schosinsky K.H., Beeler M.F., 1974. Standardization of Serum Ceruloplasmin Concentrations in International Enzyme Units with o-Dianisidine Dihydrochioride as Substrate. CLINICALCHEMISTRY, Vol. 20, No. 12, 1974\
[6]. Blakley B.R., HamiltonD.L., 1985. Ceruloplasmin as an Indicator of Copper Status in Cattle and Sheep. Can J Comp Med 1985; 49: 405-408. http://europepmc.org/articles/PMC1236200/pdf/compmed00004-0057.pdf
[7]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.535-538, 540-541.
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje