

|
Zamknij X
|
 Oksydoretuktazy są enzymami, które katalizują reakcje utleniania i redukcji. Wśród tej klasy enzymów wyróżnia się m.in. hydroperoksydazy (peroksydazy i katalazy). Peroksydazy katalizują reakcje utleniania nadtlenku wodoru (H2O2) różnych substratów, zaś katalazy rozkładają powstały nadtlenek wodoru. Peroksydazy zaliczane są do enzymów, które wykorzystują nadtlenek wodoru oraz inne nadtlenki organiczne jako substraty reakcji. Peroksydaza chroni organizm przed szkodliwym działaniem nadtlenków, ponieważ ich gromadzenie się może prowadzić do powstawania tzw. wolnych rodników, które następnie mogą uszkadzać błony komórkowe, a dodatkowo moga być jednym z czynników przyczyniających się do rozwoju miażdżycy i nowotworów [3].
Oksydoretuktazy są enzymami, które katalizują reakcje utleniania i redukcji. Wśród tej klasy enzymów wyróżnia się m.in. hydroperoksydazy (peroksydazy i katalazy). Peroksydazy katalizują reakcje utleniania nadtlenku wodoru (H2O2) różnych substratów, zaś katalazy rozkładają powstały nadtlenek wodoru. Peroksydazy zaliczane są do enzymów, które wykorzystują nadtlenek wodoru oraz inne nadtlenki organiczne jako substraty reakcji. Peroksydaza chroni organizm przed szkodliwym działaniem nadtlenków, ponieważ ich gromadzenie się może prowadzić do powstawania tzw. wolnych rodników, które następnie mogą uszkadzać błony komórkowe, a dodatkowo moga być jednym z czynników przyczyniających się do rozwoju miażdżycy i nowotworów [3].
Peroksydazy nie są tylko enzymami roślinnymi, znajdują się także w mleku, leukocytach czy płytkach krwi. W erytrocytach i innych tkankach występuje tzw. peroksydaza glutationowa. Jej grupą prostetyczną jest selen, a działanie polega na katalizowaniu w obecności zredukowanego glutationu rozkłąd nadtlenku wodoru i nadtlenków lipidów, dzięki czemu zapobiegane jest utlenianie lipidów błonowych i hemoglobiny przez nadtlenki. Peroksydaza glutationowa zaliczana jest do naturalnych przeciwutleniaczy. Występuje ona w wielu tkankach, a oprócz nadtlenku wodoru, działa ona również na nadtlenki organiczne. Wraz z witaminą E peroksydaza glutationowa jest częścią układu ochronnego przeciw peroksydacji lipidów [3]. Peroksydaza jest enzymem mało wrażliwym na wysoką temperaturę, co ciekawe jeszcze w temperaturze 100°C częściowo zachowuje swoją aktywność [4].
Z kolei, katalza wykorzystuje nadtlenek wodoru zaróno jako donor jaki i akceptor elektronów. Enzym ten jest hemoproteiną, która w swej czasteczce zawiera 4 grupy hemowe. Katalaza wykazuje aktywność peroksydazową, a dodatkowo może katalizować reakcje , gdzie jedna cząsteczka nadtlenku wodoru jest substratem oddającym elektrony, a druga cząsteczka H2O2 jest utleniaczem (akceptor elektronów). W warunkach in vivo katalaza wykazuje aktywność peroksydazową. Obecność katalazy stwierdzono we krwi, szpiku kostnym, błonach śluzowych, nerkach i wątrobie [3]. Obecnośc neidużych ilości katalazy wykazano w mitochondriach oraz retikulum endoplazmatycznym [6].Ponadto, enzym ten występuje u niektórych bakterii. W komórkach drożdźowych (S. cerevisiae) i E.coli stwierdzono dwa typy katalazy: katalazę typu A (atypowa, peroksymalna) oraz katalazę typu T (katalaza typowa, cytoplazmatyczna) [6].
W przeprowadzonych przez Gudelj M. i wsp. (2001) badaniach, wykorzystano nowy szczep Bacillus sp., który otrzymano z odpływu ścieków i zidentyfikowano jako Bacillus SF. Wyizolowany z tego szczepu kompleks katalaza-peroksydaza, charakteryzuje się dużą stabilnością pH oraz odporność cieplną. CP z bakterii oczyszczano z wykorzystaniem frakcjonowanego wytrącania siarczanem amonu i rozdziału chromatograficznego.
Oczyszczanie CP (katalazy-peroksydazy) z komóre Bacillus sp. (Bacillus SF) (procedura wg Gudelj M. i wsp., 2001).
Charakterystyka białka-elektroforeza
Otrzymane białko rozdzielono w żelu poliakrylamidowym za pomocą elektroforezy SDS-PAGE (z siarczanem dodecylu-sodu). Rozdział prowadzono w 12% żelach, z wykorzystaniem odpowiedniego markera masy cząsteczkowej . Białka na żelu barwiono barwnikiem Coomassie Brilliant Blue. Elektroforezę natywną PAGE przeprowadzono w 10% żelu poliakrylamidowym, który barwiono na aktywnośc katalazy za pomocą 0,001% nadtlenku wodoru (metoda opisana przez Harris i Hipkinson, 1976). Aktywnośc peroksydazy określono zgodnie ze zmodyfikowaną metodą Graham i wsp. (1964), przy użyciu gwajakolu lub o-dianizydyny jako substratu reakcji [7].
W przeprowadzonym doświadczeniu Gudelj M. i wsp.,2001), aktywność katalazy mierzono spektrofotometrycznie. Mieszanina testowa zawierała 100µl preparatu enzymu i 900 µl buforu fosforanowego (50 mM o pH=7). Reakcję zapoczątkowano przez dodanie 1,000 µl 26 mM H2O2 , po czym monitorowano spadek absorbancji przy 240 nm w temperaturze pokojowej. Liniowy zakres reakcji (30 sekund) użyto do obliczenia stopnia reakcji [7].
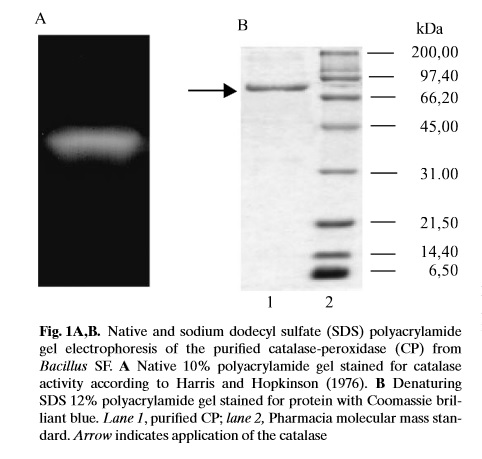
Zdjęcie: Rozdział elektroforetyczny oczyszczonej CP, [7]. http://www.mbio.ncsu.edu/mjc/old/20062007/Jae_paper.pdf
Katalaza jest tetramerem hemoproteinowym o masie cząsteczkowej równej 240 kDa. Kodowana jest przez gen jądrowy. Obecnie znane są 3 formy izienzymatyczne katalazy: CAT-1, CAT-2 oraz CAT-3. Formy CAT-1 i CAT-2 występują w miejscu obfitego występowania nadtlenku wodoru, a więc: w peroksysomach, glioksysomach, cytozolu- gdzie uniemożliwiają jego dalsze rozprzestrzenianie. Forma CAT-3 występuje w mitochondriach oraz cytozolu. Enzym ten przeprowadza tzw. dysmutację nadtlenku wodoru ( w wyniku czego tlen z nadtlenku wodoru zmienia stopień utlenienia) [5].W strukturze katalazy występuje hem- każda z podjednostek enzymu ma ukłąd hemowy, gdzie w centralnym położeniu znajduje się atom żelaza (Fe3+).
Dzięki zastosowaniu nowoczesnych technik molekularnych, w latach 80-tych XX wieku udało się poznać budowę oraz lokalizację ludzkiego genu kodującego katalaze. I tak, gen ten umoejscowiony jest na chromosomie 11 (ramię 13), składa się on z 13 eksonów, rozdzielonych między sobą za pomoca 12 intronów. Ogólną długośc całego genu szacuje się na ok. 34 kpz, gdzie region kodujący stanowi 1581 pz [6].
Zdjęcie: Cząsteczka katalazy, źródło: http://openwetware.org/wiki/Biomod/2012/Titech/Nano-Jugglers/Methods/Varification_catalase
Perokszdaza oraz katalaza są enzymami, które odgrywają bardzo ważną rolę w procesach regulacji wzrostu i rozwoju roślin. Przeprowadzone badania pozwoliły na określenie roli peroksydazy we wzroście i rozwoju roślin. I tak, stwierdzono, że peroksydaza bierze udział w syntezie lignin (Macur in., 1991) i utlenianiu kwasu indolilooctowego (IAA). Katalaza, z kolei odpowiada za rozkład nadtlenku wodoru, dzięki czemu enzym ten pełni rolę ochronną w roślinach. Podczas, gdy peroksydaza utlenia kwas IAA z wykorzystaniem nadtlenku wodoru, katalaza go rozkłada, tak więc enzymy te współgrają ze sobą. Zarówno peroksydaza jak i katalaz należą do pierwszej linii obronnej tzn. ich aktywność bardzo szybko wzrasta np. gdy występuje reakcja roślin na pojawienie się jakiegoś patogenu bądź w przypadku zadziałania określonego czynnika stresogennego [1]. Działanie katalazy i jej enzymatyczną funkcję po raz pierwszy określił Jacobson, Bourquelot i Loew, kiedy to stwierdzili, że katalaza powoduje rozkład nadtlenku wodoru na tlen i wodę [2].
Ogólnie peroksydazy (POX) można podzielić na dwie grupy:
Obniżona aktywność katalazy obserwowana jest w trakcie wystąpienia wielu chorób, w tym m.in. zapaleniu płuc, gruźlicy, miażdżycy, cukrzycy. Ponadto, zjawisko to obserwuje się w trakcie wystąpienia chorób neurodegeneracyjnym (np. chorobie Parkinsona czy Alzheimera). Przeprowadzone badania ujawniły, że w przypadku pojawienia się chorób, które poprzedzone są wystąpieniem stanów zapalnych, wzrasta aktywność katalazy w osoczu krwi. Małą aktywność katalazy we krwi obserwuje się przy miażdżycy i cukrzycy, co wskazuje na występowanie długotrwałego stresu oksydacyjnego w komórkach. Wykazano, że nadtlenek wodoru uszkadza komórki b trzustki, co przy niedoborze katalazy prowadzi do rozwoju cukrzycy . Wyraźne obniżenie aktywności obserwowano w wielu typach nowotworów np. głowy i szyi, płuc, przewodu pokarmowego, piersi, nerek czy w przypadku wystąpienia białaczki. Brak lub niedobór katalazy we krwi i innych tkankach organizmu, prowadzi do powstawania tzw. akatalasemii i hipokatalasemii. Brak katalazy (akatalasemia) lub jej niedobór (hipokatalasemia) objawiają się m.in. owrzodzeniem jamy ustnej, a zmiany te prowadzą u chorych do utraty zębów [6].
Peroksydazy należą do szeroko rozpowszechnionych enzymów. Spotyka się je zaróno w tkankach zwierzęcych jak i roślinnych, a nawet w bakteriach. Szeroka specyficzność enzymów, ich wielorakie właściwości, a także dostępnośc z różnych źródeł powodują, że enzymy te znalazły zastosowanie biologicznych i biochemicznych procesach. Z tego punktu widzenia najczęściej badanym i stosowanym enzymem jest peroksydaza chrzanowa (HRP). Do wykrywania aktywności peroksydazy wykorzystywane są metody kolorymetryczne, elektrochemiczne i chemiluminescencyjne. Klasyczne metody kolorymetryczne oparte są na monitorowaniu tworzenia barwnego produktu z bezbarwnego akceptora tlenu. Związki te obejmują benzydynę, o-dianizydynę i wiele innych. Metoda chemiluminescencyjna oparta jest na reakcji utleniania diacylohydrazydów, czemu towarzyszy emisja światła. Jednym z najbardziej zrozumiałych systemów jest HRP/nadtlenek wodoru –utlenianie z luminolem w warunkach alkalicznych [8].
Znane są dwa typy przemian prowadzące do powstania chemicznie indukowanej emisji światła. Rodniki lub rodnikojony (np. produkty elektrolizy soli organicznych) moga rekombinować na powierzchni elektrod, co w ostateczności prowadzić będzie do emisji światła. Zjawisko to określa się mianem elektrochemiluminescencji (ECL). Drugim typem przemian są reakcje utleniania, kiedy to cząsteczki reagują z tlenem cząsteczkowym lub z nadtlenkami. Reakcje te zachodzą zazwyczaj w obecności katalizatorów – enzymów. Wynikiem tego typu reakcji tworzą się produkty będące w stanie wzbudzonym i uwalniane są małe molekuły. Bardzo znanym przykładem jest wspomniane powyżej utlenianie luminolu ( w środowisku zasadowym) [9].
Peroksydaza askorbinianowa występuje w chloroplastach i cytozolu. Uważa się, że ten rodzaj peroksydazy wraz z katalazą odpowiedzialne są za ochronę komórek roślinnych przed szkodliwym działaniem nadtlenku wodoru oraz innych nadtlenków organicznych. U roślin wyższych peroksydazy występują w postaci kilku izoform, a jedną z nich jest właśnie peroksydaza askorbinianowa (APX). W chloroplastach enzym ten odpowoedzialny jest za usuwanie nadtlenku wodoru, który tam powstaje [10].
Opisana poniżej metoda stosowana jest do pomiaru spadku absorbancji przy λ=290 nm lub λ=265 nm w wyniku utleniania askorbinianu do dehydroaskorbinianu.
Materiał do badań: jako materiał do przeprowadzenia oznaczenia należy użyć liście fasoli lub pomidora
Wykonanie:
Do 1 g zhomogenizowanego materiału roslinnego należy dodać 10 ml 0,1M buforu fosforanowego (o pH=6.0) z PVP, EDTA i askorbinianem sodowym (tj. 0,1M bufor sodowofosforanowy o pH=6, 1% PVP(poliwinylopirolidon), 0,1M EDTA, 0,2 mM askorbinian sodowy). Tak przygotowana próbkę wytrząsać przez ok. 10 minut, po czym odwirować. Następnie, do probówki wprowadzić 1,8 ml 0,1M buforu fosforanowego (o pH=6.0), 100 µl ekstraktu enzymatycznego oraz 20 µl 5mM roztworu askorbinianu sodowego (przygotowany na świeżo pzred użyciem) oraz 100µl 1mM roztworu nadtlenku wodoru (H2O2). Próbkę inkubować w temperaturze 30°C [11].
Aktywnośc oznacza się na podstawie pomiaru spadku absorbancji między pierwszą i piąt aminuta po starcie reakcji, przy λ= 290 nm na spektrofotometrze z komora termostatową . Oznaczenie można rónież wykonac przy λ= 265 nm- w przypadku, gdy próba kontroln awykazuje dużą absorbancję. Równolegle do pomiaró wykonuje się oznaczenie próby kontrolnej , która w swoim składzie zamiast nadtlenku wodoru zawiera wodę. Z otzrymanych wynikó oblicza się aktywność, wykorzystują w obliczeniach milimolowe współczynniki absorpcji:
m e260= 2,8 mM -1cm -1 albo m e265 = 13,4 mM -1 cm -1 [11].
Częściowe oczyszczanie surowego ekstraktu enzymu przeprowadzono pzrez wytrącenie siarczanem amonu, a następnie zastosowano chromatografię jonowymienną. W trakcie doświadczenia zaobserwowano, że po częściowym oczyszczeniu aktywność enzymu zwiększyła się w porównaniu do surowego ekstraktu enzymu. Muhammad Anjum Zia i wsp.( 2011) opisali kilkuetapową metodę ekstrakcji i oczyszczania peroksydazy wraz z inaktywacją pozostałości katalazy i pomiarem aktywności enzymu[12].
Ekstrakcja enzymu (wg Muhammad Anjum Zia i wsp., 2011).
Peroksydazę ekstrahowano z nasion jabłek i pomarańczy z wykorzystaniem metody opisanej przez Geng i wsp. (2001) z niewielkimi modyfikacjami. Nasiona zostały oddzielone od suszu, po czym moczono je w 200 ml 0,1M buforze fosforanowym o pH=6.0 przez noc i dokładnie zhomogenizowano przez mieszanie w ciągu 15 -20 minut. Tak otrzymaną próbkę zwirowano 10 000 x g,w trakcie 15 minut, w celu usunięcia resztek komórkowych. Otrzymany po wirowaniu supernatant delikatnie usunięto znad osadu i przesączono przez bibułę filtracyjną Whatman No 1 w celu uzyskania próbki enzymu o większej przejrzystości [12].
Obróbka termiczna (wg Muhammad Anjum Zia i wsp., 2011).
W celu selektywnej inaktywacji śladów katalazy, otrzymaną próbkę surowego ekstraktu enzymu ogrzewano w temperaturze 65°C przez 3 minuty w kąpieli wodnej , po czym próbkę gwałtownie schłodzono przenosząc ja na 30 minut na lód (Wang i in., 1999). Po termicznej inaktywacji, ekstrakt przetrzymywano w temperaturze 4°C aż do momentu użycia [12].
Pomiar aktywności enzymu i stężenia białka (wg Muhammad Anjum Zia i wsp., 2011).
Aktywność enzymu oznaczano za pomocą spektrofotometru UV-VIS przy długości fali równej λ=470 nm, wg metody Rad i in. (2007) z niewielkimi modyfikacjami. Do pomiarów przygotowano mieszaninę pirokatechiny (170 mM) i aniliny (2,5 mM) w 0,2 M buforze fosforanowym ( o pH 6,5). Do każdego blanku i pustej kuwety do pomiaru próbki odpipetowano po 500 µl powyższej mieszaniny oraz 500 µl nadtlenku wodoru (35%). Próbki inkubowano w temperaturze 25° C przez 3 do 4 minut. Następnie, odpowiednio do blanków (kontrole) oraz próbek dodano po 50 µl ekstraktu enzymatycznego oraz 50 µl buforu fosforanowego. Wzrost wartości absorbancji rejestrowano z 4 do 5 minutowymi przerwami. Białko w próbce oznaczano metodą Lowry i in. (1951), gdzie stosuje się albuminę surowicy bydlęcej jako standard [12].
Częściowe oczyszczanie i dializa peroksydazy [12].
Do ekstraktu enzymatycznego dodano siarczanu amonu , aż o 50% nasycenia, po czym próbkę przechowywano przez 4 do 6 godzin w temperaturze 4° C. Wytrącony w tym czasie osad zebrano przez odwirowanie próbki przy 10 000 x g przez 15 minut, w temperaturze 4° C. Otrzymany po wirowaniu osad (wytrąconych białek) odrzucono. Do supernatantu dodawano ponownie siarczan amonu, do osiągnięcia 85% nasycenia w temperaturze 0° C. Próbkę ponownie inkubowano przez 4 do 6 godzin w temperaturze 4° C, po czy zwirowano jak wyżej. Po wirowaniu, oddzielono nadsącz, a otrzymany osad rozpuszczono w małej ilości buforu, w którym ekstrahowano enzym. Roztwór przeniesiono do worka dializacyjnego i dializowano wobec wody destylowanej przez kilka godzin zmieniając 4 razy wodę po upływie każdych 6 godzin [12].
Badani przeprowadzone przez Muhammad Anjum Zia i wsp. (2011) wykazały, że ekstrakt peroksydazy otrzymany z nasion pomarańczy wykazuje większą aktywność peroksydazy niż w przypadku ekstraktu z nasion jabłek. Dzieki temu też stwierdzono, że nasiona pomarańczy są bogatym źródłem peroksydazy w porównaniu do nasion jabłek. [12].
Autor: Lidia Koperwas
Literatura:
[1]. Mioduszewska H., 2001. Wpływ nawożenia azotem na aktywność peroksydazy i katalazy w bulwach ziemniaka odmiany Uran. NR 220 BIULETYN INSTYTUTU HODOWLI I AKLIMATYZACJI ROŚLIN 2001
[2]. http://www.ib-pan.krakow.pl/pubs-pdf/Wiadomosci%20Botaniczne/1963/7_a39-51.pdf
[3]. Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W.,1995. BIOCHEMIA HARPERA, Wydanie III, Redaktor naukowy tłumaczenia Franciszek Kokot. Wydawnictwo Lekarskie PZWL, s. 143/Utlenianiania Biologiczne
[4]. http://www.e-biotechnologia.pl/Artykuly/oksydoreduktazy
[5]. Małecka A., Tomaszewska B., 2005. Reaktywne formy tlenu w komórkach roślinnych i enzymatyczne systemy obronne. Postępy biologii Komórki, Tom 32, 2005 NR 2. http://specinfo.linuxpl.info/pbk/sites/default/files/pdfpub/311malecka.pdf
[6]. Ścibor D., Czeczot H., 2006. Katalaza- budowa, właściwości funkceje. Postepy Hig Med Dosw. (online), 2006; 60: 170-180
[7]. Gudelj M., Fruhwirth G.O., Paar A., Lottspeich F, Robra K.H., Cavaco-Paulo A., Gübitz G.M., 2001. A catalase-peroxidase from a newly isolated thermoalcaliphilic Bacillus sp. With potential for the treatment of textile bleaching effluents. ORIGINAL PAPER, Extremophiles (2001) 5:423–429 © Springer-Verlag 2001 Digital Object Identifier (DOI) 10.1007/s007920100218. http://www.mbio.ncsu.edu/mjc/old/20062007/Jae_paper.pdf
[8]. MACKOVA M. , FERRI E.N. ,DEMNEROVA K., MACEK T., 2001. QUANTITATIVE CHEMILUMINESCENT DETECTION OF PLANT PEROXIDASES USING A COMMERCIAL KIT ORIGINALLY DESIGNED FOR BLOTTING ASSAYS.Chem. Listy95, 130 -132 (2001) .
[9]. http://www.chem.univ.gda.pl/kchfiz/assets/Uploads/kchfiz/files/LZCh/LZChcw3-CLrev10-2012.pdf
[10]. http://www.biol.uw.edu.pl/zmfr/files/fizjologa_M1_skrypt.pdf
[11]. Ćwiczenia z biochemii pod redakcją L. Kłyszejko-Stefanowicz. Wydawnictwo Naukowe PWN, 2003, s.543-544.
[12]. Zia M.A., Kousar M,, Ahmed I., Iqbal H.M.N,, Abbas R.Z., 2011. Comparative study of peroxidase purification from apple and orange seeds. African Journal of Biotechnology Vol. 10(33), pp. 6300-6303, 6 July, 2011. Available online at http://www.academicjournals.org/AJB DOI: 10.5897/AJB10.2675 ISSN 1684–5315 © 2011 Academic Journals.
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje