

|
Zamknij X
|
Od kilku lat zaobserwowano wyraźne zainteresowanie badaniami dotyczącymi projektowania nowych leków przeciwwirusowych, przede wszystkim z powodu epidemii AIDS, ptasiej grypy oraz nasilających się nowych infekcji wirusowych. Aktualnie ilość dostępnych preparatów przeciwwirusowych stosowanych w terapii ma ograniczone możliwości o wąskim zakresie działania oraz dyskusyjną, niepewną skuteczność [1].
Związki selenoorganiczne zostały po raz pierwszy otrzymane w 1847 roku. Jednak dopiero na początku lat 70 XX wieku znalazły one zastosowanie w syntezie organicznej. Na podstawie dotychczasowych badań stwierdzono, że związki selenoorganiczne odznaczają się licznymi interesującymi właściwościami biologicznymi. Wykazano, że niektóre benzizoselenazol-3(2H)-ony, a także diselenidy są aktywnymi immunostymulantami, antyoksydantami, mimetykami peroksydazy glutationowej a także środkami o działaniu przeciwwirusowym, przeciwbakteryjnym, przeciwgrzybiczym oraz przeciwzapalnym. Odkrycie to pozwoliło nadać nowy kierunek badaniom nad związkami selenu projektowanymi jako leki, inhibitory enzymów, mimetyki oraz immunomodyfikatory [1].
Przez lata jedynymi związkami selenoorganicznymi testowanymi jako środki przeciwwirusowe były analogi nukleozydów, których rola polegała na blokowaniu procesu replikacji czy też transkrypcji materiału genetycznego wirusów [1]. Badania w ostatnich latach wykazały, że syntetyczne związki selenoorganiczne pochodne benzizoselenazol-3(2H)-onów i diselenidów, które posiadają struktury odmienne od testowanych do tej pory, także mogą hamować efekt cytopatyczny wirusów. Związki te mają możliwość stać się środkami przeciwwirusowymi nowej generacji. Wymaga to jednak prowadzenia skrupulatnych i regularnych badań, które doprowadzą do określenia relacji struktura-aktywność. Pozwoli to na otrzymanie właściwych związków selenoorganicznych oraz zaprojektowanie ich mechanizmu działania na poziomie molekularnym [2].
Aktywność biologiczna związków selenoorganicznych
Selen jest niezbędnym składnikiem organizmu ludzkiego. Występuje on we wszystkich jego komórkach w połączeniu z aminokwasami, cysteiną (selenocysteina) i metioniną (selenometionina) oraz w związkach z białkami. Selen wchodzi w skład około 20 enzymów. Jednym z najważniejszych enzymów zawierających selen jest peroksydaza glutationowa, która bierze udział w metabolizmie nadtlenku wodoru i chroni przed utlenianiem lipidów. Jako przeciwutleniacz selen uczestniczy w procesach metabolicznych na poziomie komórkowym, chroniąc błony komórkowe przed wolnymi rodnikami, dzięki czemu zmniejsza ryzyko wystąpienia nowotworów, chorób serca i naczyń krwionośnych. Jest niezbędny do prawidłowego funkcjonowania układu immunologicznego oraz przekazywania impulsów nerwowych w ośrodkowym układzie nerwowym. Ponadto wykazuje on działanie przeciwwirusowe, przeciwbakteryjne, przeciwgrzybicze oraz przeciwzapalne. Niedobór selenu powoduje zmniejszenie aktywności peroksydazy glutationowej selenozależnej. Sprzyja także chorobie mięśnia sercowego, układu krążenia, kostnego, nowotworom, infekcjom i przeziębieniom. Zarówno niedobór jak i nadmiar selenu jest szkodliwy dla organizmu [3].
Przez długi czas selen i jego połączenia były uważane za silną truciznę. Dopiero odkrycie w 1973 roku, że dwa bakteryjne enzymy zawierają selen spowodowało wzmożenie badań nad zastosowaniem tego pierwiastka. Poczyniono wiele badań w kierunku syntezy związków selenu i użyciem ich jako antyutleniaczy, induktorów cytokin, czynników antyinfekcyjnych, inhibitorów enzymów czy immunomodulatorów. Do związków selenoorganicznych posiadających aktywność biologiczną można zaliczyć [4]:
· pochodne benzizoselenazol-3(2H)-onów, o ogólnym wzorze:
· diselenidy diarylowe i dialkilowe:
R1SeSeR2, gdzie R1, R2 – alkil, aryl
· selenidy dialkilowe i diarylowe:
R1SeR2, gdzie R1, R2 – alkil, aryl
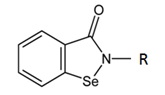
W ostatnich latach przeprowadzono liczne badania w celu określenia zależności pomiędzy strukturą związków selenoorganicznych, głównie benzizoselenazol-3(2H)-onów, a ich aktywnością przeciwwirusową. Przedstawiono projekt grupy związków, które zawierały liczne modyfikacje strukturalne w pierścieniu benzenowym wyjściowego benzizoselenazol-3(2H)-onu. Ukierunkowane modyfikacje strukturalne głównego związku z grupy benzizoselenazol-3(2H)-onów – 2-fenylobenzizoselenazol-3(2H)-onu (ebselenu) ogarnęły pierścień izoselenazol-3(2H)-onu, zwarty z nim pierścień benzenowy, a także podstawniki na atomie azotu (Rys. 1). Uzyskane pochodne ebselenu dały powód do dyskusji dotyczącej zależności między strukturą związku a jego aktywnością przeciwwirusową [5].
Rys.1. Modyfikacje struktury wiodącej ebselenu.
Metoda syntezy benzizoselenazol-3(2H)-onów (5) i ich analogów polega na przeprowadzeniu kwasów podstawionych w pozycji orto grupą aminową (1) bądź atomem chloru (2) we właściwe chlorki 2-(chloroseleno)benzoilu (4), a następnie na tandemowej reakcji selenenylowania-acylowania z pierwszorzędowymi aminami. Tak uzyskane benzizoselenazol-3(2H)-ony (5) przy użyciu wodzianu hydrazyny mogą być zredukowane do diselenidów (6) (Rys.2). Benzizoselenazol-3(2H)-on (R2 = H) reagując z izocjanianami, zapewnia właściwe pochodne karbamoilowe, natomiast jego sól potasowa w reakcji z halogenopochodnymi różne N-podstawione benzizoselenazol-3(2H)-ony [5].
Ogólną metodą syntezy benzizoselenazol-3(2H)-onów podstawionych w pierścieniu homoaromatycznym jest przeprowadzenie podstawionych pochodnych kwasu 2 chlorobenzoesowego lub antranilowego we właściwe chlorki 2-(chloroseleno)benzoilu, a następnie na ich reakcji tandemowego selenenylowania-acylowania z aminami pierwszorzędowymi. Dla syntezy 5-aminoacylobenzizoselenazol-3(2H)-onów przygotowano oddzielny sposób syntezy, który obejmuje selektywną redukcję grupy nitrowej [5].
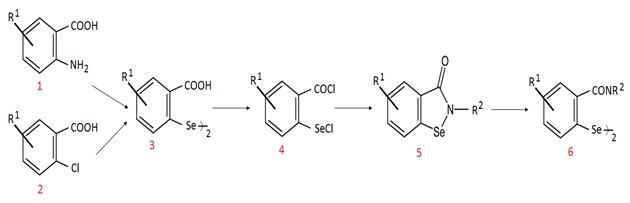
Rys. 2. Synteza benzizoselenazol-3(2H)-onów (5) oraz diselenidów (6).
Związki selenoorganiczne mogą być badane za pomocą rezonansu selenowego 77Se-NMR (spin jądrowy ½, rozpowszechnienie izotopu 8%). W metodzie tej wartości przesunięcia chemicznego są zależne od stosowanego rozpuszczalnika. Jako wzorzec zewnętrzny stosowany jest zazwyczaj roztwór selenidu dimetylowego w CDCl3 o umownej wartości przesunięcia chemicznego δ77Se = 0 ppm oraz roztwór (PhSe)2 w CDCl3, którego δ77Se = 463 ppm. Zaletami techniki 77Se NMR są diagnostyczne stałe sprzężenia z jądrami 1H, 13C i 31P oraz szeroki zakres wartości przesunięć chemicznych wynoszący ok. 3300 ppm, dzięki czemu istnieje małe prawdopodobieństwo nakładania się sygnałów. Technika 77Se NMR pozwala na badania konformacyjne związków selenoorganicznych w znacznie wyższych temperaturach (wyższe temperatury koalescencji) niż spektroskopia 1H i 13C NMR. Ponadto czułość techniki 77Se NMR jest porównywalna z czułością techniki 13C NMR i nie wymagane jest wzbogacenie izotopowe próbki [6].
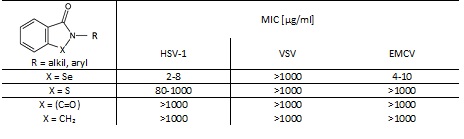
Wykazano aktywność przeciwwirusową związków selenoorganicznych względem trzech wirusów należących do różnych grup systematycznych. Należą do nich: HSV-1 - wirus opryszczki typu 1 (posiadający osłonkę wirus DNA z rodziny Herpesuiridae), EMCV - wirus zapalenia mózgu i mięśnia sercowego (nieposiadąjący osłonki wirus RNA z rodziny Picornaviridae) oraz VSV - wirus pęcherzykowatego zapalenia jamy ustnej (posiadający osłonkę wirus RNA z rodziny Rhabdouiridae). Miarą aktywności przeciwwirusowej jest minimalne stężenie hamujące rozwój wirusa (MIC). Jest ono zdefiniowane jako najmniejsze stężenie związku, które powoduje spadek miana wirusa o 100 (dla HSV-1) bądź 1000 (dla EMCV i VSV) w stosunku do próby kontrolnej [5].
Modyfikacje strukturalne benzizoselenazol-3(2H)-onów a ich aktywność przeciwwirusowa
W celu udowodnienia aktywności przeciwwirusowej selenu zsyntezowano właściwe benzizoselenazol-3(2H)-ony i ich izostrukturalne analogi, gdzie atom selenu został zastąpiony siarką, ugrupowaniem metylenowym lub karbonylowym. Często pewne właściwości związków organicznych selenu są zbliżone do siarkowych analogów [5].
Stwierdzono wysoką aktywność przeciwwirusową związków selenoorganicznych wobec wirusów EMCV (MIC 4-10 µg/ml) i HSV-1 (MIC 2-8 µg/ml) oraz zupełną nieaktywność w stosunku do VSV (MIC > 1000 µg/ml). Natomiast siarkowe analogi benzizoselenazol-3(2H)-onów były nieaktywne wobec VSV i EMCV (MIC > 1000 µg/ml). Wobec HSV-1 ich aktywność była dużo słabsza niż właściwych analogów selenowych (MIC 80-1000 µg/ml). Do zupełnej utraty aktywności przeciwwirusowej doprowadziła zamiana atomu selenu na grupę karbonylową lub metylenową. Uzyskane wyniki potwierdzają jak ważna jest rola selenu na oddziaływanie przeciwwirusowe [5].
Tabela 1. Aktywność przeciwwirusowa benzizoselenazol-3(2H)-onów oraz ich izostrukturalnych analogów
Na podstawie uzyskanych wyników przeprowadzono badania polegające na zaangażowaniu selenu w oddziaływania biologiczne z innymi połączeniami, takimi jak funkcja selenidowa czy też diselenidowa. W wyniku tego otworzono pierścień izoselenazol-3(2H)-onu, gdzie otrzymano szereg otwartopierścieniowych pochodnych benzizoselenazol-3(2H)-onów i diselenidów, zsyntezowano również kilka pochodnych selenidowych. Wykazano, że cykliczne benzizoselenazol-3(2H)-ony i otwartopierścieniowe diselenidy posiadają wysoką aktywność wobec wirusów EMCV i HSV-1 (MIC 2—40 µg/ml), natomiast selenidy były zupełnie nieaktywne (MIC > 1000 µg/ml). Wyniki te pozwalają wysnuć hipotezę, że aktywność przeciwwirusowa wiąże się głównie z możliwością dostępności atomu selenu w reakcjach z grupami tiolowymi biologicznych receptorów oraz zdolności tworzenia wiązania Se-S [5].
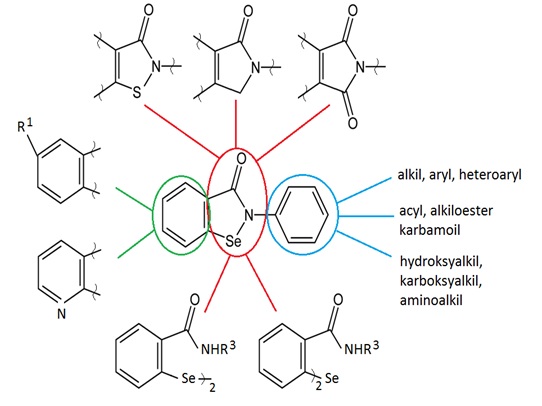
Uzyskanie benzizoselenazol-3(2H)-onów posiadających swoiście dobrane N-podstawniki miało za zadanie stwierdzenie wpływu różnych grup funkcyjnych na poziom aktywności przeciwwirusowej. Dlatego wprowadzono na atom azotu grupy: alkilowe, acylowe, arylowe, heteroarylowe, karbamoilowe, alkiloestrowe, a także hydroksy,- karboksy- i amino alkilowe [5].
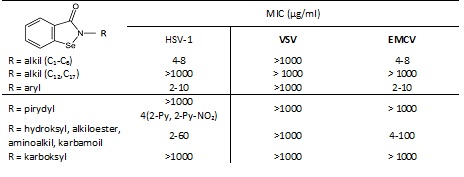
Tabela 2. Aktywność przeciwwirusowa N- podstawionych benzizoselenazol-3(2H)-onów.
W przypadku alkilowych jak i arylowych analogów pochodnych benzizoselenazol-3(2H)-onów, aktywność przeciwwirusowa dotyczyła tylko wirusów HSV-1 oraz EMCV ponieważ związki te posiadały wysoką aktywność anty-HSV-1 i anty-EMCV (MIC 2-10 µg/ml). Wyjątek stanowiły pochodne: adamantylowa oraz trotylowa, których aktywność była znacznie niższa (MIC > 100 µg/ml). Przypuszczalnie jest to związane z przeszkodą sferyczną utworzoną przez w miarę duże podstawniki. Nieaktywne pozostały także prawie wszystkie pochodne pirydynowe. Pokaźną aktywność wobec wszystkich trzech wirusów (MICHSV = 20 µg/ml, MICEMCV = 20 µg/ml, MICVSV = 80 µg/ml), wykazał N-metylojodek 2-(3-pirydylo)benzizoselenazol-3(2H)-onu [5].
Metylojodki 119 są aktywniejszymi czynnikami przeciwwirusowymi aniżeli ebselen 6. Działają one jako inhibitory wirusa opryszczki (HSV-1), a także wirusa zapalenia mózgu i mięśnia sercowego (EMCV). Wartości minimalnego stężenia hamującego MIC obejmowały zakres 0,4-6,0 µg/ml. Wirus pęcherzykowatego zapalenia błony jamy gębowej bydła (VSV) był oporny na większość związków selenoorganicznych. Wyjątek stanowił umiarkowanie aktywny metylojodek 120 [5].
Wysoką aktywność anty-HSV-1 (MIC 4-8 µg/ml) i anty-EMCV (MIC 4-8 µg/ml) posiadały pochodne, które zawierały krótkie łańcuchy alkilowe. Natomiast długołańcuchowe podstawniki alkilowe przyczyniały się do spadku aktywności związków (MIC > 1000 µg/ml). Przypuszczalnie ma na to wpływ ich słaba rozpuszczalność, następstwem czego była obniżona biodostępność. W stosunku do wszystkich przebadanych związków wirus VSV wykazał zupełną oporność [5].
Natomiast w grupie pochodnych, które zawierały N-podstawniki mające dodatkowe moduły funkcyjne, związki zawierające grupy estrowe, karbamoilowe, hydroksylowe i aminowe posiadały wysoką aktywność anty-HSV-1 (MIC 2-60 µg/ml) i anty-EMCV (MIC 4-100 µg/ml). Zaobserwowano jednak znaczny spadek aktywności wśród analogów karboksylowych [5].
Wprowadzenie heterocyklicznego atomu azotu i dodatkowych podstawników na atomie węgla C-5, takich jak: chlor, grupa nitrowa, metylowa i metylosulfonowa, przyczyniło się do otrzymania modyfikacji pierścienia benzenowego skondensowanego z pierścieniem izoselenazol-3(2H)-onu. Prawdopodobnie obecność różnych podstawników w pierścieniu benzenowym może spowodować dodatkowe międzycząsteczkowe oddziaływania, co może w dużej mierze wpływać na aktywność przeciwwirusową. Wzmocnienie siły oddziaływania związku z receptorem biologicznym może nastąpić również przez wprowadzenie heterocyklicznego atomu azotu, a w następstwie wytworzenie kolejnego miejsca wodoroakceptorowego [5].
Tabela 3. Aktywność przeciwwirusową C5-podstawionych benzizoselenazol-3(2H)-onów.
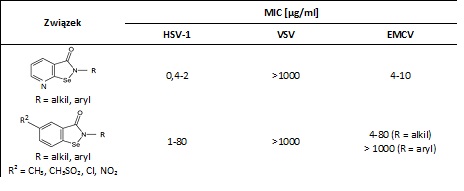
Przedstawione dane wskazują, że wprowadzenie atomu azotu do pierścienia benzenowego doprowadza do wzrostu aktywności względem wirusa HSV-1. Związki z grupy 7-azabenzizoselenazol-3(2H)-onów są około 10-krotnie aktywniejsze (MIC 0,4-2 µg/ml) od swych analogów, które nie posiadają heterocyklicznego atomu azotu (MIC 2-8µg /ml). Natomiast aktywność macierzystych benzizoselenazol-3(2H)-onów była w miarę porównywalna do aktywności anty-EMCV azanalogów (MIC 4—10 µg/ml) [5].
W stosunku do wirusa HSV-1 aktywność przeciwwirusowa benzizoselenazol-3(2H)-onów podstawionych w pozycji C-5 była niewiele wyższa (MIC 1-80 µg/ml) od zauważalnej dla związków niepodstawionych. W przypadku wirusa EMCV tylko pochodne alkilowe wykazały zbliżony poziom aktywności (MIC 4-80µg/ml), podczas gdy analogi arylowe były zupełnie nieaktywne (MIC > 1000 µg/ml). Tymczasem wobec wirusa VSV przebadane związki okazały się całkowicie nieaktywne [5].
Podsumowanie
W ostatnich latach uzyskano obiecujące wyniki dotyczące aktywności przeciwwirusowej związków selenoorganicznych. Na działanie tych związków okazały się wrażliwe wirusy: opryszczki typu 1 (HSV-1), zapalenia mózgu i mięśnia sercowego (EMCV) oraz pęcherzykowatego zapalenia jamy ustnej (VSV). Wiele laboratoriów na świecie zaangażowanych jest w poszukiwanie nowych związków selenoorganicznych, które wykazałyby działanie przeciwwirusowe. Selen jest bardzo ważny dla funkcjonowania systemu immunologicznego, dlatego też istnieje potrzeba poszukiwania dodatkowych wiadomości dotyczących roli selenu i jego związków w oddziaływaniu przeciwwirusowym. Informacji takich może dostarczać analiza strukturalna w oparciu o obliczenia kwantowo-chemiczne i rezonans selenowy 77Se-NMR. Wprowadzenie modyfikacji strukturalnych daje możliwość poznania zależności pomiędzy strukturą a aktywnością. Zsyntezowane związki wykazały aktywność biologiczną in vitro względem wybranych modelowych wirusów. Stały się więc podstawą nowej klasy związków przeciwwirusowych. Przedstawione dane wskazują, że struktury wybranych związków selenoorganicznych są efektywnymi składnikami mogącymi znaleźć zastosowanie w profilaktyce i leczeniu chorób wywołanych przez wirusy. Istnieje jednak konieczność prowadzenia dalszych badań w tym zakresie. Planowane są badania naukowe dotyczące syntezy, a także badania biologiczne innych C-podstawionych benzizoselenazolo-3(2H)-onów, ich azaanalogów z atomem azotu w pozycji 4, 5 albo 6, jak również nowych układów heterocyklicznych, które zawierają w swej strukturze endo- i egzocykliczny atom selenu. Wyniki tych badań mogą wnieść wiele informacji koniecznych do ustalenia mechanizmu działania przeciwwirusowego związków selenoorganicznych.
Autor: Katarzyna Czuba
Literatura:
1. Soriano-Garcia M. Organoselenium compounds as potential therapeutic and chemopreventive agents. Curr. Med. Chem. 2004. 11,1657-1669.
2. Wójtowicz H., Chojnacka M., Młochowski J., Palus J., Syper L., Hudecova D., Uher M., Piasecki E., Rybka M. Functionalized alkyl and aryl diselenides as antimicrobial and antiviral agents: synthesis and properties. Farmaco. 2003. 58, 1235- 1242.
3. Puzanowska-Tarasiewicz H., Kuźmicka L., Tarasiewicz M. Funkcje biologiczne pierwiastków i ich związków. II. Selen, seleniany, związki selenoorganiczne. Pol. Merk. Lek. 2009. XXVII. 159. 249-252.
4. Lisiak R. Badanie wpływu elementów struktury wybranych związków selenoorganicznych na ich reaktywność. Rozprawa doktorska. Wrocław 2009.
5. Piętka-Ottlik M., Kołodziejczyk K., Kloc K., Młochowski J. Wpływ struktury wybranych związków selenoorganicznych na ich aktywność przeciwwirusową. Na pograniczu chemii i biologii. 2006. Tom XVI. 83-91
6. Majewski A. Nowa metoda selenylowania z użyciem diselenidu bis(o,o-diizopropylofosforotioilu). Rozprawa doktorska. Gdańsk 2012.
7. http://connectwithwellness.wordpress.com/2011/05/26/selenium-and-your-immune-system/
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje