

|
Zamknij X
|
Termin glikacja odnosi się do wieloetapowego procesu zachodzącego spontanicznie bez udziału enzymów. W jej wyniku powstają zaawansowane końcowe produkty glikacji, które określane są skrótem AGE (ang. Advanced Glycation End-Products). Proces glikacji zachodzi zarówno w organizmach żywych, jak i in vitro [2]. Reakcje glikacji opatrzone są nazwą reakcji Maillarda. Nazwa wywodzi się od nazwiska francuskiego chemika Louisa-Camilla Maillarda, który jako pierwszy w 1919 rok badał reakcje pomiędzy cukrami, a białkami w produktach żywnościowych [2]. Cały proces glikacji zachodzi w organizmach żywych bardzo powoli, ponieważ tylko mała część glukozy występuje w postaci otwartej, zawierającej wolną grupę aldehydową, która może reagować z grupami aminowymi białek [6].
Glikacja jest główną przyczyną spontanicznych uszkodzeń białek. Proces ten jest szczególnie niekorzystny w przypadku cukrzycy- jako konsekwencja wzrostu glukozy i innych pochodnych sacharydów w osoczu [4]. W trakcie glikacji zachodzi reakcja grupy aldehydowej cząsteczki monosacharydu (zazwyczaj jest nią glukoza) z wolnymi grupami aminowymi różnych białek. W jej wyniku powstaje tzw. hemoglobina glikowana (GHB, glikohemoglobina). Spośród znanych kilku frakcji hemoglobiny glikowanej największe znaczenie diagnostyczne ma frakcja HbA1c (A1c) [11]. Reakcji tej ulegają wszystkie białka, w których cząsteczkach wyróżnia się wolne grupy aminowe. Wśród białek krwi znane są glikowane formy hemoglobiny, albuminy, lipoprotein oraz białek układu krzepnięcia. Ponadto, glikacji ulegają również białka strukturalne, takie jak kolagen i białka wewnątrzkomórkowe. Proces glikacji powoduje zmianę struktury i funkcji wielu białek,a także odgrywa istotną rolę w patogenezie przewlekłych powikłań cukrzycy [1].
Ilość powstających produktów glikacji białek zależy od stężenia substratów oraz lokalnych zmian pH. Z racji tego,że stężenia białek osocza i hemoglobiny są zwykle stałe, nasilenie glikacji tych białek jest wynikiem współdziałania dwóch czynników, tj.: średniego stężenia glukozy, a także czasu, w jakim białko było eksponowane na kontakt z cząsteczkami glukozy. Zależność pomiędzy stężeniem glukozy, a zawartością białek glikowanych stała się bardzo ważnym parametrem wykorzystywanym w monitorowaniu leczenia cukrzycy. W tym celu oznacza się hemoglobinę glikowaną oraz albuminę glikowaną (oznaczana jako fruktozaminę). Fruktozamina jest ketoaminową formą białka, która powstaje po przegrupowaniu cząsteczki utworzonej w wyniku reakcji glukozy z grupą aminową reszt lizynowych. Zazwyczaj oznaczana jest w przypadku, gdy występują trudności z oznaczeniem HbA1c lub u kobiet ciężarnych z cukrzycą [1], [12].
O poziomie AGE w ustroju decyduje nie tylko szybkość ich wytwarzania, lecz również tempo usuwania. W warunkach homeostazy AGE podlegają rozkładowi proteolitycznemu w lizosomach komórek, a powstałe produkty degradacji wydzielane są do krążenia i wydalane z moczem. Pewna ilość AGE może być również usuwana z krążenia przez wątrobę, za co odpowiedzialne są tzw. komórki Kupffera (stanowiące 15-20% wszystkich komórek wątroby) oraz śródbłonek tkanki wątroby [3].
Coraz częściej w rutynowej diagnostyce laboratoryjnej wykorzystuje się oznaczanie fruktozaminy z użyciem metody kolorymetrycznej, która oparta jest na redukcji błękitu nitratetrazoliowego. Metoda stosowana jest jako retrospektywny miernik glikemii ostatnich 2–3 tygodni (okres półtrwania albuminy) oraz glikowanej hemoglobiny (HbA1c). Z kolei, metody chromatograficzne z zastosowaniem jonowymiennych kolumn kationowych, stosowane są jako miernik glikemii ostatnich trzech miesięcy (okres życia erytrocytów) [2].
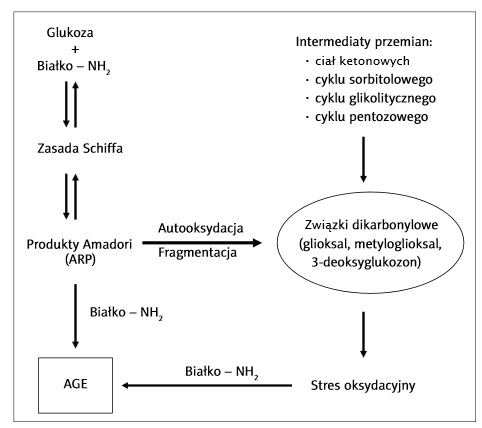
Zdjęcie: Schemat powstawania AGE w organizmie, http://www.ptfarm.pl/pub/File/Farmacja%20Polska/2010/08-2010/11%20%20AGE.pdf
Do oznaczenia wykorzystywana jest pełna krew żylna, która pobierana jest na EDTA lub heparynę. Możliwe jest również przeprowadzenie badania w krwi włośniczkowej pobieranej do specjalnie heparynizowanych kapilar i probówek z czynnikiem hemolizującym. Oznaczenie frakcji HbA1c powinno być wykonywane jak najszybciej z racji tego, że glikacja zachodz również in vitro (jej stopień uzależniony jest od aktualnego stężenia glukozy) [11]. Pobrana krew może być też przechowywana- jednak nie dłużej niż tydzień w temp. +4°C. Dłuższe przechowywanie pełnej krwi (lub hemolizatu) powoduje późniejsze zakłócenia w oznaczaniu frakcji z wykorzystaniem metod chromatograficznych. [11].
Najczęściej występujące czynniki zakłócające oznaczanie frakcji HbA1c:
Na rynku dostępne są różne zestawy testowe, które umożliwiają pomiar stężenia wczesnych produktów glikacji białek. Do najpowszechniej stosowanych technik oznaczania AGE w materiale biologicznym (takim jak surowica krwi czy mocz) zalicza się metody: spektrofluorescencyjne oraz immunoenzymatyczne. Dostępne są komercyjne testy typu ELISA do pomiaru stężenia prekursorów AGE (np. karboksymetylolizyny – CML). Inny prekursor -pentozydynę oznacza się najczęściej w moczu za pomocą wysokosprawnej chromatografii cieczowej (HPLC). Taka próbka nie wymaga hydrolizy, ponieważ występuje ona w moczu w formie wolnej, z kolei w osoczu większość pentozydyny jest związana z białkami i oznaczenie całkowitej zawartości wymaga uprzedniej hydrolizy [2].
Proces glikacji może zachodzić zarówno wewnątrz komórek, jak i pozakomórkowo we wszystkich tkankach i płynach ustrojowych. Należy podkreślić, że zjawisko glikacji dotyczy nie tylko białek, ale również DNA czy lipidów. W życiu płodowym obserwuje się duże ilości glikowanych białek w komórkach macierzystych [3]. W warunkach fizjologicznych proces glikacji przebiega powoli przez całe życie, stopniowo prowadząc do starzenia się organizmu. Reakcji glikacji zazwyczaj ulegają białka, które charakteryzują się długim okresie półtrwania. Wśród nich wyróżnia się: kolagen, krystalinę soczewki czy albuminę osoczową. Obecne w AGE wiązania krzyżowe przyczyniają się do wzrostu sztywności białek, a dalej wysokospolimeryzowane i usieciowane białka tracą swoje biologiczne funkcje. To z kolei utrudnia ich usuwanie z komórek i tkanek organizmu. Nieusunięte białka kumulują się w postaci złogów, powodując usztywnienie ścian naczyń oraz tkanek. Przeprowadzone badania wykazały postępujący wraz z wiekiem wzrost glikacji białek tkanki łącznej m.in. w ścięgnach i aorcie oraz nasiloną modyfikację kolagenu skóry u osób niewykazujących objawów cukrzycy. Zaobserwowane zjawisko wywiera bezpośredni wpływ na rozwój chorób związanych z wiekiem. Co więcej, wszystkie zmiany patofizjologiczne dodatkowo stymulowane są przez stres oksydacyjny, który towarzyszy powstawaniu AGE. Wykazano, że glikacja nasila się w stanie ostrej i chronicznej glikemii, dlatego też to właśnie w cukrzycy znacznie wcześniej dochodzi do akumulacji AGE w krążeniu oraz w różnych tkankach i narządach [3], [5]. Spośród białek, które ulagają nieenzymatycznej reakcji glikacji duże znaczenie w diagnostyce cukrzycy mają hemoglobina, albumina, kolagen i krystalina. Oznaczenie glikowanej hemoglobiny i albuminy jest istotne w diagnostyce hiperglikemii. Proces glikacji kolagenu i innych białek macierzy u chorych na cukrzycę prowadzi do sztywnienia ścian naczyń żylnych i tętniczych, zaś glikacja krystaliny soczewki oka sprzyja wytworzeniu się katarakty. Wciąż trwają badania mające na celu wynalezienie leku, który zapobiegałby procesowi glikacji. Jego odkrycie byłoby przełomem w terapii cukrzycy [7].
Wśród najczęście stosowanych metod oznaczania stężenia hemoglobiny glikowanej wyróżnia się:
1) Metody wykorzystujące różnice w ładunku: hemoglobina glikowana HbA1c oraz hemoglobina HbA wykazuja niewielkie różnice w punkcie izoelektrycznym. Przy odpowiednim pH obydwie hemoglobiny mają różne ładunki elektryczne, a dzięki temu możliwe jest ich oznaczanie z wykorzystaniem chromatografii jonowymiennej, chromatografii powinowactwa, elektroforezy czy ogniskowania izoelektrycznego [10], [1]. Chromatografia jonowymienna jest metodą rozdziału frakcji hemoglobiny, opierającą się na ładunku cząsteczek. W metodzie wykorzystywane są kationowe żywice jonowymienne. Związanie wolnych grup aminowych z cząsteczkami glukozy powoduje, że hemoglobina glikowana w środowisku kolumny chromatograficznej wykazuje mniejsz ładunek ujemny od hemoglobiny A. Znane są dwa rodzaje chromatografii jonowymiennej tj.: niskociśnieniowa oraz wysokociśnieniowa chromatografia cieczowa (określana jako HPLC). Z kolei, w chromatografii powinowactwa wykorzystywana jest pochodna kwasu borowego, która związana jest z podłożem wypełniającym kolumnę. W wyniku reakcji cząsteczki hemoglobiny glikowanej są wiązane kowalencyjnie przez wytworzenie pierścieniowego połączenia z udziałem atomu boru. W wyniku dysocjacji następuje elucja hemoglobiny glikowanej oraz pomiar stężenia w zebranej frakcji. Podobnie jak chromatografia jonowymienna, również wyróżnia się jej dwie odmiany (niskociśnieniową i wysokociśnieniową) [1].
2) Metody oparte o różnice strukturalne: hemoglobina HbA1c w przeciwieństwie do hemoglobiny A posiada glukozę połączoną z N-końcową waliną β-globiny. Zależność tą wykorzystuje się w oznaczaniu hemoglobin metodą chromatografii powinowactwa, immunochemiczną czy spektrometrią masową [10].
Oznaczanie glikowanej hemoglobiny (HbA1c) z wykorzystaniem zestawu odczynników Horiba ABX Pentra HbA1c WB i analizatora Pentra C200 (wg Urbaniak J. i Woźniak M., 2012).
Oznaczanie HbA1c w monitorowaniu leczenia cukrzycy rozpowszechniło się w latach 90-tych, kiedy to ogłoszono wyniki badań Diabetes Control and Complications Trial (DCCT) oraz United Kingdom Prospective Diabetes Study (UKPDS). W badaniach tych wykazano, że odsetek HbA1c jest nie tylko retrospektywnym wskaźnikiem wyrównania metabolicznego cukrzycy, lecz również niezależnym czynnikiem ryzyka rozwoju przewlekłych powikłań choroby. Dzięki temu, zgodnie z rekomendacjami towarzystw diabetologicznych (min. Polskiego Towarzystwa Diabetologicznego) zaczęto stosować oznaczanie hemoglobiny glikowanej u chorych na cukrzycę w momencie rozpoznania choroby, a następnie co 3 miesiące. W przypadku stabilnie przebiegającej, dobrze wyrównanej metabolicznie choroby , zaleca się wykonywanie oznaczeń HbA1c co pół roku [1].
Hemoglobina HbA1c wykorzystywana jest do wykrywania oraz do oceny ryzyka rozwoju cukrzycy u osób z upośledzoną tolerancją glukozy. Wciąż badane są nowe metody oznaczania HbA1c, gdyż jej rola w wykrywaniu cukrzycy wciąż rośnie. Co ważne, ten rodzaj hemoglobiny wykazuje mniejszą zmienność biologiczną w porównaniu do glikemii [8]. Ważne znaczenie ma fakt, że oznaczenie może być wykonywane w materiale pobranym o dowolnej porze dnia, niezależnie od spożywanych pokarmów czy aktywności fizycznej, co znacznie ułatwia prowadzenie badań [8].
Urbaniak J. i wsp. (2012) przeprowadzili badania mające na celu zbadanie przydatności krwi przechowywanej w postaci suchej kropli na bibule, w oznaczaniu hemoglobiny glikowanej HbA1c. Oznaczenie pzreprowadzono z wykorzystaniem metody immunoturbidymetrycznej. Do badań wykorzystano krew pobraną od 47 pacjentów, którą następnie nanoszono na bibułę typu Whatman 3. Tak przygotowane próbki suszono, a dalej przechowywano przez 24 godziny, 72 godziny lub 7 dni. Zawartość hemoglobiny glikowanej (HbA1c) we krwi pełnej i suchej kropli krwi oznaczano z wykorzystaniem gotowego zestawu odczynników (Horiba ABX Pentra HbA1c WB) przy użyciu analizatora Pentra C200 [8].
W swoich badaniach Urbaniak J. i wsp. (2012) wykorzystywali losowo wybrane próbki, które stanowiły krew żylną pobraną na wersenian. W próbkach tych w badaniach kontrolnych oznaczono stężenie HbA1c [8].
Wykonanie (wg Urbaniak J., Woźniam M., 2012)
Oznaczenie prób wykonywano w hemolizacie krwi wg instrukcji producenta dołączonej do zestawu odczynników.
1) 10 µl krwi pełnej zmieszano z 500 µl odczynnika lizującego (ABX Pentra WB Hemolysis Reagent). Próbkę dokładnie wymieszano, a następnie inkubowano 15 minut w temperaturze pokojowej. Po uplywie czasu inkubacji otrzymany hemolizat umieszczano w rotorze próbkowym aparatu i przeprowadzono analizę.
2) Równolegle nanoszono 20 μl każdej próbki badanej krwi pełnej na paski bibuły chromatograficznej typu Whatman 3MM, bibuły suszono, a następnie przechowywano przez 24 godziny , 72 godziny lub 7 dni w temperaturze pokojowej (w papierowych kopertach).
3) W kolejnym etapie suchą kroplę wycinano z bibuły (dzieląc ją na 3 części). Bibułę umieszczano w probówce typu Eppendorfa i dodawano do niej 500 μl odczynnika lizującego (tj. ABX Pentra WB Hemolysis Reagent). Po 15 minutowej inkubacji w probówce całość delikatnie mieszano. W ostatnim etapie otrzymany hemolizat przenoszono do naczyńka próbkowego analizatora i poddawano go analizie [8].
Powyższy zestaw składa się z odczynników umożliwiających przeprowadzenie dwóch niezależnych oznaczeń. Tak więc, możliwe jest oznaczenie hemoglobiny całkowitej z wykorzystaniem metody kolorymetrycznej, jak również frakcji HbA1c metodą immunoturbidymetryczną. Oznaczanie hemoglobiny całkowitej polega na konwersji wszystkich form hemoglobiny w hematynę zasadową. Reakcja zachodzi w zasadowym roztworze detergentu niejonowego, a w jej wyniku dochodzi do zmiany barwy roztworu, której natężenie jest wprost proporcjonalne do stężenia hemoglobiny w badanej próbce. W metodzie immunoturbidymetrycznej wykorzystuje się agregację cząstek lateksu, które opłaszczone są przeciwciałami monoklonalnymi skierowanymi przeciwko HbA1c (anty-HbA1c) po dodaniu syntetycznego polimeru (zawierającego wiele kopii immunoreaktywnej HbA1c) [8],[9]. HbA1c z próbki pacjenta konkuruje o miejsca wiązania na cząsteczkach przeciwciała anty-HbA1c opłaszczonych na lateksie,w wyniku tego dochodzi do hamowania aglutynacji. W konsekwencji uzyskuje się mniejsze rozproszenie światła (spadek absorbancji) [10].Z kolei, tworzenie kompleksów w zawiesinie powoduje wzrost absorbancji (duże rozproszenie światła), gdzie po dodaniu próbki badanej aglutynacja odczynników testowych jest hamowana w stopniu zależnym od stężenia HbA1c w badanym materiale. Na podstawie otrzymanych wyników oblicza się odsetkową zawartość HbA1c , która stanowi stosunek HbA1c do hemoglobiny całkowitej [8], [9], [10].
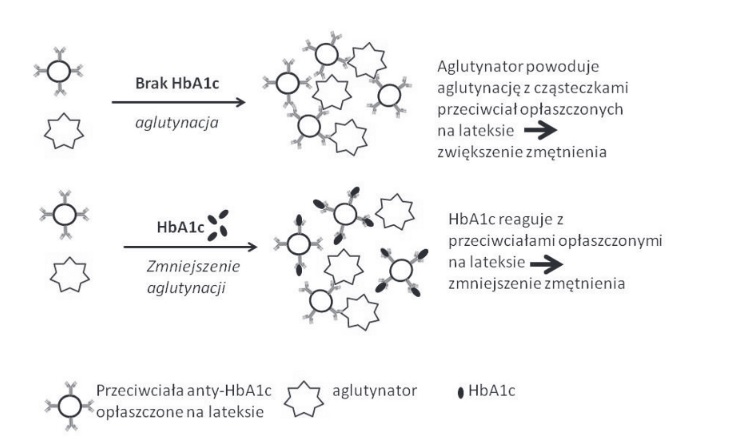
Zdjęcie: Metoda immunoturbidymetryczna oznaczania stężenia HbA1c, http://diagnostykalaboratoryjna.eu/journal/DL_3_2012._str_303-311.pdf
Oznaczanie hemoglobiny glikowanej metodą immunoturbidymetryczną (wg Lakshmy R., Gupta R.,2009)
Wykonanie:
Krew żylną pobrano do probówek zawierających antykoagulant (EDTA). Na bibułę Wathman (nr 3) nanoszono po 10 µl krwi za pomocą pipety, po czym suszono w temperaturze pokojowej. Po całkowitym wyschnięciu krążki bibuły pakowano do zamykanych plastykowych worków w celu ochrony przed kurzem i wilgocią. Tak przygotowane przechowywano w 4°C [9].
Z bibuły z krwią wycinano 6 mm krążki, a następnie szacowano ilość hemoglobiny glikowanej z wykorzystaniem metody immunoturbidymetrycznej (stosując zestaw Agappe Diagnostic, Indie). Wykorzystany kit opiera się na oddziaływaniu antygenu z przeciwciałem, gdzie bezpośrednio określana jest wartość A1c w krwi pełnej. W momencie dodania mysich monoklonalnych przeciwciał (anty-ludzkich A1c) do pełnej krwi dochodzi do formowania się kompleksu z cząsteczkami lateksu opłaszczonymi anty-ludzkimi przeciwciałami A1c. Oddziaływanie przeciwciał z krwi badanej i z zestawu powoduje aglutynację w próbce. Wielkość aglutynacji mierzona jest jako absorbancja, która jest proporcjonalna do ilości HbA1c zaabsorbowanej na powierzchni cząsteczek lateksu [9].
Jedną wyciętą suchą kroplę krwi (odpowiadającą 8 µl krwi) zmieszano z 400 µl odczynnika do hemolizy. Próbkę dokładnie wymieszano i inkubowano w temperaturze pokojowej przez 30 minut do całkowitego rozpadu. Otrzymany hemolizat poddano następnie inkubacji z odczynnikiem zawierającym opłaszczony przeciwciałami lateks, po czym do próbki dodano odczynnik zawierający mysie przeciwciało (anty-ludzkie przeciwciało A1c) oraz kozie przeciwciało anty-mysie IgG (przeciwciała poliklonalne) w buforze glicynowym. Próbki inkubowano, po czym zmierzono absorbancję przy 600 nm. Dla oszacowania stężenia całej krwi, hemolizat przygotowano przez 10 minutową inkubację 10 µl z 500 µl odczynnika do hemolizy. Reszta oznaczeń wykonywana była w sposób identyczny jak dla krwi suszonej na filtrze.
Badania przeprowadzone przez Lakshmy R. i wsp. (2009) z wykorzystaniem metody turbidymetrycznej, wykazały dobrą korelację między stężeniem HbA1c w próbce świeżej krwi, jak i utrwalonej w postaci plamy na filtrze (bibule typu Whatman). Jak pokazały przeprowadzone badania, hemoglobina glikowana może być z powodzeniem oznaczana w krwi utrwalanej, dzięki czemu można wyelimonować „czynniki przeszkadzające”, które towarzyszą pomiarom w krwi świeżo pobranej [9]
Autor: Lidia Koperwas
Literatura:
[1]. Solnica B. Oznaczanie hemoglobiny glikowanej w monitorowaniu leczenia cukrzycy. Katedra Biochemii Klinicznej, Collegium Medium, Uniwersytet Jagielloński, Kraków. http://diabetologiaonline.pl/lekarz_diabeto_adoz,info,67.html
[2]. Warwas M., Piwowar A., Kopiec G., 2010. Zaawansowane produkty glikacji (AGE) w organizmie- powstawanie, losy, interakcja z receptorami i jej następstwa. Patogeneza Chorób, Farmacja Polska. Tom 66, nr 8, 2010. http://www.ptfarm.pl/pub/File/Farmacja%20Polska/2010/08-2010/11%20%20AGE.pdf
[3]. Pietkiewicz J., Seweryn E., Bartyś A., Gamian A., 2008. Receptory końcowych produktów zaawansowanej glikacji – znaczenie fizjologiczne i kliniczne. Postepy Hig Med Dosw. (online), 2008; 62: 511-523. http://www.phmd.pl/fulltxthtml.php?ICID=870077
[4]. Ahmed N., Thornalley P.J., 2007. Advanced glycation endproducts: what is their relevance to diabetic camplications?. Diabetes Obes Metab. 2007 May;9(3):233-45. abstract: http://www.ncbi.nlm.nih.gov/pubmed/17391149?dopt=Abstract
[5]. Brett J. i wsp., 1993. Survey of the Distribution of a Newly Characterized Receptor for Advanced Glycation End Products in Tissues. Am J Pathol. Dec 1993; 143(6): 1699–1712. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1887265/?page=1
[6]. Kuzan A., Chwiłkowska A., Kobielarz M., Pezowicz C., Gamian A., 2012. Glikacja białek macierzy zewnątrzkomórkowej i jej znaczenie w miażdżycy. Postepy Hig Med Dosw. (online), 2012; 66: 804-809. http://www.phmd.pl/fulltxthtml.php?ICID=1016359
[7]. Jabłońska-Trypuć A., 2007. Artykuł poglądowy: Molekularny mechanizm nieenzymatycznej glikacji białek i jej rola w cukrzycy. Przegląd Kardiodiabetologiczny 2007; 2, 4: 253–258. http://www.termedia.pl/Artykul-pogladowy-Molekularny-mechanizm-nieenzymatycznej-glikacji-bialek-i-jej-rola-w-cukrzycy,47,9594,0,0.html
[8]. Urbaniak J., Woźniak M., 2012. Oznaczanie hemoglobiny glikowanej HbA1c w suchej kropli krwi – doniesienia wstępne. diagnostyka laboratoryjna Journal of Laboratory Diagnostics 2012 • Volume 48 • Number 1 • 51-55. http://diagnostykalaboratoryjna.eu/journal/DL_1_2012._str_51-55.pdf
[9]. Lakshmy R., Gupta R., 2009. Measurement of glycated hemoglobin 12. A1c from dried blood by turbidimetric immunoassay. J Diabetes Sci Technol 2009; 3: 1203-1206
[10]. Sztefko K., 2012. Hemoglobina glikowana- problem analityczne. diagnostyka laboratoryjnaJournal of Laboratory Diagnostics 2012 • Volume 48 • Number 3 • 303-311. http://diagnostykalaboratoryjna.eu/journal/DL_3_2012._str_303-311.pdf
[11]. Diabetologia Doświadczalna i Kliniczna, 2006. Tom 6, Suplement A. Zalecenia kliniczne dotyczące postępowania u chorych na cukrzycę, 2006. www.ddk.viamedica.pl
[12]. Szutowicz A., Raszei-Szpecht A., 2009. Diagnostyka laboratoryjna. Tom I.Gdański Uniwersytet Medyczny, Zlecenie KW/224/09.Recenzent prof. dr hab.Wiesława Łysiak-Szydłowska. s.244 -246.
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje