- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Oznaczanie azotanów i azotynów w wybranych próbkach biologicznych
Azotany i azotyny są związkami chemicznymi powszechnie stosowanymi np. w nawozach czy w konserwacji żywności. Po wyschnięciu oba związki mają postać białego związku. Azotany (NO3-) i azotyny (NO2-) występują również naturalnie, ponieważ są produktami przemiany metabolicznej drobnoustrojów, które rozkładają odpady zawierające w swoim składzie azot np. odchody zwierząt, nawozy azotowe. Azotan sodu i potasu używane są jako fumiganty (środki ochrony roślin), zaś sam azotyn sodu stanowi dodatek do żywności, który stosowany jest jako środek konserwujący [7].
W ostatnich latach problem nadmiernej zawartości azotanów w surowcach roślinnych oraz ich negatywny wpływ na organizm człowieka stał się przedmiotem wielu badań. Uważa się, że nadmierną akumulacją azotanów charakteryzują się te gatunki roślin, które mają krótszy okres wegetacji i są odmianami wczesnymi [1]. Maksymalne dopuszczalne dzienne pobranie (ADI) azotanó (V) przez człowieka nie powinno przekraczać 3,7 mg NO3/kg masy ciała. Dla zwierząt wartość ta jest mniejsza i wynosi 0,07 mg NO2/kg masy ciała [3].
Niebezpieczeństwo wynikające z dużej zawartości azotanów (V) związane jest z faktem, że związki te są prekursorami silnie toksycznych azotanów (III), powstających na skutek redukcji azotanów (V). Azotany (III) wywołują m. in. methemoglobinemię czy niedobory witaminy A. Co więcej, przeprowadzone badania epidemiologiczne wykazały silną korelację pomiędzy śmiertelnością spowodowaną nowotworami żołądka, a długotrwałym spożyciem nadmiernej ilości azotanów. Redukcji azotanów (V) do azotanów (III) sprzyja długi transport warzyw jeszcze przed ich spożyciem lub ich składowanie w temperaturze wyższej niż zalecana. Proces nasila także brak dostępu tlenu [1].
Oznaczanie azotanów i azotynów w supernatantach komórek śródbłonka z wykorzystaniem metody kolorymetrycznej opartej na reakcji Griessa (wg Boncler M., i wsp. 2010)
Generowany przez komórki śródbłonka tlene azotu (NO) jest ważnym markerem funkcji śródbłonka. Śródbłonek naczyniowy bierze udział w regulacji napięcia ściany naczyniowej, biorąc również udział w procesach zapalnych i immunologicznych. Za utrzymanie prawidłowej wazomotoryki naczyń krwionośnych jest głównym zadaniem komórek śródbłonka, za które odpowiada tlenek azotu. Ponadto tlenek azotu hamuje aktywację i reaktywność płytek krwi, zapobiega aktywacji leukocytów i proliferacji komórek mięśniowych co potwierdza ważność przeprowadzania oceny funkcjonowania komórek śródbłonka. Oznaczanie tlenku azotu w płynach biologicznych przysparza wiele trudności, ponieważ związek ten występuje w niewielkim stężeniu (rzędu kilku mikromoli), a dodatkowo ma krótki czas półtrwania [2].
Mimo rozwoju wielu wysoce specyficznych metod służących do oznaczania tlenku azotu w materiale biologicznym, metoda kolorymetryczna nadal jest chętnie wykorzystywana do oznaczania produkcji NO przez komórki w warunkach in vivo i in vitro. Metoda pomiaru NO jest metodą pośrednią, która umożliwia oznaczanie powstających w reakcji Griessa metabolitów NO (tj. azotanów i azotynów) występujących w mikromolowym zakresie czułości [2].
W swoich badaniach (Boncler M., i wsp. 2010) sprawdzali użyteczność kolorymetrycznej metody detekcji azotanów i azotynów w supernatantach komórek śródbłonka, które wcześniej stymulowano przez 1 lub 2 doby wybranymi agonistami [2].
Wykonanie:
a) Hodowla komórek śródbłonka
Komórki śródbłonka pochodzące z ludzkiej żyły pępowinowej hodowano w medium suplementowanym surowicą płodów cielęcych (2%), z dodatkiem ludzkiego śródbłonkowego czynnika wzrostu (w stężeniu 10 ng/ml), hydrokortyzonem (1μg/ml), podstawowym czynnikiem wzrostu fibroblastów (3 ng/ml), heparyną (10 μg/ml), penicyliną, amfoterycyną i solami mineralnymi. Komórki poddawano pasażowi co 7 dni, wysiewając 250 tys. komórek do butelki hodowlanej (o powierzchni 75 cm2). Hodowlę komórkową prowadzono do 8-go pasażu w temperaturze 37°C (w wilgotnej atmosferze, wzbogaconej dodatkowo o 5% CO2). Eksperyment prowadzono na komórkach od 3-8 pasażu. W celach eksperymentalnych komórki przesiewano na 6-dołkowe płytki hodowlane w ilości 100 tys. kom/ml na dołek. Po upływie czasu jaki jest niezbędny dla adhezji komórek do podłoża (tj. 48 godz.) zużyte medium usuwano z hodowli i zastępowano je świeżym podłożem (dodatek 1 lub 0,5 ml medium dla uzyskania miana 200 lub 400 tys. komórek/ ml). Komórki hodowano z dodatkiem do medium 100 μM L-argininy oraz czynnika stymulującego śródbłonek do produkcji tlenku azotu [2].
b) Oznaczanie stężenia tlenku azotu w supernatantach komórek śródbłonka (wg Boncler M., i wsp. 2010)
Hodowlę komórek śródbłonka stymulowano odpowiednio: 10 μM bradykininą, 100 μM acetylocholiną lub 500 nM PMA. Jednocześnie przygotowano próbę kontrolną negatywną, którą stanowił supernatant z hodowli komórek niestymulowanych powyższymi czynnikami. Podłoże hodowli stymulowanych, jak i niestymulowanych zbierano po upływie 24 i 48-godzinnej inkubacji,a następnie próbki odwirowywano (10 000 rpm przez 5 min.). Odwirowane próbki poddawano natychmiastowemu zamrażaniu.
Stężenie metabolitów tlenku azotu w uzyskanych supernatantach (w próbach filtrowanych i niefiltrowanych) oznaczano z wykorzystaniem komercyjnego testu (Total NO/Nitrite/Nitrate Parameter Assay Kit). Następnie badane supernatanty rozcieńczano 2x i mierzono absorbancję przy długości fali równej λ=560 nm. Uzyskane stężenie NO3-/NO2- obliczano na podstawie krzywej kalibracyjnej sporządzonej w zakresie stężeń od 0µM do 200 μM (oznaczenie wykonywano w 2 powtórzeniach, zgodnie z zaleceniami producenta kitu) [2].
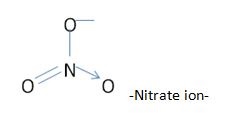
Zdjęcie: Struktura NO3-, http://www.differencebetween.com/difference-between-nitrate-and-vs-nitrite/
Badania nad wpływem pakowania i przechowywania warzyw na zawartość azotanów (V) i (III)
W badaniach (Radziejewska-Kubzdela E., i wsp. (2008)) określano wpływ pakowania w atmosferze modyfikowanej z zastosowaniem folii o różnej przepuszczalności tlenu, na zawartość azotanów (V) i (III). Badano również cechy sensoryczne i fizykochemiczne w sałatce warzywnej typu coleslaw, którą przechowywano przez 12 dni w temperaturze 4°C. Jako materiał do badań użyto mieszankę warzywną typu coleslaw o następującym składzie: 80 % kapusty głowiastej białej (Brassica oleracea) oraz 20 % marchwi (Daucus carota) [1].
Przygotowanie próbek:
Surowiec umyto, obierano ręcznie, ponownie umyto w wodzie i osuszano na bibule. Następnie rozdrabniano mechanicznie w Robocie-Coupe (Vincennes, Francja). Przygotowaną sałatkę z 80% udziałem kapusty białej i 20% marchwi pakowano po 100 g i umieszczano na tackach styropianowych, po czym zamykano w woreczkach (o wymiarach 20 x 25 cm) w atmosferze powietrza i w atmosferze modyfikowanej (o składzie: 2 % O2, 10 % CO2, 88 % N2; 10 % O2, 10 % CO2, 80 % N2 i 20 % O2, 25 % CO2, 55 % N2). Do pakowania użyto folię różniącą się przepuszczalnością tlenu, tj.: 3000 cm3/m3/24 h·bar oraz 1900 cm3/m3/24 h·bar.
Wykonanie oznaczenia:
Oznaczenie zawartości azotanów (V) i (III) oraz ekstraktu, pomiar pH i ocenę sensoryczną przeprowadzano po upływie: 1, 6 i 12 dniach przechowywania próbek w temp. 4°C [1].
Zawartość azotanów (V) i (III) oznaczano z wykorzystaniem metody kolorymetrycznej z odczynnikiem Griessa. Absorbancję próbek mierzono przy długość fali równej λ= 538 nm. W oznaczeniu wykorzystano bezpośrednią redukcję azotanów (V) do azotanów(III) kadmem metalicznym (zgodnie z normą PN-92/A-75112 odpowiadającej normie ISO 6635-1984). Wszystkie próby poddano analizie w dwóch równoległych powtórzeniach [1].
W wyniku przeprowadzonych badań (Radziejewska-Kubzdela E., i wsp. (2008)) stwierdzono, że zawartość azotanów (V) w badanych próbkach nie przekraczała dopuszczalnego dziennego pobrania (ADI) wg FAO/WHO, które wynosi 350 mg NaNO3/ dzień (dla osoby o masie 70 kg) [1].
Azotany (V) i azotany (III): metoda oznaczania stężenia w wodzie wodociągowej [3]
a) Przygotowanie próby: próbkę wody należy przesączyć przez sączek ilościowy o średniej gęstości w celu usunięcia ewentualnej zawiesiny. Pierwsze 30 cm3 otrzymanego przesączu należy odrzucić, a kolejne 100 cm 3 przesączonej wody przenieść do cylindra Nesslera, po czym cylinder umieścić w środkowym otworze komparatora. W bocznych otworach powinny znajdować się wzorce skali, które są najbardziej zbliżone do intensywności barwy badanej próbki. Trzymając komparator na białym tle należy określić barwę próbki (patrząc z góry na słup cieczy).
b) Przygotowanie platynowo-kobaltowego roztworu wzorcowego o barwie 500 mg Pt/dm3 : 1,245 g chloroplatynianu potasowego z 1,01 g chlorku kobaltu (II) rozpuścić w wodzie destylowanej. Do próbki dodać 100 cm3 kwasu solnego, po czym całość dopełnić do 100 cm3)
c) Oznaczanie barwy (przygotowanie próby): polega na wizualnym porównaniu barwy badanej próbki wody w świetle białym z odpowiednio przygotowanymi wzorcami. Wzorce sporządzane są według skali platynowo-kobaltowej lub dwuchromianowo-kobaltowej. Intensywność zabarwienia określana jest w miligramach Pt/dm3 [3].
Wyniki: w przypadku, gdy badana próbka wody ma barwę wyższą niż 70 mg Pt/dm3 oznaczenie należy powtórzyć na próbce rozcieńczonej za pomocą wody destylowanej do 100 cm3. Rozcieńczenie dobra tak, by barwa próbki mieściła się w zakresie skali wzorców. Barwa wody przeznaczonej do picia i na potrzeby gospodarcze nie powinna przekraczać 20 mg Pt/dm3, jeżeli jest zabarwiona wymaga odbarwienia. W tym celu można wykorzystać węgiel aktywny lub wodorotlenek glinu [4].
d) Oznaczanie azotanów (V) w wodzie: metoda opiera się na reakcji kwasu fenolodisulfonowego z azotanami (V), w wyniku czego powstają nitrozopochodne fenolu, wykazujące w roztworze alkalicznym żółte zabarwienie.
Przygotowanie krzywej wzorcowej: do kolbek miarowych o pojemności 50 cm3 odmierzyć kolejno: 0,0 cm3 (próba ślepa); 0,1; 0,3; 0,5; 0,7; 1,0; 3,0; 5,0 i 10,0 cm3 wzorcowego roztworu azotanu (V) potasu (tj.: 0,7216 g azotanu potasowego w 1000 cm3 wody, gdzie 1 cm3 zawiera 0,1 mg azotu azotanowego) o stężeniu 0,01 mg azotu azotanowego lub 0,04427 mg NO3/cm3. Podane wartości odpowiadają kolejno: 0,0; 0,002; 0,006;0,010; 0,014; 0,02; 0,06; 0,10 i 0,2 mg azotu azotanowego na 100 cm3 wody. Do każdej kolby dodać 1 cm3 kwasu fenolodisulfonowego, po czym zawartość kolbek rozcieńczyć wodą destylowaną do połowy, a dalej dodać po 3 cm3 12 N roztworu wodorotlenku potasu (tj.: 170 g KOH w 250 cm3 wody), dopełnić wodą destylowaną do kreski i dokładnie wymieszać.
Zmierzyć absorbancję w kuwetach pomiarowych o długości drogi optycznej równej 1 cm przy fali równej λ= 410 nm (pomiaru dokonać wobec próby ślepej). Na podstawie otrzymanych wyników należy sporządzić wykres zależności absorbancji od stężenia azotanów w roztworze.
e) Wykonanie oznaczenia azotanów (V) w wodzie: 50 cm3 odbarwionej i pozbawionej chlorków wody należy wlać do parowniczki i odparować do sucha na łaźni wodnej. Otrzymaną po odparowaniu pozostałość zalać 1 cm3 kwasu fenolodisulfonowego, a następnie rozcieńczyć wodą destylowaną do objętości 20 cm3. Roztwór przenieść ilościowo do kolbki miarowej o poj. 50 cm 3 (ewentualną pozostałość na ściankach przepłukać 15-20 cm3 wody destylowanej). Zawartość kolbki wymieszać, po czym zmierzyć absorbancję przy λ= 410 nm według próby ślepej. Z wykreślonej krzywej wzorcowej odczytać zawartość azotanów , a wynik podać w miligramach azotu azotanowego w dm3 badanej wody [4].
Alfanaftyloamina
Alfanaftyloamina (α-naftyloamina) jest organicznym związkiem chemicznym należącym do grupy amin aromatycznych, który otrzymuje się w reakcji redukcji alfanitronaftalenu. Wzór sumaryczny alfanaftyloaminy to: C10H9N [6].
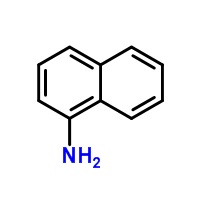
Zdjęcie: wzór alfanaftyloamina, http://www.chemspider.com/Chemical-Structure.8319.html
W środowisku kwaśnym azotany (III) w reakcji z kwasem sulfanilowym połączonym z α -naftyloaminą dają fioletowy diazowy barwnik.
a) Przygotowanie krzywej wzorcowej do oznaczania azotanów (III): do kolbek miarowych (o pojemności 50 cm3) kolejno odmierzyć: 0,0 (próba ślepa); 0,4; 0,8; 1,6; 2,4; 3,2 i 4,0 cm3 mianowanego roztworu azotanu (III) sodu (zawierającego w 1 cm3 0,0005 mg azotu). Całość dopełnić wodą destylowaną do kreski. Przygotowane wzorce odpowiadają kolejno: 0,000; 0,004; 0,008; 0,016; 0,024; 0,032 i 0,040 mg azotu azotynowego (w przeliczeniu na 1 dm3). Do wszystkich kolbek dodać po 0,5 cm3roztworu kwasu sulfanilowego, dokładnie wymieszać i inkubować próbki przez 5 minut. PO upływie czasu inkubacji dodać po 0,5 cm3 roztworu α-naftyloaminy. Roztwory wymieszać i odstawić na 10-minutową inkubację. Następnie zmierzyć wartość absorbancji przy długości fali λ= 520 nm (wobec próby ślepej). Na podstawie otrzymanych wyników wykreślić krzywą wzorcową (zależność absorbancji od stężenia azotanów (III) w roztworach wzorcowych) [4].
b) Oznaczanie azotanów (III) w wodzie: do kolby stożkowej odmierzyć 50 cm3 badanej próbki wody, do której dodać 0,5 cm3 roztworu α-naftyloaminy. Próbkę wymieszać, inkubować 10 minut, po czym zmierzyć wartość absorbancji (λ= 520 nm). Na podstawie przygotowanej wcześniej krzywej wzorcowej odczytać zawartość azotanów (III) (mg azotu azotynowego/ dm3 wody) [4].
Autor: Lidia Koperwas
Literatura:
[1]. Radziejewska-Kubzdela E., Walkowiak-Tomczak D., Biegańska-Marecik R., 2008. WPŁYW PAKOWANIA I PRZECHOWYWANIA W ATMOSFERZE MODYFIKOWANEJ NA ZAWARTOŚĆ AZOTANÓW(V) I (III) W SAŁATCE WARZYWNEJ TYPU COLESLAW ORAZ NA JEJ CECHY SENSORYCZNE I FIZYKOCHEMICZNE. ŻYWNOŚĆ. Nauka. Technologia. Jakość, 2008, 4 (59), 261 – 268. http://www.pttz.org/zyw/wyd/czas/2008,%204%2859%29/30_Radziejewska.pdf
[2]. Boncler M., Dudzińska D., Rywaniak J., Watała C., 2010. Wykorzystanie metody Griessa do oznaczania azotanów/azotynów w supernatantach komórek śródbłonka stymulowanych agonistami. diagnostyka laboratoryjnaJournal of Laboratory Diagnostics 2010 • Volume 46 • Number 3 •307-312. http://www.diagnostykalaboratoryjna.eu/journal/DL_3_2010._str_307-312.pdf
[3]. Augustyniak U., Brzozowska A., Czerwińska D.,Dąbrowska M., Kałuża J., Kozłowska K., Morawiec M., Pietruszka B., Wierzbicka E., 2010. Toksykologia żywności. Przewodnik do ćwiczeń pod redakcją Anny Brzozowskiej. Wydanie IV uzupełnione. Wydawnictwo SGGW, Warszawa 2010, s. 211-220.
[4]. http://www.differencebetween.com/difference-between-nitrate-and-vs-nitrite/
[5]. Rozporządzenie Ministra Zdrowia z dnia 20 kwietnia 2010 r. zmieniające rozporządzenie w sprawie jakości wody przeznaczonej do spożycia przez ludzi. http://isap.sejm.gov.pl/DetailsServlet?id=WDU20100720466
[6]. http://bc.pollub.pl/Content/4843/BN_80_6026_32.pdf
[7]. Nitrates and Nitrites, TEACH Chemical Summary U.S. EPA, Toxicity and Exposure Assessment for Children’s Health. http://www.epa.gov/teach/chem_summ/Nitrates_summary.pdf











Recenzje