Prezentujemy artykuł, który przyniósł jego autorowi wyróżnienie w VI Konkursie na artykuł popularnonaukowy pod hasłem „Skomplikowane i proste. Młodzi uczeni o swoich badaniach”, zorganizowanym przez Forum Akademickie.
 Gwiazdy w mózgu
Gwiazdy w mózgu
Jakie są najliczniejsze komórki w mózgu człowieka? Astrocyty. Dlaczego zatem jest to prawdopodobnie wiadomość nowa dla czytelnika? Przyczyn jest kilka.
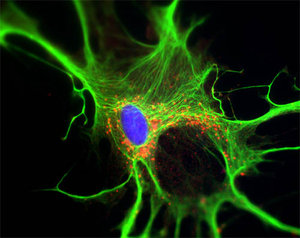
Głównym przedmiotem neurobiologii jest badanie neuronów, ich pobudliwości, struktury połączeń, zmian plastycznych będących podstawą uczenia się lub przystosowania do nowych warunków. Wydaje się to logiczne, biorąc pod uwagę, że te właśnie komórki przewodzą impulsy elektryczne i przetwarzają informacje napływające do mózgu. W tkance nerwowej znajduje się jednak wiele innych typów komórek, z których każda ma do spełnienia ważne zadanie. Nieneuronalny komponent mózgu klasyczna neurobiologia traktuje nieco po macoszemu. I to już od połowy XIX w., kiedy to Rudolf Virchow wprowadził termin „glia” – co po grecku oznacza po prostu klej. Według Virchowa glej to bezkomórkowa tkanka łączna, wypełniająca przestrzeń między neuronami. Wkrótce mikroskopia pozwoliła na stwierdzenie, że glej jest zbudowany z komórek; pogrupowano je na podstawie wyglądu. Morfologicznie wyróżniono trzy podstawowe typy gleju: oligodendrocyty – komórki tworzące osłonki mielinowe neuronów, co przyczynia się do sprawnego przewodzenia impulsów elektrycznych; mikroglej – komórki pozostające w stanie spoczynku, uaktywniające się w stanach patologicznych oraz astrocyty. Te ostatnie mają bardzo rozbudowany system wypustek, przy odpowiednim wybarwieniu tkanki nerwowej przypominają gwiazdy, a w każdym razie takie skojarzenie miał Mihaly von Lenhossek, który w 1895 r. stał się ich ojcem chrzestnym. Astrocyty pełnią w mózgu wiele funkcji – metabolizują neurotransmitery, usuwają toksyny, są źródłem energii dla neuronów i ogólnie rzecz biorąc – dbają o utrzymanie homeostazy układu nerwowego. W latach 90. wykazano, że astrocyty potrafią komunikować się ze sobą za pomocą „fal wapniowych” – zjawiska polegającego na wzroście poziomu jonów wapnia w kolejnych komórkach należących do sieci połączonych ze sobą astrocytów. Jednak dopiero badania wskazujące, że astrocyty mogą brać czynny udział w modulacji transmisji synaptycznej oraz że to właśnie one regulują przepływ krwi w mózgu, spowodowały niezwykły wzrost zainteresowania tymi komórkami. Badacze zrozumieli bowiem, że astrocyt to nie tylko bierny regulator środowiska, ale też istotny gracz modulujący najistotniejsze procesy w mózgu.
Nokaut genetyczny
Odkrywanie nowych funkcji komórek jest związane ściśle z rozwojem metod. O neuronach wiadomo, że ich głównym zadaniem jest przewodzenie impulsów i wydzielanie neurotransmiterów. Ponieważ są to komórki pobudliwe, podstawową metodą ich badania jest elektrofizjologia. Z astrocytami sprawa jest bardziej skomplikowana. Nie są pobudliwe, zatem nie można rejestrować potencjałów błonowych. Rozwój obrazowania z wykorzystaniem fluorescencyjnych znaczników stężenia jonów wapnia doprowadził do pokazania, że astrocyty reagują na zmianę poziomu większości substancji występujących w mózgu, oraz umożliwił określenie zakresu reakcji. Z kolei połączenie elektrofizjologii, zaawansowanej mikroskopii i specyficznych metod farmakologicznych pozwoliło stwierdzić, że aktywnymi modulatorami wydzielonymi z gleju są glutaminian (a więc ta sama cząsteczka, która stanowi podstawowy neuroprzekaźnik wykorzystywany w komunikacji synaptycznej między neuronami), ATP (tym razem nie jako źródło energii, ale transmiter) oraz D-seryna (rzecz niezwykła, bowiem zdecydowana większość aminokwasów u zwierząt to L-aminokwasy). W 2001 roku Frank W. Pfrieger i jego współpracownicy dzięki specjalnemu sposobowi hodowania komórek odkryli, że jeden z czynników wydzielanych przez astrocyty warunkuje tworzenie połączeń synaptycznych. Wyniki te zaskoczyły świat nauki, bowiem tą kluczową substancją okazał się być… cholesterol. Odkrycie było fascynujące, a ponieważ astrocytami zainteresowałem się już na studiach, postanowiłem zaangażować się w badania nad mechanizmem tego zjawiska. Wysłałem e-mail, a bardzo zachęcająca odpowiedź sprawiła, że 3 miesiące później rozpocząłem doktorat w Strasbourgu.
Badania wskazujące na udział cholesterolu w synaptogenezie, podobnie jak zdecydowana większość eksperymentów nad astrocytami, prowadzone były poza żywym organizmem, w hodowli komórkowej. Ponieważ w biologii często mamy do czynienia z artefaktami, wynikającymi z badania zjawisk poza ich naturalnym kontekstem, słuszne pytanie brzmiało: jakie znaczenie mają astrocyty (a w szczególności wydzielany przez nie cholesterol) w funkcjonowaniu mózgu żywych organizmów?
Kiedy pada pytanie o rolę białka lub procesu in vivo, niezbędne stają się narzędzia oferowane przez współczesną genetykę. Jedna z najczęściej stosowanych metod polega na eliminacji określonych genów i obserwacji, jakie będą skutki takiego zabiegu. Problem w tym, że takie „nokauty genetyczne” powodują eliminację genów we wszystkich komórkach organizmu, na wszystkich etapach rozwoju. Z badań grupy Pfriegera wynikało, że cholesterol syntetyzowany przez astrocyty był niezbędny do tworzenia synaps. Cholesterol w mózgu nie pochodzi z krwiobiegu, lecz jest syntetyzowany lokalnie przez astrocyty, z zaangażowaniem tych samych białek, z których korzysta np. wątroba. Zwykły nokaut genetyczny pozbawiłby cały organizm regulacji poziomu tego związku. A choć cholesterolem straszą dziesiątki reklam telewizyjnych, to jednak jest on absolutnie niezbędny do życia. Aby poznać funkcje interesujących nas szlaków w astrocytach, niezbędne było więc wytworzenie zwierząt, które syntezę cholesterolu miałyby zablokowaną wyłącznie w tych komórkach.
Transgeniczne myszy
Rozwiązaniem okazał się być system Cre-ERT2. Ten enigmatyczny akronim zawiera w sobie dwie składowe. Cre oznacza rekombinazę pochodzącą z pewnych bakteriofagów (wirusów atakujących bakterie). Enzym ten działa jak molekularne nożyczki dostosowane do jednego tylko rodzaju ciętego materiału – rozpoznaje sekwencje DNA otoczone znacznikami (nazywanymi sekwencjami loxP), po czym wycina fragment zawarty pomiędzy tymi znacznikami. Technikami inżynierii genetycznej można wprowadzić sekwencję DNA kodującą Cre do genomu myszy tak, aby enzym ulegał ekspresji tylko w jednym rodzaju komórek. O tym, że gen ulega aktywacji w danym typie komórek, w odpowiednim momencie, decyduje promotor. Jeżeli zatem fragment DNA kodujący Cre poprzedzimy promotorem, który kieruje ekspresję wyłącznie do astrocytów, i tak przygotowany konstrukt wszczepimy do zygoty, to u zwierząt, które się urodzą rekombinaza będzie występować wyłącznie w astrocytach.
W przypadku naszych badań istotny był jeszcze jeden aspekt – chodziło o to, aby mutacja ujawniała się wyłącznie w mózgu dorosłych osobników, tak aby jej efekty nie wpłynęły na prawidłowy rozwój zwierząt. Tę kwestię rozwiązuje druga składowa – ERT2, która zapewnia, że rekombinaza pozostanie nieaktywna aż do momentu, w którym zwierzę otrzyma syntetyczny lek – tamoksyfen. Ostatnim elementem układanki jest linia transgenicznych myszy, zmodyfikowanych w taki sposób, że gen, który chcemy wyciąć, będzie otoczony sekwencjami – znacznikami, czyli loxP. W momencie rozpoczynania projektu wiedzieliśmy, że linia myszy, w której gen kodujący białko kluczowe dla metabolizmu cholesterolu (SQS) jest „naznaczony” do usunięcia, już istnieje. Pozostało zatem wygenerować myszy zawierające Cre-ERT2 w astrocytach.
Wytworzenie konstruktu umożliwiającego modyfikację genetyczną (transgenu) zajmuje doświadczonemu naukowcowi około 2 miesiące, początkującemu doktorantowi zajęło pół roku. Później nastąpiły żmudne krzyżowania w celu uzyskania dużej liczby zwierząt, nieubłagane prawa Mendla mówią bowiem o tym, że statystyka urodzeń zwierząt transgenicznych nie sprzyja eksperymentatorowi. Wreszcie, aby ocenić, w jakim stopniu pomysł się udał, konieczna była weryfikacja. Najpopularniejszą metodą jest użycie tzw. linii reporterowych, czyli takich, w których aktywność rekombinazy Cre prowadzi do produkcji białka łatwego do identyfikacji, np. beta-galaktozydazy czy GFP (czyli zielonego białka fluorescencyjnego). Zwłaszcza GFP jest szczególnie przyjazne, bowiem komórki GFP-pozytywne widać pod mikroskopem bez konieczności dodatkowych barwień. Takie podejście potwierdziło, że u myszy, które wygenerowałem, do rekombinacji dochodzi efektywnie, choć jej poziom zależy od badanej struktury mózgu. Na przykład w korze mózgowej mutacja wystąpiła w ok. 30 proc. astrocytów, natomiast we wzgórzu w ok. 85 proc. Uzyskane linie pozwalają więc na wydajną, ograniczoną do astrocytów i regulowaną w czasie eliminację z tych komórek dowolnego genu.
Wyjście z cienia
Jak często bywa w nauce – dobre badania mają to do siebie, że podejmuje je więcej niż jedno laboratorium. W trakcie prowadzonego przeze mnie projektu powstało kilka szczepów transgenicznych myszy umożliwiających genetyczną modyfikację astrocytów, a jeden z nich został zastosowany do zablokowania syntezy cholesterolu w tych komórkach. Dublowanie eksperymentów konkurencji nie zawsze jest fascynującym wyzwaniem, postanowiliśmy więc nieco zmodyfikować projekt badawczy. Jednym z najbardziej dyskutowanych problemów w badaniach nad astrocytami jest pytanie o mechanizm wydzielania przekaźników. Jedna z najważniejszych hipotez mówi o tym że, podobnie jak w neuronach, glejoprzekaźniki są gromadzone w pęcherzykach i wydzielane wówczas, gdy rośnie stężenie jonów wapniowych w cytoplazmie. To atrakcyjna hipoteza, bo wiąże aktywność wydzielniczą astrocytów z odkrytymi falami wapniowymi. Chociaż istnieją badania w hodowlach komórkowych lub tkankowych świadczące o tym, że ten mechanizm ma miejsce, ponownie najistotniejsze wydaje się potwierdzenie tego zjawiska u żywych myszy.
Na szczęście system Cre-ERT2 można zaadaptować tak, aby służył nie tylko do eliminacji naturalnie występującego genu, lecz do ekspresji genu, którego normalnie brak. W tym celu należy przygotować linię transgeniczną zawierającą konstrukt, w którym sekwencje loxP otaczają fragment DNA hamujący ekspresję (tzw. sekwencja STOP). Jeśli za nią umieścimy gen, którego funkcję chcemy badać, to aktywność rekombinazy spowoduje usunięcie fragmentu STOP i aktywację ekspresji żądanego genu.
Ale jaki gen chcemy wprowadzić do genomu? W tym przypadku gen kodujący główny składnik botoksu (i znów możemy mówić o gwiazdach)! Białko to działa bowiem w ten sposób, że całkowicie hamuje wydzielanie pęcherzykowe z komórek, do których się dostanie. U takich myszy glejotransmitery nie będą więc wydzielane, a odpowiednie testy behawioralne pozwolą się dowiedzieć, w jakich procesach biorą one udział. Obecnie właśnie tak zmodyfikowane zwierzęta przechodzą serię eksperymentów, w których analizujemy ich zachowanie. Dokładnej analizie jest poddawana również tkanka pobrana z ich mózgów – mierzymy poziom ekspresji genów oraz morfologię komórek. Wyniki pozwolą na określenie tych elementów funkcjonowania układu nerwowego, które zależą od niedocenianych wcześniej astrocytów.
Von Lenhossek użył nazwy „komórki gwiaździste” na podstawie wyglądu astrocytów. W tej chwili wiadomo, że komórki te są istotnym ogniwem najważniejszych procesów w mózgu, jak uczenie się czy pamięć, i mogą być celem wielu nowych leków. Zarówno wielość badań poświęconych astrocytom, jak i zaangażowanie najważniejszych ośrodków naukowych sprawiły, że komórki te wyszły z cienia, stając się prawdziwymi gwiazdami na scenie współczesnej neurobiologii. A między nami mówiąc – piękne są, nieprawdaż?
Autor: Dr Michał Ślęzak, asystent w Zakładzie Neurofarmakologii Molekularnej Instytutu Farmakologii PAN.
astrocyty, mózg, komórka, neuron, komórka nerwowa, Forum Akademickie, lab, laboratorium, laboratoria
wstecz
Podziel się ze znajomymi


 Gwiazdy w mózgu
Gwiazdy w mózgu