Do zarażenia płodu dochodzi prawie wyłącznie w przypadku pierwotnego zarażenia ciężarnej i po transmisji pasożyta przez łożysko do płodu. Przebycie przed ciążą zarażenia T. gondii łączy się z nabyciem wystarczającej odporności i tylko w przypadku ciężkiego upośledzenia odporności może dojść do reaktywacji infekcji i transmisji do płodu.
Co to jest toksoplazmoza?
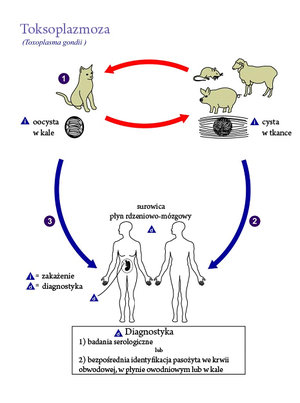
Toksoplazmoza jest jedną z najbardziej rozpowszechnionych chorób pasożytniczych u człowieka, wywołaną pierwotniakiem Toxoplasma gondii. Po raz pierwszy pierwotniak został wykryty w 1908 roku, a w 1937 roku udokumentowano przypadek toksoplazmozy wrodzonej u ludzi. Jednakże zdecydowanie później odkryto drogi zakażenia, a dopiero w 1970 roku opisano kompletny cykl życiowy tego pierwotniaka.1,2
Na świecie od 25–75% populacji jest zarażonych tym pierwotniakiem, najmniej w krajach północnej Europy oraz w Azji południowo-wschodniej.3 Szacuje się (na podstawie badań ośrodkowych), że w Polsce ok. połowa kobiet w ciąży chorowała w przeszłości na toksoplazmozę, o czym świadczy obecność swoistych przeciwciał we krwi.4,5
W krajach europejskich, w których prowadzi się badania badania przesiewowe u kobiet w ciąży (np. Francja), obserwuje się zmniejszenie odsetka osób serodotatnich, tzn. takich, które przebyły toksoplazmozę.6 W Polsce również zaobserwowano taki trend.7
Częstość występowania toksoplazmozy wrodzonej u noworodków wynosi od 0,07/1000 urodzeń żywych w Szwecji do 2,9/1000 urodzeń żywych we Francji. W Polsce rocznie stwierdza się ok. 400 przypadków toksoplazmozy wrodzonej co stanowi ok. 1,1/1000 urodzeń żywych lub 1,9/1000 dzieci kobiet, u których nie stwierdzono odporności na chorobę.5
Jakie są drogi zarażenia Toxoplasma gondii?
Wyróżnia się 3 główne drogi zarażenia Toxoplasma gondii:
- droga pokarmowa – zarażenie następuje przez spożywanie surowego lub niedogotowanego mięsa (głównie wieprzowego, baraniego i wołowego) zawierającego cysty tkankowe lub przez połknięcie oocyst znajdujących się w środowisku zanieczyszczonym odchodami zarażonego kota (żywiciel ostateczny pasożyta) kontakt z glebą, picie skażonej wody, spożycie warzyw lub owoców w stanie surowym.8 Oocysty wydalane przez kota są odporne na niesprzyjające warunki środowiskowe oraz inaktywację chemiczną i zachowują zdolność inwazyjną w glebie do roku, w wodzie nawet do kilku lat. Warto zaznaczyć, że kot choć w okresie zarażenia wydala miliony oocyst choruje tylko raz i to przez okres 14 dni, a oocysty stają się zakaźne dopiero po 1–5 dniach od wydalenia.9Nie stwierdzono istotnego związku między zarażeniem T. gondii u kobiet w ciąży i kontaktem z kotami, niezależnie od sposobu ich karmienia, czy też czyszczenia kuwety.8 O dużej roli oocyst w epidemiologii toksoplazmozy świadczy wysoki odsetek dodatnich odczynów serologicznych u wegetarian, którzy są bardziej narażeni na spożycie oocysts znajdujących się na nieodpowiednio umytych warzywach i owocach.
- droga przezłożyskowa – zakażenie T. gondii przenikającymi aktywnie przez łożysko do płodu w czasie trwania czynnej toksoplazmozy u matki (toksoplazmoza wrodzona)
- rzadko występujące zarażenie wskutek transfuzji krwi zanieczyszczonej tachyzoitami T. gondii, przeszczepu zarażonych narządów oraz pracy z zainfekowanym materiałem w laboratorium.
Jakie są objawy toksoplazmozy?
Choroba najczęściej przebiega bezobjawowo i bez powikłań. Dotyczy to większości kobiet w ciąży.10 Rzadko występują gorączka, obrzęk węzłów chłonnych i objawy grypopodobne (objawy przypominające mononukleozę). U osób z obniżoną odpornością (zakażenie HIV, terapia immunosupresyjna, choroby nowotworowe) może dojść do ciężkich powikłań, w tym zapalenia mózgu i opon mózgowych, zapalenia mięśnia serca, zapalenie płuc i wątroby, niedokrwistości oraz zaburzeń widzenia (postać oczna).11
Jakie jest ryzyko zarażenia płodu i jakie są następstwa toksoplazmozy wrodzonej?
Do zarażenia płodu dochodzi prawie wyłącznie w przypadku pierwotnego zarażenia ciężarnej i po transmisji pasożyta przez łożysko do płodu. Przebycie przed ciążą zarażenia T. gondii łączy się z nabyciem wystarczającej odporności i tylko w przypadku ciężkiego upośledzenia odporności może dojść do reaktywacji infekcji i transmisji do płodu.
Ryzyko transmisji u kobiet (średnio ok. 25%), u których zarażenie nastąpiło w czasie ciąży wzrasta wraz z wiekiem ciążowym, w którym kobieta uległa zarażeniu i wynosi: 6% w 13.tygodniu ciąży, 40% w 26 tygodniu ciąży i 72% w 36 tygodniu ciąży. Jednak im wcześniej występuje zarażenie, tym częściej stwierdza się ciężką postać choroby u dziecka (odpowiednio u 61%, 25% i 9%).12,13
Następstwem zarażenia może być wewnątrzmaciczny zgon płodu (rzadziej poronienie) lub poważne powikłania u noworodka i dziecka. Zarażenia we wczesnym okresie ciąży, choć najrzadsze mogą skutkować najcięższymi powikłaniami, w tym zapaleniem siatkówki i naczyniówki oka, zwapnieniami śródmózgowymi oraz małogłowiem lub wodogłowiem (tzw. triada Sabina-Pinkertona). Towarzyszyć im mogą drgawki, zaburzenia widzenia i niedosłuch.
Zarażenie w ciąży zaawansowanej (najczęstsze) może objawiając się żółtaczką, powiększeniem wątroby i śledziony, zapaleniem mózgu i zapaleniem płuc. Jednak w większości zarażonych wewnątrzmacicznie dzieci nie stwierdza się po porodzie jawnych objawów klinicznych. Mimo to u dzieci tych mogą pojawiać się po miesiącach i latach zaburzenia neurologiczne i wzroku, dlatego też powinny one pozostać pod kontrolą lekarską co najmniej przez 2–3 lata.
U dzieci, u których po porodzie stwierdzono objawy toksoplazmozy wrodzonej często występują odległe następstwa w tym padaczka, upośledzenie umysłowe, zaburzenia mowy, porażenie dziecięce, zez, niedowidzenie i ślepota.14
Jak wykrywa się zarażenie T. gondii u kobiet w ciąży?
Podstawą diagnostyki u kobiet w ciąży są badanie serologiczne (oznaczanie swoistych przeciwciał klasy IgG i IgM najczęściej za pomocą testu immunoenzymatycznego ELISA) w kierunku toksoplazmozy. Należy je wykonać możliwie jak najwcześniej (podczas pierwszej wizyty u lekarza ginekologa-położnika), a w przypadku uzyskania wyników ujemnych, badania te należy powtarzać co najmniej raz w każdym trymestrze ciąży. Celem tych powtórnych badań jest wychwycenie serokonwersji, czyli zmiany wyników ujemnych na dodatnie.
Serokonwersja może świadczyć o pierwotnym zarażeniu pierwotniakiem, które po przeniknięciu przez łożysko zagraża rozwijającemu się płodowi. Nie ma potrzeby powtarzania badania, jeśli wyniki dodatnie pierwszego badania świadczą o przebytej przed ciążą toksoplazmozie (niskie dodatnie miana IgG, brak IgM - nabyta odporność). W takich przypadkach nie istnieje ryzyko transmisji zarażenia do płodu.
Stwierdzenie serokonwersji wymaga potwierdzenia w kontrolnym badaniu wykonanym w referencyjnym laboratorium (najczęściej klinicznym). Ponownie wykonuje się oznaczenie przeciwciał IgG i IgM (również IgA i IgE), a dodatkowo oznacza się tzw. awidność przeciwciał klasy IgG oraz (jeśli jest to możliwe). Ogólnie rzecz biorąc wysoka awidność świadczy o zakażeniu nabytym co najmniej 12–16 tygodni wcześniej, i stwierdzenie jej na początku ciąży praktycznie wyklucza pierwotne zarażenie toksoplazmozą w okresie ciąży. Obecność przeciwciał o niskiej awidności może, ale nie musi oznaczać „świeżego” zarażeniu (mimo, że pojawiają się najwcześniej), gdyż przeciwciała te mogę przetrwać nawet rok.13
Interpretacja wyników badań serologicznych jest trudna i powinna być przeprowadzona przez specjalistów, gdyż od niej zależy dalszy tok postępowania, w tym wdrożenie prewencyjnego leczenia, wykonania amniopunkcji (w celu zdiagnozowania zarażenia wewnątrzmacicznego) lub innych dodatkowych badań. Niestety praktyka dnia codziennego świadczy o niezbyt dokładnym przestrzeganiu procedur w rozpoznawaniu toksoplazmozy co może skutkować niepotrzebnym stresem u ciężarnych kobiet.
Stwierdzenie obecności swoistych przeciwciał w jednorazowym badaniu nie jest podstawą do rozpoczęcia leczenia. Decydujące znaczenie ma wynik badania kontrolnego (po 3 tygodniach) albo weryfikacja wyników w specjalistycznym laboratorium.
Spożywanie zarażonego T. gondii surowego i niedogotowanego mięsa jest główną przyczyną infekcji.
Zachowując proste środki ostrożności w opiece nad swoim kotem nie musisz obawiać się zarażenia od swojego ulubionego zwierzęcia, nie ma więc powodów do pozbywania się go z domu na okres swojej ciąży.
Stosując proste zasady higieniczne (zestawione w tabeli na końcu artykułu) możesz skutecznie zapobiegać toksoplazmozie u siebie i swojego nienarodzonego dziecka.
Jakie jest postępowanie w przypadku rozpoznania ostrej fazy toksoplazmozy?
Jeżeli rozpoznanie toksoplazmozy zostało potwierdzone w sposób wiarygodny (należy to uczynić w możliwie najkrótszym czasie) wdraża się leczenie. Istotny jest czas od wykonania pierwszego badania sugerującego zarażenie T. gondii do chwili rozpoczęcia terapii, gdyż tzw. „okno terapeutyczne” (tzn. okres, w którym terapia może być skuteczna) jest krótki. Pierwotnym celem leczenia jest zapobiegania przeniesienia zarażenia do płodu, do którego dochodzi w krótkim czasie po wystąpieniu serokonwersji u matki. Stosowany w tym celu antybiotyk spiromycyna (rowamycyna) nie przechodzi łatwo przez łożysko i nie może być uważana za lek zwalczający zarażenie u płodu. Spiramycyna jest lekiem bezpiecznym i nie powoduje wad wrodzonych u płodu. Mimo wątpliwości odnośnie do skuteczności spiromycyny15,16 w zapobieganiu transmisji do płodu, leczenie kontynuuje się aż do porodu. Dzieje się tak nawet w przypadku braku potwierdzenie zarażenia płodu (ujemny wynik badania PCR w płynie owodniowym). Spiramycynę stosuje się doustnie w dawce 1,0 g (3 mln U) co 8 godzin (dzienna dawka całkowita 3 g lub 9 mln u).
Jeśli jednak dojdzie do zarażenia płodu (dodatnie wyniki badań płynu owodniowego17 i/lub objawy infekcji płodu w badaniu ultrasonograficznym), spiramycynę zastępuje się (po 18 tygodniu ciąży) pirymetaminą z sulfadiazyną i kwasem folinowym.19
Leki te przechodzą przez łożysko i zwalczają chorobę u płodu. Pirymetamina wykazuje działanie teratogenne i nie powinna być stosowana w 1. trymestrze ciąży. Lek powoduje też odwracalną, zależną od dawki, supresję szpiku kostnego. Kwas folinowy (nie foliowy) stosuje się w celu zmniejszenia ryzyka wystąpienia powikłań hematologicznych związanych ze stosowaniem pirymetaminy.12
Po porodzie przeprowadza się u noworodków badania serologiczne w celu ostatecznego potwierdzenia lub wykluczenia toksoplazmozy wrodzonej. Większość dzieci matek leczonych w czasie ciąży (ok. 80%) nie wykazuje po porodzie objawów klinicznych.16,19
Głównym zagrożeniem jest upośledzenie wzroku, które może się rozwinąć nawet u 1/3 dzieci zarażonych toksoplazmozą w okresie płodowym do 12. roku życia20, choć ciężkie obustronne upośledzenie wzroku jest rzadkie. Leczenie noworodków prowadzi się za pomocą pirymetaminy z sulfadiazyną. Czas trwania terapii sięga nawet 2 lat. Zalecany okres obserwacji wynosi nawet 10 lat, ale ogólna prognoza co do jakości wzroku jak i jakości życia jest dobra.21,22
Czy należy przeprowadzać rutynowe badania w kierunku toksoplazmozy u kobiet w ciąży?
Prowadzenie powszechnych badań przesiewowych w kierunku toksoplazmozy u kobiet w ciąży jest nadal spornym problemem. Na decyzje o prowadzeniu takich badań oprócz danych epidemiologicznych, bierze się pod uwagę również możliwości finansowe (analiza kosztów i korzyści) i diagnostyczne, organizację i funkcjonowanie placówek ochrony zdrowia, przestrzegania zasad i higieny oraz podatność społeczeństwa na kierowane do nich programy edukacyjne.
W Europie obligatoryjne badania przesiewowe u kobiet w ciąży prowadzi się we Francji, Austrii, Włoszech, Słowenii i na Litwie. W 3 innych krajach (m.in. Wielka Brytania) nie zalecono prowadzenia skryningu, a w 18 nie zajęto oficjalnego stanowiska.23 Po przeprowadzeniu wnikliwej analizy w Szwajcarii nie wprowadzono badań przesiewowych u kobiet w ciąży.24
Następstwa toksoplazmozy wrodzonej mogą być poważne, ale częstość ich występowania jest mała. Dane z Francji, która wdrożyła powszechny program nadzoru nad toksoplazmozą u kobiet w ciąży wskazują, że w 2007 roku stwierdzono toksoplazmozę wrodzoną u 272 dzieci na 818 700 porodów co stanowi 3,3 przypadki na 10 000 urodzeń żywych, a objawową postać jest jeszcze rzadziej - 0,34/10 000 urodzeń żywych.19
Nawet przy założeniu 50% skuteczności leczenia, jakie podjęto w przypadkach serokonwersji, przedstawione wartości nadal są niewielkie. Warto zaznaczyć, że we Francji, która ma prawdopodobnie najlepiej zorganizowany nadzór nad toksoplazmozą (badania przesiewowe wykonuje się u wszystkich kobiet co 4 tygodnie, a nie raz w trymestrze), odpowiednie wczesne leczenia w krótkim czasie po serokonwersji (tzn. do 3 tygodni) wdrożono tylko u 1/5 kobiet.25
Wątpliwości odnośnie do zasadności i skuteczności programów badań przesiewowych, mimo olbrzymiego wysiłku badaczy w ostatniej dekadzie, nie zostały rozwiane. Świadczą o tym publikacje jednoznacznie optujące za prowadzeniem takich badań, biorąc za podstawę już zgromadzoną wiedzę,26 jak i krytycznie oceniające dotychczasowe wyniki osiągnięć naukowych (zastrzeżenia dotyczą m.in. skuteczności stosowanego leczenia w zapobieganiu transmisji do płodu, zapobieganiu uszkodzenia ośrodkowego układu nerwowego oraz zapaleniu siatkówki i naczyniówki, rodzajów leczenia oraz długości terapii).16,25
Stanowisko towarzystw naukowych w sprawie prowadzenia badań w kierunku toksoplazmozy u kobiet w ciąży też jest zróżnicowane. American College of Obstetricians and Gynecologists i National Institute for Health and Clinical Excellence w Wielkiej Brytanii nie zalecają rutynowej diagnostyki.27,28
Polskie Towarzystwo Ginekologiczne w swych rekomendacjach wymienia badania w kierunku toksoplazmozy jako zalecane, ale nieobligatoryjne. Również w rozporządzeniu Ministra Zdrowia z września 2010 roku,29zaleca się wykonywanie badań, pozostawiając w gestii lekarza i pacjentki, czy zostaną one przeprowadzone. Ponieważ z każdą interwencją medyczną łączy się mniejsze lub większe ryzyko, kobieta w ciąży przed podjęciem tej decyzji powinna być o nim poinformowana. Należy również udzielić wyczerpującej informacji o naturalnym przebiegu choroby (rzeczywistym zagrożeniu) oraz o rozwoju większości dzieci urodzonych z toksoplazmozą wrodzoną, który w zasadzie nie odbiega od rozwoju dzieci zdrowych.21
Zgodnie ze stanowiskiem Europejskiej Sieci do Badań nad Wrodzoną Toksoplazmozą nie można nikomu odmawiać badań prenatalnych po uprzednim rzetelnym poinformowaniu zainteresowanego o ich korzyściach i o ryzyku, natomiast nie można nikogo przymuszać do poddania się tego rodzaju badaniu skryningowemu.30
W Polsce nie wprowadzono powszechnego programu wykrywania toksoplazmozy, a Narodowy Fundusz Zdrowia nie pokrywa kosztów badań. Przyczyną tego są zapewne niedostatki finansowe NFZ, nieopłacalność programu (bilans korzyści i strat), jak i brak odpowiedniego przygotowania organizacyjnego.7
Szacuje się, że we Francji roczny koszt (2002 r.) prowadzenia badań przesiewowych przekracza 100 milionów euro).31 Nieznany jest szacunek kosztów wprowadzenia rutynowych badań przesiewowych w kierunku toksoplazmozy w Polsce. Biorąc pod uwagę dane dotyczące Francji oraz liczbę urodzeń można przypuszczać, że koszt badań w Polsce mógłby sięgnąć 200 milionów złotych, a to oznaczałoby, że dla wykrycia jednego przypadku toksoplazmozy wrodzonej należałoby przeznaczyć ogromną kwotę (kilkaset tysięcy złotych).
Niektóre korzyści i ryzyka prowadzenia badań prenatalnych w kierunku toksoplazmozy
Interwencje w czasie ciąży:
- Badania serologiczne: (K) identyfikacja przypadków infekcji i możliwość wdrożenia leczenia, [R] lęk rodziców związany z otrzymaniem prawdziwie dodatnich i fałszywie dodatnich wyników badań
- Leczenie prenatalne: (K) możliwość zmniejszenia ryzyka transmisji oraz ryzyka następstw choroby u zakażonych dzieci (R) stosowane leki (pirymetamina/sulfonamid) mogą powodować supresję szpiku kostnego, niewydolność oddechową, tachykardię, krwiomocz, niewydolność nerek i mają potencjalne działanie teratogenne
- Amniopunkcja: (K) wykrycie zakażenia wewnątrzmacicznego i zmiana sposobu leczenia, rozpoczęcie bezpośredniego nadzoru po porodzie i ew. kontynuacja leczenia, wynik ujemny uspokaja rodziców; (R) utrata dziecka, powikłania położnicze, dyskomfort matki.
- Ultrasonografia: (K) brak nieprawidłowości u płodu uspokaja rodziców, (R) nieprawidłowości u płodu nie korelują ściśle ze stopniem uszkodzenia ośrodkowego układu nerwowego, potrzeba wykonywania comiesięcznych badań.31
- (K – korzyści R – ryzyko)
Jak zapobiegać toksoplazmozie?
Wobec przedstawionych wątpliwości diagnostycznych I terapeutycznych szczególnego znaczenia nabiera program zapobiegania zarażenia T. gondii. Wiedza kobiet w ciąży o toksoplazmozie, wskutek prowadzenia akcji oświatowych zwiększyła się znacznie w Polsce w ostatnich 20 latach, ale jest nadal niewystarczająca.32,33
Ważne
Stosując podane niżej proste zasady higieniczne można uniknąć zarażenia toksoplazmozą34
Nie należy spożywać surowego lub niedogotowanego mięsa. Mięso przeznaczone do spożycia powinno być przygotowane w odpowiedniej temperaturze. Zaleca się stosowanie termometru do pomiaru temperatury wewnątrz przygotowanego mięsa, aby upewnić się, że cała porcja poddana została odpowiedniej obróbce termicznej. Wołowinę, jagnięcinę i cielęcinę należy przygotowywać w temperaturze co najmniej 62°, wieprzowinę, mięso mielone i dziczyznę w temperaturze co najmniej 71°, zaś drób (w całości) w temperaturze co najmniej 82°. Po pracy w kuchni należy umyć dokładnie ręce wodą z mydłem. Do obróbki mięsa najlepiej stosować osobną tacę (szklaną).
Przed spożyciem należy umyć dokładnie i obrać owoce i warzywa.
Deski do krojenia, naczynia, lady, przybory kuchenne i ręce należy myć w ciepłej wodzie z mydłem po kontakcie z surowym mięsem, drobiem, owocami morza i niemytymi owocami lub warzywami.
Podczas kontaktu z ziemią (praca w ogrodzie, na działce) zaleca się używanie rękawic gumowych, a później dokładne umycie rąk wodą z mydłem.
Należy zabezpieczyć piaskownice dziecięce, gdyż służą kotom chętnie do defekacji.
Zaleca się karmienie kotów przygotowaną komercyjnie karmą, a nie surowym mięsem. Kuwetę należy sprzątać codziennie w gumowych rękawiczkach, a potem dokładnie umyć ręce wodą z mydłem.
Należy unikać picia surowej wody, zwłaszcza w czasie podróży.
Opracowała: Katarzyna Sowa-Lewandowska
Literatura:
1. Dubey J.P., Miller N.L., Frenkel J.K. Characterization of the new fecal form of Toxoplasma gondii. J. Parasitol. 1970. 56: 447–456
2. Lass A: Występowanie oocysts Toxoplasma Gondii w środowisku. Rozprawa doktorska. Instytut Medycyny Morskiej i Tropikalnej GUMed., Gdańsk 2010
3. Tenter A.M., Heckeroth A.R., Weiss L.M.: Toxoplasma gondii: from animals to humans. Int J Parasitol, 2000; 30: 1217–1258
4. Niemiec KT, Raczyński P, Markiewicz K i wsp: The prevalence of Toxoplasma gondii infection among 2016 pregnant women and their children in the Institute of Mother and Child in Warsaw. Wiad Parazytol., 2002;48:293-299
5. Paul M, Petersen E, Szczapa JJ: Prevalence of congenital Toxoplasma gondii infection among newborns from the Poznań region of Poland: validation of a new combined enzyme immunoassay for Toxoplasma gondii-specific immunoglobulin A and immunoglobulin M antibodies. Clin Microbiol., 2001;39:1912-1916
6. Villena I, Ancelle T, Delmas C, i wsp, Toxosurv network and National Reference Centre for Toxoplasmosis. Congenital toxoplasmosis in France in 2007: first results from a national surveillance system. Euro Surveill. 2010;15(25):pii=19600. Available online: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19600
7. Pawłowski ZS: Toksoplazmoza w Wielkopolsce w latach 1900-2000. Przegl Epidemiol., 2000;56:409-417
8 Cook AJ, Gilbert RE, Buffolano W, i wsp: Sources of toxoplasma infection in pregnant women: European multicentre case-control study. European Research Network on Congenital Toxoplasmosis. BMJ, 2000; 321: 142-147
9. Remington JS, Desmonts G: Toxoplasmosis. W Remington JS, Klein JO (red): Infectious Disease of the Fetus and Newborn, 140–267. 4th ed. WB Sanders Company, Philadelphia 1995
10. KM, Holfels E, Roizen N, et al. Risk factors for Toxoplasma gondii infection in mothers of infants with congenital toxoplasmosis: implications for prenatal management and screening. Am J Obstet Gynecol, 2005; 192: 564–571
11. Montoya JG, i wsp: Toxoplasma gondii section of Infectious diseases and their etiologic agents. W: Mandell GL i wsp (red): Principles and Practice of Infectious Diseases, pp. 3170–3198. Philadelphia: Elsevier Churchill Livingstone, 2005
12. Montoya JG, Remington JS: Management of Toxoplasma gondii infection during pregnancy. CID, 2008; 47: 554-565
13. Dunn D, Wallon M, Peyron F i wsp: Mother-to-child transmission of toxoplasmosis: risk estimates for clinical counseling . Lancet, 1999: 353: 1829-1833 14. Milewska-Bobula B: Toksoplazmoza i cytomegalia – postępowanie w okresie ciąży. Med. Prakt Ginekol Położ, 2004; 34:69-80
15. Gilbert R, Gras L: European Multicentre Study on Congenital Toxoplasmosis: Effect of timing and type of treatment on the risk of mother to child transmission of Toxoplasma gondii. BJOG 2003; 110:112–120
16. The SYROCOT Study Group: Effectiveness of prenatal treatment for congenital toxoplasmosis: a meta-analysis of individual patients’ data. Lancet, 2007; 369:115–122
17. Wallon M, Franck J, Thulliez P i wsp: Accuracy of real-time polymerase chain reaction for Toxoplasma gondii in amniotic fluid. Obstet Gynecol, 2010;115:727-733
18 Garcia-Méric P, Franck J, Dumon H, Piarroux R.: Management of congenital toxoplasmosis in France: current data. Presse Med, 2010; 39:530-538
19. Villena I, Ancelle T, Delmas C i wsp: Congenital toxoplasmosis in France in 2007: first results from a national surveillance system. Euro Surveill. 2010;15(25):pii=19600. Available online: http://www. eurosurveillance.org/
20. Tan HK, Schmidt D, Stanford MR i wsp: Risk of visual impairment in children with congenital toxoplasmic retinochoroiditis. Am J Ophthalmol, 2007;144 :648–653
21. Berrébi A, Assouline C, Bessieres MH i wsp: Long-term outcome of children with congenital toxoplasmosis. Amer J Obstet Gynecol, 2010; 203: 552. E1-6
22. Peyron F, Garweg J, Wallon M i wsp: Long-term impact of treated congenital toxoplasmosis on quality of life and visual performance. Pediatr Infect Dis J, 2011, 30, 597-600
23. Villena I, Buffolano W , Gilbert R for the Eurotoxo Group (Panel 3). National public health policies and routines programs to prevent congenital Toxoplasmosis, Europe, 2005 [Unpublished report]. Bordeaux (France): The Eurotoxo Group; 2005.19p.
24. Rudin C, Boubaker K, Raeber PA i wsp.: Toxoplasmosis during pregnancy and infancy. Swiss Med Wkly, 2008, 138, 1-8
25. Gilbert R: Treatment for congenital toxoplasmosis; finding out what works. Mem Inst Oswaldo Cruz, Rio de Janeiro, 2009; 104: 305-311
26. McLeod R, Kieffer F, Sautter M i wsp: Why prevent, diagnose and treat congenital toxoplasmosis. Mem Inst Oswaldo Cruz, Rio de Janeiro, 2009, 104, 32-344
27. ACOG practice bulletin. Perinatal viral and parasitic infections. Number 20, September 2000. Int J Gynaecol Obstet, 2002;76:95-107
28. Antenatal care; routine care for healthy pregnant women. NICE Clinical Guideline No 62, 2010
29. Rozporządzenie Ministra Zdrowia z dnia 23 września 2010 r. Dziennik Ustaw nr 187, poz. 1259
30. Gilbert RE, Peckham CS. Prenatal screening for toxoplasma infection. W: Joynson DHM, Wreghitt TG (red). Toxoplasmosis. A comprehensive clinical guide. Cambridge Univ.Press 2001:214-240 http://www.scribd.com/doc/56006077/8/Prenatal-screening-for-toxoplasma-infection
31. Gilbert RE, Peckham CS: Congenital toxoplasmosis in the United Kingdom: to screen or not to screen. J Med Screen, 2002; 9: 135-141
32. Ziemba J, Nowakowska-Głąb A, Wilczyński J i wsp: Ocena stanu wiedzy dotyczącej toksoplazmozy wśród ciężarnych, położnych, studentów medycyny i lekarzy położników . Med Pr. 2010;61:271-276
33. Pawłowski ZS, Gromadecka-Sutkiewicz M i wsp: Impact of health education on knowledge and prevention behavior for congenital toxoplasmosis: the experience in Poznan, Poland. Health Educ Res, 2001, 16: 493-502
34. Dietz VJ, Wilson M, Navin TR, Jones LJ: Preventing congenital toksoplasmosis. MMWR, 2000; 49: 57-75
Tagi:
zakażenie,
ciąża,
choroba,
toksoplazmoza,
kot,
lab,
laboratorium,
laboratoria
wstecz
Podziel się ze znajomymi