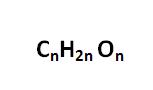Cukry (węglowodany) są związkami, które stanowią przeważającą część materii organicznej na Ziemi, a także pełnią różnorodne funkcje we wszystkich formach życia. Tak więc związki te są materiałem zapasowym, paliwem energetycznym, a także intermediatami w szlakach metabolicznych. Przeprowadzone badania ujawniły, że cukry (jednostki węglowodanowe) znajdujące się na powierzchni komórek pełnią także bardzo ważną rolę w procesach rozpoznawania międzykomórkowego [2].
 Słowa kluczowe: cukry proste, monocukry, węglowodany, oznaczanie ilościowe cukrów, próba Benedicta, próba Tollensa, redukcja kwasu pikrynowego, test Fehlinga, odczyn Nylandera
Słowa kluczowe: cukry proste, monocukry, węglowodany, oznaczanie ilościowe cukrów, próba Benedicta, próba Tollensa, redukcja kwasu pikrynowego, test Fehlinga, odczyn NylanderaCukry proste zwane także monosacharydami lub jednocukrami to najprostsze węglowodany.Są to hydroksyaldehydy lub hydroksyketony, które w swoim składzie zawierają kilka grup hydroksylowych. Cukry te syntetyzowane są w organizmach samożywnych (w trakcie procesu fotosyntezy i chemosyntezy). Ich nazewnictwo chemiczne opiera się na ilości atomów węgla w cząsteczc (może być ich od 3 do 7), w związku z czym mówimy o triozach posiadających 3 atomy węgla i konsekwentnie o tetrozach, pentozach (zwyczajowe nazwy: arabinoza, ksyloza, ryboza), heksozach (zwyczajowo: glukoza, fruktoza, galaktoza, mannoza) i heptozach, które mają odpowiednio 4, 5, 6 i 7 atomów węgla [1], [2], [3].
Ogólny, sumaryczny wzór cząsteczki monosacharydu to:
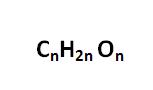
Ze względu na obecność w cząsteczce cukró grupy aldehydowej lub ketonowej, związki te nazywa się odpowiednio: aldozami lub ketozami [1], [3], [5].
Wszystkie cukry proste są substancjami bezbarwnymi, bezwonnymi a także (przeważnie) charakteryzują się słodkim smakiem. Najsłodszym cukrem jest fruktoza (obecna w owocach). Związki te rozpuszczają się w wodzie, co związane jest ze znaczną polarnością ich cząsteczek, a także ze zdolnością do tworzenia wiązań wodorowych z cząsteczkami wody. W związku z czym, cukry nie rozpuszczają się w rozpuszczalnikach organicznych [1].
Jedną z charakterystycznych właściwości fizycznych cukrów (umożliwoającą ich identyfikację) jest ich czynność optyczna (tj. zdolność do skręcania płaszczyzny światła spolaryzowanego).
W cząsteczkach wszytskich cukrów występują tzw. węgle asymetryczne. Są to atomy węgla, którego 4 wartościowości wysycone są różnymi podstawnikami. Węgiel asymetryczny powoduje asymetrię cząsteczki danego związku, a także istnienie dwóch wzorów przestrzennych cząsteczki , które nie dają się na siebie w żaden sposób nałożyć.Tak powstałe izomery optyczne mają identyczne właściwości fizyczne i chemiczne, lecz różnią się kierunkiem skręcania płaszczyzny światła spolaryzowanego . Tak więc, związki te mają tę samą skręcalność właściwą, ale o przeciwnym znaku. Równocząsteczkowa mieszanina dwóch takich związków (zwanymi enancjomorficznymi lub lub enancjostereoizomerycznymi) nie skręca płaszczyzny światła spolaryzowanego i nosi nazwę racematu [1].
Do najpopularniejszych cukrów zalicza się D-ryboza, D-galaktoza, D-mannoza i D-fruktoza. Powszechnie znany miód jest mieszaną dwóch cukrów, a mianowicie: D-glukozy i D-fruktozy. Pośród nielicznych naturalnych cukrów prostych szeregu L znajduje się L-arabinoza i L-galaktoza. Wolne triozy nie zostały wykryte w przyrodzie, jednakże występują w komórkach żywych w postaci fosforanów, podobnie w przyrodzie nie znaleziono także wolnych tetroz [4].
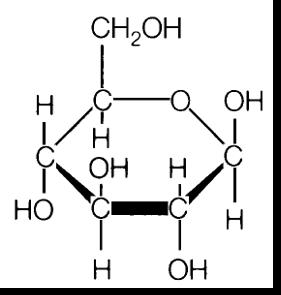 Zdjęcie: Glukoza, http://www.greenspirit.org.uk/resources/glucose.gif
Zdjęcie: Glukoza, http://www.greenspirit.org.uk/resources/glucose.gif Cukry takie jak D-Glukoza i D-fruktoza są produkowane przez rośliny zielone w procesie fotosyntezy z dwutlenku węgla (CO2) oraz wody. D-Glukoza spotykana jest w wielu owocach oraz we krwi, cukier ten stanowi także wyłączne źródło energii potzebnej dla prawidłowego funkcjonowania mózgu [4].
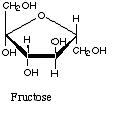 Zdjęcie: Fruktoza, http://www.food-info.net/pl/products/sugar/chemistry.htm
Zdjęcie: Fruktoza, http://www.food-info.net/pl/products/sugar/chemistry.htmZ kolei, wolne cukry spotyka się w owocach lub innych częściach roślin,w tym np. w łodygach (przykłądem może być trzcina cukrowa), korzeniu (np. w burakach) bądź w kwiatach (np. nektar).
W skład mleka wchodzi cukier laktoza (tzw. cukier mleczny). Laktoza jest dimerem D-glukozy i D-galaktozy. W słodzie (np. w kiełkujących zbożach) pojawia się inny dimer, złożony tylko D-glukozy – maltoza (tzw. cukier słodowy). Maltoza powstaje w wyniku hydrolizy skrobi, z kolei skrobia, podobnie jak i celuloza oraz glikogen są polimerami D-glukozy.
Celuloza stanowi około 80% suchej masy roślin wyższych. Wiele innych produktów roślinnych należy do cukrów złożonych ( czyli polimerów cukrów prostych), w tym łupiny orzechów, gumy roślinne, wyciągi typu agaru, dekstrany, pektyny i inne [4].
Najważniejszą funkcją cukrów jest ich uczestniczenie w procesach biochemicznych jako materiał budulcowy, substancje zapasowe, przenośniki informacji, substancje znakujące (determinanty, kwas sjalowy), a także podstawowy (obok białek i tłuszczów) składnik pożywienia [4].
W wyniku zadziałania na cukry stężonymi kwasami nieorganicznymi , cukry ulegają procesowi dehydratacji w wyniku czego tworzą się związki furfuralowe. Jeżeli dehydratacji ulegają heksozy, tworzy się 5-hydroksymetylenofurfural, z kolei w przypadku pentoz tworzy się furfural. Powstałe w ten sposób związki, ulegają kondensacji z fenolami, chinonami oraz aminami aromatycznymi, tworząc połączenia triarylometanowe o charakterystycznym zabarwieniu. Powyższe reakcje wykorzystywane są do identyfikacji, różnicowania oraz do oznaczeń ilościowych cukrów [4].
Cukry można oznaczać ilościowo na kilka sposobow. Wśród znanych metod wyróżnić można metodę biologiczną, opierającą się na fermentacji, w ktorej glukoza i fruktoza są ostatecznie przekształcane w alkohol etylowy i dwutlenek węgla. Z kolei, metody fizyczne polegają na oznaczaniu ciężaru właściwego roztworu cukru, bądź jego skręcalności właściwej (tj. skręcanie płaszczyzny światła spolaryzowanego). Metody te są szybkie, jednakże niemniej wymagają dużej ilości materiału wyjściowego do ich przeprowadzenia. Ponadto, wśród stosowanych metod wyróżnia się także metody chemiczne, które stanowią liczną grupę metod opartych na właściwościach redukujących cukrów. W przypadku oligo- i polisacharydów, które nie posiadają właściwości redukujących konieczna jest ich wcześniejsza hydroliza. Bardzo dokładnymi metodami polegającymi na wykorzystaniu specyficznych enzymów (przekształcających badaną cząsteczkę cukru) są metody enzymatyczne . Metody chemiczne i enzymatyczne dostarczają produkty, które następnie oznaczane są np. spektrofotometrycznie [3].
Badanie właściwości chemicznych jednocukrów (właściwości redukujące)- reakcja z odbarwioną fuksynąRoztwór fuksyny pod wpływem wodorosiarczanu (IV) sodu ulega odbarwieniu dzięki przyłączeniu do cząsteczki barwnika anionu HSO3-. Dodanie do roztworu odbarwionej fuksyny aldehydów( które silnie reagują z siarczanami (IV)- tj. siarczynami), powoduje ponowne zabarwienie się roztworu.
Wykonanie:
Do kilku ml czerwonego 0,01% roztworu fuksyny należy dodać NaHSO3 w stanie stałym, aż do odbarwienia roztworu. Odbarwiony roztwór należy podzielić na 2 części . Do jednej części wprowadzić parę kropli rozcieńczonej formaliny ( pojawi się czerwone zabarwienie), z kolei do drugiej części należy dodać roztwór glukozy ( brak pojawiania się zabarwienia) [1].
Próba BenedictaMetoda ta należy do najbardziej swoistych a zarazem najbardziej czułych prób redukcyjnych na cukry. W skład odczynnik wchodzi węglan sodu oraz cytrynian sodu. W wyniku reakcji powstaje węglan. Próba ta charakteryzuje się dość dużą czułośćią, ponieważ już 0,1% stężenie cukru redukującego w próbce powoduje zmianę barwy roztworu z niebieskiej na zieloną. Zielona barwa roztworu jest wynikiem reakcji pomiędzy pomarańczową zawiesiną Cu2O i niebieskim odczynnikiem[1].
Wykonanie:
Do 5 ml odczynnika należy dodać 0,5 ml roztworu glukozy, próbkę wstwić do wrzącej łaźni wodnej na ok. 5 minut. W zależności od ilości glukozy w próbce powstaje albo tylko zielone zabarwienie, albo osad: żółty, pomarańczowy lub czerwony [1].
Próba TollensaZasada metody polega na redukcji jonów srebra do srebra metalicznego. Odczynnik Tollensa to amoniakalny roztwór azotanu srebra, który w reakcji z aldehydami ( w tym z aldozami) kation srebrowy ulega redukcji do srebra metalicznego,które osadza się na ściankach szklanego naczynia w postaci lustra.
W wyniku reakcji aldoza utlenia się do kwasu glikonowego. Zachodzenie szybkiej reakcji tworzenia lustra srebrowego jest dowodem na obecność w środowisku aldehydu (aldozy). Jeżeli reakcji tej poddamy ketozę, to także zaobserwujemy wolne tworzenie się lustra srebrowego, ale dopiero po wielokrotnie dłuższym czasie,który potrzebny jest do przekształcenia się ketozy w epimeryczną aldozę. Ketony zwykłe są niewrażliwe na test (próbę) Tollensa.
Co ciekawe, reakcja redukcji soli srebra za pomocą aldehydów wykorzystywana jest do wytwarzania luster [1], [4].
Wykonanie:
Do 2 ml roztworu AgNO3 należy dodać kilka kropli 10% roztworu NaOH oraz 10% roztworu NH3. Roztwór NH3 dodawać aż do momentu rozpuszczenia się osadu wodorotlenku srebrowego w jego nadmiarze. Do amoniakalnego roztworu wodorotlenku srebra , Ag(NH3)2OH należy dodać około 2 ml roztworu glukozy, próbkę zamieszać, a następnie wstawić do wrzącej łaźni . Po kliku minutach inkubacji na ściankach można zaobserwować wydzielanie się na ściankach probówki metalicznego srebra w postaci lustra [1].
W środowisku zasadowym cukry mogą redukować nie tylko jony metali ciężkich, lecz także inne związki (np. kwas pikrynowy, heksacyjanożelazian(III) potasu czy błękit metylenowy [1].
Redukcja kwasu pikrynowegoW wyniku reakcji kwas pikrynowy redukowany jest do kwasu pikraminowego, powstający w środowisku alkalicznym pikraminian sodu- daje czerwone zabarwienie próbki.
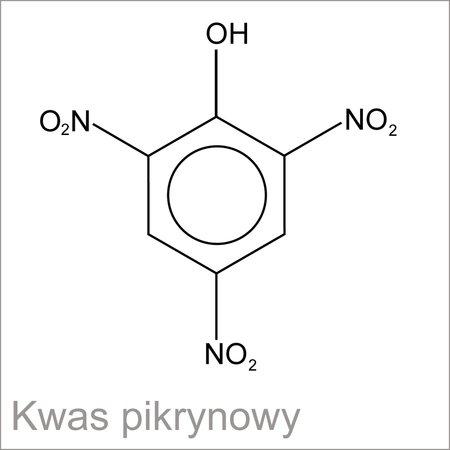
Zdjęcie: Wzór kwasu pikrynowego, http://portalwiedzy.onet.pl/124113,1,,,wzor_strukturalny_kwasu_pikrynowego,haslo.html
Wykonanie:
Do 1 ml roztworu glukozy należy dodać 1 ml nasyconego roztworu kwasu pikrynowego, oraz 0,5 ml 10% roztworu NaOH. W wyniku ogrzewania próbki pojawia się czerwone zabarwienie [1].
Test FehlingaTest ten polega na utlenianu aldoz za pomocą soli Cu(II) w zasadowym roztworze winianu sodowo-potasowego. W wyniku tej reakcji, aldoza utlenia się do kwasu glikonowego, z kolei jon Cu(II) redukuje się do Cu(I) i w środowisku zasadowym utleniacz wytrąca się w postaci pomarańczowego osadu Cu2O.
Ketozy reagują z odczynnikiem Fehlinga w podobny sposób jak z odczynnikiem Tollensa (tzn.
pomarańczowy osad zaczyna się wolno wytrącać po upływie kilku minut) [4].
W metodzie tej używa się dwóch odczynników Fehlinga: odczynnika Fehlinga I, który zawiera CuSO4, oraz odczynnik Fehlinga II, w skłąd którego wchodzi NaOH i winian sodowo-potasowy [5].
Winian sodowo-potasowy zapobiega wytrącaniu się osadu Cu(OH)2, co może mieć miejsce przy małym stężeniu cukru. Sól ta wiąże jony Cu2+ tworząc kompleksową sól kwasu winowego [5].
Wykonanie:
Należy przygotować 2 probówki.
W pierwszej probówce należy zmieszać 0,5 ml odczynnika Fehlinga I i 0,5 ml odczynnika Fehlinga II.
W drugiej probówce umieścić 1 ml glukozy. Obydwie probówki należy ogrzewać aż do wrzenia, po czym oba roztwory należy zlać razem. Po zmieszaniu powinno pojawić się zabarwienie lub brunatno-czerwony osad wydzielonego Cu2O [5].
Analiza jakościowo monocukrów- odczyn Nylandera W skłąd odczynnika Nylandera wchodzi zasadowy azotan bizmutu, KOH i winian sodowo-potasowy, który spełnia tę samą rolę, co w odczynie Felinga i co cytrynian w odczynie Benedicta. Pod wpływem cukrów, redukcji ulega Bi3+ do Bi0 [5].
Wykonanie:
Do 5 ml 1% roztworu glukozy należy dodać kilka kropel odczynnika Nylandera, próbkę wymieszać, po czym wstawić do wrzącej łaźni wodnej na ok. 5 minut. W wyniku ogrzewania dochodzi do wytrącania się czarnego osadu metalicznego bizmutu [5]
Autor: Lidia KoperwasLiteratura:[1]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.260 - 261, 269
[2]. Stryer L, 2003. Biochemia. Przekład zbiorowy pod redakcją: Augustyniak J, Michejda J, z czwartego wydania amerykańskiego. Wydawnictwo Naukowe PWN, Warszawa 2003, s.295-295.
[3]. Derlacz R., Girstun A., Kowalska-Loth B., Kozłowski P., Piekiełko-Witkowska A., Szakiel A., Trzcińska-Danielewicz J., 2008. Podstawy Biochemii dla Ochrony Środowiska. UW, Wydz. Biologii, Instytut Biochemii, Warszawa 2008. s. 12-13.
[4].http://tczew.net.pl/~mgrmisiek/Technologia%20Chemiczna/C%20U%20K%20R%20Y%20%20_sacharydy_.pdf
[5].http://www.biologia.studies.uj.edu.pl/binoz/iz/zbg/materialy_cw/cw_8_cukry_proste.pdf


 Słowa kluczowe: cukry proste, monocukry, węglowodany, oznaczanie ilościowe cukrów, próba Benedicta, próba Tollensa, redukcja kwasu pikrynowego, test Fehlinga, odczyn Nylandera
Słowa kluczowe: cukry proste, monocukry, węglowodany, oznaczanie ilościowe cukrów, próba Benedicta, próba Tollensa, redukcja kwasu pikrynowego, test Fehlinga, odczyn Nylandera