Streszczenie
Dnitrozylowe kompleksy żelaza powstają z różnorodnych ligandów organicznych a liczba ich struktur jest niepoliczalna. Jednak wszystkie te kompleksy są paramagnetyczne i można je obserwować w bardzo złożonych układach biologicznych za pomocą metody elektronowego rezonansu paramagnetycznego. Syntetyzowane są one w organizmach z żelaza(II), tlenku azotu powstałego z rozpadu L-argininy oraz dostępnych ligandów (aminokwasów, peptydów i białek). Zwiększone stężenie dinitrozylowych kompleksów żelaza pojawia się w organizmach przy stanach patogennych i neurodegradacyjnych.
Wstęp
Żelazo oraz jego dinitrozylowe kompleksy z ligandami organicznymi to jedna z najbardziej interesujących grup związków paramagnetycznych a jednocześnie biologicznie czynnych. Po raz pierwszy dinitrozylowe kompleksy żelaza (DNIC) zaobserwowały 44 lata temu (1965r.) dwa niezależne zespoły badawcze Vanina A.F. i Vithaythil’a A.J. Potraktowali oni materiał biologiczny: komórki drożdży (zespół Vanina A.F.) i tkanki – hepatocyty szczurze (zespół Vithaythil A.J.) nadmiarem tlenku azotu (II). Następnie za pomocą metody spektroskopowej – elektronowego rezonansu paramagnetycznego zarejestrowali sygnał o wartości współczynnika rozszczepienia spektroskopowego 2,04. Sygnał ten został zinterpretowany jako pochodzący od kompleksów jonów żelaza z tlenkiem azotu oraz sulfonowych ligandów.
Przełom nastąpił dopiero 21 lat później, kiedy to tlenek azotu (II) został zakwalifikowany jako nieorganiczny śródbłonkowy czynnik rozkurczający a więc wpływający na rozszerzanie mięśni gładkich naczyń krwionośnych a tym samym regulującym ciśnienie krwi w zamkniętych układach krwionośnych a zatem DNIC jako prawdopodobny nośnik NO wzbudził szczególne zainteresowanie, dzięki czemu rozpoczęto szereg badań mających na celu poznanie struktury i właściwości tego specyficznego kompleksu. Obecnie wiadomo, że DNIC pochodzenia endogennego razem z nitrozotiolami stabilizuje, magazynuje i transportuje tlenek azotu(II) w organizmach ludzi i zwierząt
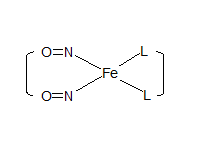
Cząsteczka dinitrozylowych kompleków żelaza to kompleks dwóch ligandów organicznych (aminokwasy, peptydy, białka - L) i dwóch nieorganicznych grup NO skoordynowanych przez centralny jon – żelazo (stopień utlenienia żelaza jest kwestią sporną), co przedstawiane jest schematycznie L2Fe(NO)2:
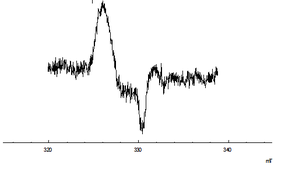
Ligandem organicznym może być dowolna struktura organiczna mająca w swojej budowie atomy azotu (pierścienie imidazolowe) lub siarki (tiole), które posiadają wolne pary elektronowe. Ponieważ związków o takiej budowie może być tak samo wiele jak ligandów zawierających te grupy, wszystkie one zostały nazwane dinitrozylowymi kompleksami żelaza a cechą wiążącą wszystkie te kompleksy jest ich paramagnetyczny sygnał singletowy o wartości rozszczepienia g=2,03.
Rys.1 Sygnał DNIC powstały w układzie in vitro (badania własne).
Ze względu na różnorodność ligandów oraz ułatwienia opisu właściwości poszczególnych związków stosuje się następujący podział:
- Wysokocząsteczkowe ligandy – masa cząsteczkowa powyżej 100kD
- Niskocząsteczkowe ligandy – masa cząsteczkowa poniżej 100kDa
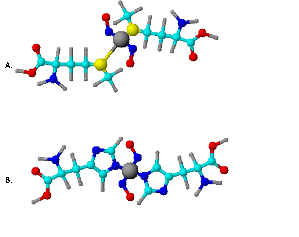
Rys.2 Różnorodność struktury DNIC. A, B – niskocząsteczkowy DNIC (odpowiednio cysteinowy, histydynowy); B – wysokocząsteczkowy.
W literaturze, spotyka się wiele doniesień na temat budowy DNIC. Jednak dane te nie są jednoznaczne. Oczyszczenie i krystalizacja tych związków nie są łatwe z powodu nietrwałości tego kompleksu in vivo i in vitro. Jedną z pierwszych struktur krystalograficznych jaka została opisana w roku 1999 przez Reginato jest niskocząsteczkowa, dwunirtrozylowa cząsteczka zawierająca dwie grupy 1-metyloimidazolu. W kompleksie tym żelazo połączone jest wiązaniem kowalencyjnym z azotem (3N) pierścienia imidazolowego oraz tlenkiem azotu poprzez atom azotu. Z przeglądu literaturowego wynika, że struktura DNIC zbudowanego z niskocząsteczkowych ligandów nie zawierających w swojej strukturze grup tiolowych jest lepiej poznana niż struktura DNIC zbudowanego także z niskocząsteczkowych ligandów ale zawierających grupy tiolowe. Stwierdzono bowiem, że niezależnie od rozpuszczalnika i fazy w jakiej się znajduje kompleks (ciekłej lub krystalicznej) posiada on zawsze strukturę tetraedryczną [7]. Analiza widm elektronowego rezonansu paramagnetycznego wykazała, że krystaliczny DNIC zawierający w swojej strukturze ligandy tiolowe posiada także strukturę tetraedralną jednak umieszczony w roztworze wodnym ulega transformacji do płaskiego kwadratu . Zakłada się, że sygnał paramagnetyczny DNIC w roztworach wodnych pochodzi zatem od najbardziej stabilnej struktury (HFS – hyperfine structure), która powstaje z interreakcji jednej molekuły żelaza koordynującej dwa kationy tlenku azotu (NO+) oraz dwóch ujemnie naładowanych ligandów. Niesparowany elektron jest zlokalizowany na atomie żelaza, które przyjmuje w tym układzie konfiguracje [Ar] 3d7. Wyjaśniało by to zatem paramagnetyczność cząsteczki, jednak inne badania wskazują, że jest możliwa także konfiguracja żelaza [Ar] 3d9 . Autorzy tego postulatu opisali nie tylko strukturę elektronową, ale i geometryczną stwierdzając także budowę tetraedryczną, którego symetryczność zależy od budowy ligandów organicznych. Badania strukturalne i spektroskopowe przybliżyły zatem geometrię cząsteczki, ale nie dały jednoznacznej odpowiedzi jaka jest struktura eletronowa niskocząsteczkowych kompleksów nitrozylowych. Stąd też wielu badaczy rozpoczęło badania DFT (Density functional theory; teoretyczne wyliczenia gęstości elektronowej cząsteczki), które miały znależć odpowiedz na pytanie: na którym stopniu utlenienia znajduje się żelazo w DNIC. Ponownie badacze nieotrzymali jednoznacznej odpowiedzi. W częśi badań stwierdzono, że żelazo występuje w formie Fe1+ [3d6s1]. Problem ten stał się jeszcze bardziej skomplikowany gdy ligandem organicznym nie jest aminokwas lecz białko . Zespół Lee badał powstawanie DNIC z ferrytyny, białka naturalnie magazynującego żelazo. Otrzymali oni trzy typy kompleksów dających tą samą wartość rozszczepienia ale o innym przebiegu widma, stąd tez wysnuli wniosek, że DNIC tworzy się nie tylko z histydyny przez azoty imidazolowe i siarkę pochodzącą z grup tiolowych cysteiny lecz także z karboksylowych grup asparginianu i glutaminianu. Inne badania wykazały, że DNIC powstaje z białek, które nieposiadały dostępnych grup tiolowych ani imidazolowych, ale pod wpływem działania NO utraciły klastry [Fe-S] a tym samym zmieniły swoją strukturę i generowały paramagnetyczne kompleksy .
Podsumowanie
Dinirozylowe kompleksy żelaza ciągle stawiają wiele pytań, nie dziwi, więc fakt, że cieszą się one popularnością wśród badaczy, a liczba artykułów i publikacji, dotyczących syntezy, budowy oraz właściwości i roli tych związków, jak i ich pochodnych, ciągle wzrasta. Do badań zachęca także fakt, iż związki te generowane są w organizmach przy stanach zapalnych i patogennych (choroba Parkinsona, nowotwory) a co za tym idzie lepsze ich poznanie może wpłynąć na leczenie i profilaktykę.
Bibliografia:
- Vanin A.F., Nalbandyan. 1965. Free radical species of a new type in yeast cells. Biofizyka (Russia) 10 pp. 167-168
- Vanin A.F., Nalbandyan. 1966. Free radical species with unpaired electron localization on sulfur atom in yeast cells. Biofizyka (Russia) 11 pp. 178-179
- Vithaythil A.J., Ternberg J.L., Commoner B. 1965. Changes in electron spin resonance signals of rat liver during chemical carcinogenesis. Nature 207 pp. 1240-1249
- Palmer R.M., Ferrige A.G., Moncada S. 1987. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature 327 (6122) pp. 524-526
- Vanin A.F. 1998. Dinitrosyl-iron complexes and S-nitrosothiols are two possible forms of stabilization and transport of nitric oxide in biological systems. Biochemistry 63 pp.782-793
- Vanin A.F. 2004. Dinitrosyl-iron complexes are endogenous signaling agents in human and animal cells and tissues. Hypothesis, Biofizika (Russia) 49 pp.581-586
- Reginato N., McCrory C.T.C., Pervitsky D., Li L. 1999. Synthesis, X-ray crystal structure, and solution behavior of Fe(NO)2(2-MeIm)2: implications for nitrosyl-iron complexes with g=2,03. J.Am. Chem. Soc., 121 pp.10217-10218
- Sanina N.A., Rakova O.A., Aldoshin S.M., Shilov G.V., Chuev I.I., Atovmyasn E.G., Ovanesyan N.S. 2001 Synthesis and X-ray and spectral study of the compounds [Q4N]2[Fe2(S2O3)2(NO)4] (Q=Me, Et, n-Pr, n-Bu). Russ. J. Coord. Chem. 27 pp. 179-183
- Sanina N.A., Rakova O.A., Aldoshin S.M., Shilov G.V., Shulga Y.M., Kulikov A.V., Ovanesyan N.S. 2004 Structure of the neutral mononuclear dinitrosyl-iron complex with 1,2,4-triazole-3-thione {Fe(SC2H3N3)2(NO)2]0.5H2O. Mendeleev Comm. (Issue1) pp.1-2
- Tsai M.-I., Chen C.-C., Hsu I.-J., Ke S.-C., Hsien C.-H., Chiang K.-A., Lee G.-H., Wang Y., Chen J.-M., Lee J.-F., Liaw W.-F. 2004. Photochemistry of the dinitrosyl-iron complex [S5Fe(NO)2]- leading to reversible formation of [S5Fe(µ-S)2(FeS5)2-: Spectroscopic charakterization of species relevant to the nitric oxide modification and repair of [2Fe-2S] ferredoxins. Inorg. Chem. 43 pp. 5159-5167
- Chiang C.-Y., Miller M.L., Reibenspies J.H., Darensbourg M.Y. 2004. Bismercaptoethandiazacyclooctane as a N2S2 chelating agent and cys-X-cys mimic for Fe(NO) and Fe(NO)2. J. Am. Chem. Soc. 126 pp.10867-10874
- Chen H.-W., Lin C.-W., Chen C.-C., Yang L.-B., Chiang M.-H., Liaw W.-F. 2005. Homodinuclear iron thiolate nitrosyl compounds [(ON)FeS,S-C6H4)Fe(NO)2]- and [(ON)Fe(SO2,S-C6H4)Fe(NO)2]- with {Fe(NO)}7 - {Fe(NO)}9 Electronic coupling: New members of class of dinitrosyliron complexes. Inorg. Chem. 44 pp.3226-3232
- Wang X., Sundberg E.B., Li L., Kantardjieff K.A., Herron S.R., Lim M., Ford P. 2005.A cycilc tetra-nuclear dinitrosyl-iron complex [Fe(NO)2(imidazolate)4]: synthesis, structure stability. Chem. Comm. pp.477-479
- Cesario E., Parker L.J., Pedersen J.Z., Nuccetelli M., Mazzetti A.P., Pastore A., Federici G., Caccuri A.M., Ricci G., Adams J.J., Parker M.W., LoBello M. 2005. Nitrosylation of human transferase P1-1 with dinitrosyl diglutathionyl iron complex in vitro i in vivo. J. Biol. Chem. 280 pp.42172-42180
- Vanin A.F., Sanina N.A., Serezhenkov V.A., Burbaev D. Sh., Lozinsky V.I., Aldoshin S.M. 2006. Dinitrosyl-iron complexes with thiol-containing ligands: Spatial and electronic structures. Elsevier Nitric Oxide 16 (2007) pp.82-93
- Bryar T.R.; Eaton D.R. 1992. Electronic configuration and structure of paramagnetic iron dinitrosyl complexes. Can. J. Chem. 70 pp. 1917-1926
- Shumaev K.B., Gubkin A.A., Gubkina S.A., Gudkov L.L., Lakomkin V.L., Topunov A.F., Vanin A.F., Ruuge E.K. 2007. Interaction between albumin-bound dinirosyl iron complexes and reactive oxygen species. Biophysics 52(5) pp. 534-538
- Lee M., Arosio P.,Cozzi A., Chasteen N.D. 1994. Identyfication of the EPR-active iron-nitrosyl complexes in mammalian ferritins. Biochemistry 33(12) pp.3679-3687
- Foster H.W., Cowan J.A. 1999. Chemistry of nitric oxide with protein-bound iron sulfur center. Insights on physiological reactvity. J. Am. Chem. Soc. 121 pp.4093-4100
- Bastian N.R., Yim C.Y., Hibbs J.B., Samlowski W.E. 1994. Induction of iron-derived EPR signals in murine cancers by nitric oxide. Evidence for multiple intracellular target. J. Biol. Chem. 269 (7) pp. 5127-5131
- Shergill J.K., Cammack R., Cooper C.E., Cooper J.M., Mann V.M, Schapira A.H. 1996. Detection of nitrosyl complexes in human substantia nigra, in relation to Parkinson’s disease. Biochem. Biophys. Res. Commun. 228 (2) pp.298-305
Autor: Karolina Wójciuk
Tagi:
DNIC,
dinitrozylowe kompleksy żelaza,
tlenek azotu,
paramagnetyczność,
lab,
laboratoria,
laboratorium
wstecz
Podziel się ze znajomymi