

|
Zamknij X
|
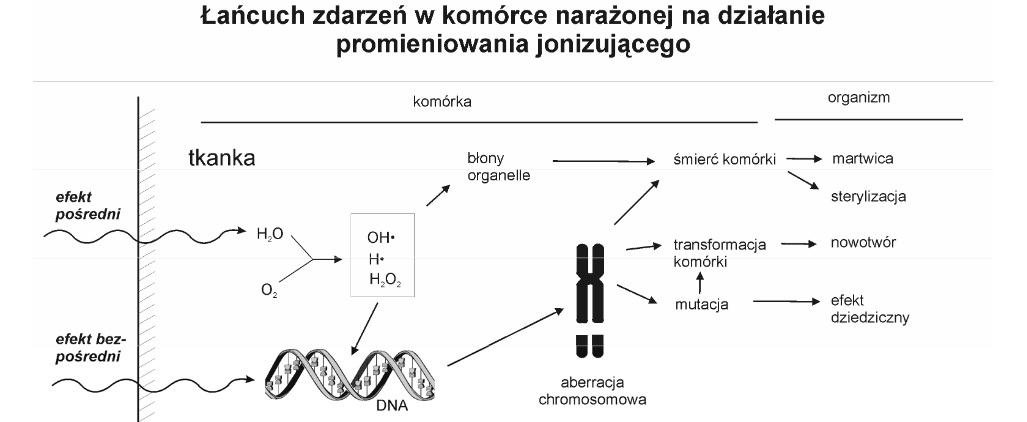
Obserwacja, która dostarczyła informacji na temat tego, że uszkodzenia chromosomów mogą być spowodowane ekspozycją komórek na promieniowanie jonizujące lub rakotwórcze chemikalia, była jednym z pierwszych dowodów, że czynniki fizyczne i chemiczne mogą spowodować znaczące zmiany w materiale genetycznym komórek eukariotycznych. Pomimo, że wiedza na temat budowy chromosomów była wtedy niekompletna, dostarczone dowody wskazywały, że zaburzenia chromosomowe są bezpośrednim skutkiem i objawem uszkodzenia na poziomie DNA (np. uszkodzenia chromosomów mogą wynikać z nienaprawionej podwójnej nici DNA, a zmiany w chromosomach z braku naprawy przerw w nici DNA).
Wiadome jest, że utrata chromosomów i ich uszkodzenia odgrywają główną rolę w procesach nowotworzenia i starzenia się komórek oraz, że są one prawdopodobnie spowodowane defektami wrzeciona, centromeru a w konsekwencji nieskondensowanej struktury chromosomów przed metafazą [9].
Zdjęcie: http://www.ujk.edu.pl/ibiol/ZRI/wyklad%20radiobiologia%20Kielce%20FizMed%2002.pdf
W klasycznych technikach cytogenetycznych chromosomy są badane bezpośrednio przez obserwację i liczenie aberracji w metafazie. Takie podejście zapewnia najbardziej szczegółową analizę, jednakże złożoność i pracochłonność badania (kolejnego przedstawiania) aberracji w metafazie przyczyniły się do opracowania prostszego systemu pomiaru uszkodzeń chromosomów. Schmid W.(1975) i Heddle J.A (1973) zaproponowali (niezależnie) alternatywne i prostsze podejście do oceny uszkodzenia chromosomów in vivo, mierząc mikrojądra (MNi)- znane także jako ciała Howell-Jolly [9].
Badanie mikrojąder w szpiku kostnym i erytrocytach krwi obwodowej jest jednym z najlepiej znanych testów cytogenetycznych in vivo w zakresie toksyczności genetycznej, jednak nie jest to technika która może mieć zastosowanie do komórek innych populacji in vivo i in vitro. Wciąż opracowywane są nowe metody do pomiaru mikrojąder w różnych komórkach jądrzastych in vitro [9].
Powstanie mikrojąder zachodzi w dzielących się komórkach, które albo zawierają chromosomy bez centromerów (fragmenty acentryczne) albo całe chromosomy, które nie są w stanie przemieszcać do biegunów wrzeciona podziałowego podczas mitozy. W telofazie pojawiają się jądrowe formy dookoła chromosomów, które stopniowo ulegaja dekondensacji i przejmują morfologię jądra interfazowego z tym wyjątkiem, że są one mniejsze niż główne jądro w komórce, w związku z czym określane są mianem „mikrojąder” [9].
Badanie uszkodzeń DNA na poziomie chromosomów jest istotną częścią toksykologii genetycznej ze względu na fakt, że mutacje chromosomowe są bardzo ważnym etapem karcenogenezy. Test mikrojądrowy jest preferowaną metodą do ujawniania uszkodzeń chromosomów, ponieważ umożliwia diagnozowanie zarówno utraty jak i pęknięć chromosomów, dając miarodajne i wiarygodne wyniki [9].
Test mikrojądrowy (MN) jest powszechnie stosowaną metodą, która służy do przeżyciowego określania uszkodzeń chromosomów pod wpływem różnych czynników. Co więcej, test ten jest uniwersalny, ponieważ mikrojądra mogą być łatwo identyfikowane we wszystkich komórkach posiadających jądro
komórkowe. W przypadku ssaków ze względu na to, że ich erytrocyty nie posiadają jąder, test przeprowadza się na leukocytach. Mikrojądra definowane są jako chromatynowe struktury znajdujące się wewnątrz cytoplazmy. Swoją budową przypominają małe dodatkowe jądra w komórce. Mikrojądra powstają wskutek utraty lub opóźnienia formowania chromosomów w anafazie podziału mitotycznego lub z acentrycznych fragmentów chromatynowych tj. części chromosomów nie zawierających centromeru. Tak więc, tworzenie mikrojąder związane jest z chromosomowymi aberracjami liczbowymi - kiedy to tracony jest jeden lub kilka chromosomów z jądra komórkowego lub strukturalnymi (ubytek fragmentu jednego bądź kilku chromosomów).
Utracone podczas podziału komórki chromosomy lub ich fragmenty tworzą w cytoplazmie charakterystyczne struktury o okrągłej budowie - to właśnie są mikrojądra [1], [2].
Barwienie mikrojąder
Mikrojądra można wybarwiać, ponieważ pochłaniają one odczynnik Giemzy w identyczny sposób jak jądro komórkowe (a inaczej niż barwi się cytoplazma). Wynika to z faktu, że mikrojądra zbudowane są z tego samego materiału co jądro - z chromatyny jądrowej. Mikrojądra pojawiają się w komórkach w wyniku oddziaływania na nie różnych czynników fizycznych np. temeratury czy czynników genotoksycznych (związków o działaniu mutagennym i kancerogennym) [1]. Stosując odpowiednie wybarwienie DNA test mikrojądrowy pozwala na obserwowanie zmian cytogenetycznych, które zachodzą np. w komórkach nabłonkowych. Zazwyczaj do komórek nabłonkowych stosuje się barwienie metodą Feulgena, które w porównaniu do barwienia barwnikami fluorescencyjnymi jest proste i stosunkowo tanie, a ponadto pozwala na wyeliminowanie fałszywie dodatnich wyników [2].
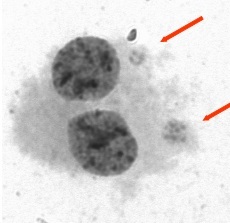
Zdjęcie: komórka dwujądrzasta z dwoma mikrojądrami (zaznaczone strzałką), http://www.ichtj.waw.pl/drupal/?q=node/529 [5].
Przygotowanie materiału do testu mikrojądrowego w komórkach nabłonkowych z jamy ustnej
Prawidłowe przygotowanie materiału komórkowego jest niezwykle ważnym etapem całej procedury, gdyż jakość uzyskanych preparatów ma istotne znaczenie podczas końcowej analizy.
Poniżej przedstawiono procedurę izolacji, oczyszczania i homogenizacji komórek nabłonkowych wg Thomasa i wsp. (2009) oraz opisano metodę utrwalania materiału wraz z wykonaniem preparatów mikroskopowych wg Błaszczyk i wsp. (2012).
a) pobraną zawiesinę komórek nabłonkowych należy wytrząsać na vortexie, po czym przenieść do 15 ml probówki wirówkowej. Próbkę zwirować (10 minut, 581x g )
b) po wirowaniu należy usunąć otzrymany supernatant- pozostawić ok 1 ml zawiesiny do której dodać 5 ml świeżo przygotowanego roztworu PBS. Całość próbki dokładnie vortexować i ponownie zwirować (jak wyżej) - usunąć supernatant i ponownie dodać 5 ml buforu PBS
c) W celu otrzymania zawiesiny pojedynczych komórek, próbkę należy homogenizować przy użyciu homogenizatora (20 000 obr./min, 2-3 minuty).
d) W celu usunięcia agregatów komórkowych oraz innych występujących zanieczyszczeń, próbkę należy przefiltrować przez filtr nylonowy ( o średnicy porów 100µm), ponownie zwirować jak wyżej . Po wirowaniu usunąć powstały supernatant tak, by pozostawić około 1ml zawiesiny w probówce wirówkowej [2].
e) Przygotować rozcieńczenie próbki w mieszaninie etanolu i lodowatego kwasu octowego zmieszanych w stosunku 3:1. Końcowe rozcieńczenie powinno być takie, by uzyskać 80 000 komórek/1 ml próbki ( w tym celu wykorzystać komorę Thoma by sprawdzić gęstość próbki). W celu uniknięcia sklejania się komórek do osadu dodawano mieszaninę utrwalającą kroplami - mieszając równocześnie próbkę na vortexie. Cały proces utrwalania powinien trwać minimum 20 minut.
f)Końcowym etapem jest naniesienie uzyskanego materiału na szkiełko mikroskopowe, nakłądając go w 3 rzędach na całej długości szkiełka. Szkiełka pozostawić do całkowitego wyschnięcia, a następnie przechowywać w 4°C [2].
Zastosowanie testu
Test mikrojądrowy (MN) wykorzystywany jest do wykrywania związków klastogennych to jest takich, które doprowadzają do pojawienia się zmian strukturalnych w chromosomach. Mikrojądra powstają w wyniku uszkodzenia wrzeciona podziałowego, w wyniku czego w komórce wyodrębnia się jedno lub kilku mniejszych jąder. Jądra te zawierają głównie acentryczne fragmenty chromosomów, a czasem nawet całe chromosomy [8].
Zmiany strukturalne chromosomów
Zmiany strukturalne chromosomów widoczne są w metafazie, w której można wyrożnić dwa rodzaje aberracji: aberracje chromatydowe oraz chromosomowe.
W przypadku, gdy komórka została napromieniowana we wczesnej interfazie czyli przed duplikacją materiału genetycznego (test G0), powstają mutacje chromosomowe (chromosomy pierścieniowe, dwucentryczne- dicentryki, fragmenty acentryczne, translokacje).
Z kolei, gdy komórki poddano napromieniowaniu w późnej interfazie czyli w momencie zduplikowania materiału DNA (test G2) wyrożnia się tzw. aberracje chromatydowe (tj. acentryczny fragment jednej z chromatyd, pęknięcia chromatyd). Szeroko zakrojone badania wykazały, że pomiar uszkodzeń DNA w zależności od fazy cyklu komórkowego ma niezwykłe znaczenie w ocenie wrażliwości na promieniowanie u chorych z różnego rodzaju nowotworami złośliwymi [7].
Test mikrojądrowy - procedura wg Burzan i wsp. (2007).
Test mikrojądrowy - procedura wg Błaszczyk i wsp. (2012)
Materiał badawczy utrwalony na preparatach mikroskopowych należy przeprowadzić przez szereg uwadniający tj: 50% etanol, wodę 20%, kontrolę negatywną. Następnie, szkiełka inkubować przez 30 minut w 5 M HCl jednocześnie należy przygotować kontrolę negatywną, tj. umieścić szkiełko w wodzie zamiast w HCl, w celu sprawdzenia skuteczności działania kwasu solnego. Inkubacja ma na celu zdenaturowanie DNA. Kolejnym etapem jest 90-minutowa inkubacja szkiełek w odczynniku Schiffa, przeprowadzana w ciemności. Dzięki niej DNA zabarwi się na kolor purpurowy. W celu wybarwienia cytoplazmy preparaty poddaje 30 sekundowemu zanurzeniu w 0,2% roztworze Light Green, po czym preparaty moża odwodnić w etanolu, co ma zapobiec ich blaknięciu. Wysuszone szkiełka należy zamknąć przy pomocy żywicy (medium) stosowanej do preparatów histopatologicznych (np. medium DPX) [2], [3].
Zamykanie preparatów należy przeprowadzić bardzo ostrożnie i wolno. Należy je wykonywać tak, aby pod powierzchnią szkiełka nakrywkowego nie pozostały pęcherzyki powietrza, gdyż znacznie utrudniają obserwację. Po upływie godziny następuje polimeryzacja żywicy, przygotowany preparat staje się trwały i gotowy do analizy mikroskopowej [3].
W swoich badaniach Błaszczyk i wsp. (2012) przeprowadzili analizę mikroskopową preparatów w mikroskopie świetlnym przy powiększeniu 400x oraz 1000x. W preparatach obserwowano zmiany w jądrach komórkowych (wybarwionych n apurpurowo) oraz w cytoplazmie (wybarwionej na bladoniebiesko-zielono). Częstość komórek z mikrojądrami oceniano w przeliczeniu na 2000 komórek zróżnicowanych w preparatach mikroskopowych. Analizę komórek nabłonkowych przeprowadzono zgodnie z wytycznymi zaproponowanymi przez Thomasa i wsp. (2009). Dzięki istniejącej klasyfikacji możliwe jest rozróżnienie komórek: bazalnych, zróżnicowanych, z mikrojądrami, z mostkami jądrowymi, dwujądrowych, ze skondensowaną chromatyną, kariorhetycznych, piknotycznych oraz kariolitycznych [2], [4].
Na rynku dostęne są gotowe zestawy do przeprowadzenia testu mikrojądrowego (np. Cyprotex- In vitro HCS Micronucleus Test- MNT). Jest to test oparty na fluorescencyjnym obrazowaniu komórki z systemem “high content screening-HCS”, dzięki czemu test jest dokładniejszy niż metody manualne [6]. Dodatkowo, możliwe jest określenie większej ilości parametrów opisujących „stan” komórki , m.in. integralność błony komórkowej (ocena cytotoksyczności), czy informacje dotyczące przebiegu cyklu komórkowego (indeks proliferacji). W połączeniu parametry te określają zdrowie komórki (cytostaza) [6].
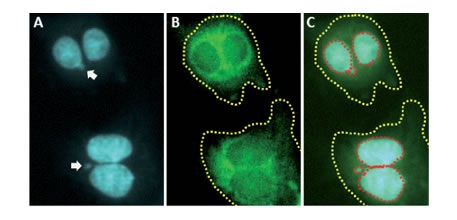
Zdjęcie: mikrojądra (białe starzłki) - test MNT(Cyprotex), http://www.cyprotex.com/toxicology/genotoxicity/in-vitro-micronucleus/ [6].
Analiza mikrojąder- preparat mikrojąder z wymazów z wewnętrznej strony policzka
Sellappa S i wsp. (2011) w swoich badaniach analizowali mikrojądra w preparatach przygotowanych z wymazów z wewnętrznej strony policzka. Ochotnicy, którzy zgłosili się do badania pocierali wewnętrzną stronę policzka bardzo miękką szczoteczką do zębów. Komórki nabłonkowe ze śliną zostały zebrane do 3 ml probówek. Następnie, do próbek dodano bufor fosforanowy (PBS) o pH=7.0 i wirowano (1500 rpm/ 10 minut). Otrzymany po wirowaniu nadsącz usunięto, a do próbki dodano kolejną 5-cio ml porcję świeżego roztworu PBS, po czym próbkę ponownie zwirowano przez 10 min przy 1500 rpm. Proces ten powtórzono 3x, ponieważ bufor PBS inaktywuje endogenne DNAzy, a także usuwa bakterie, które mogą utrudniać końcową ocenę. Po odrzuceniu supernatantu, otrzymaną peletkę komórek rozmazano na czystym szkiełku mikroskopowym (robiąc rozmaz za pomocą szkiełka nakrywkowego), preparat następnie suszono na powietrzu przez 10 minut, a dalej utrwalono w zimnym roztworze metanolu z kwasem octowym (zmieszanych w stosunku 3:1) przez 10 minut. Preparaty wysuszono na powietrzu przez 10 do 15 minut, barwiono w 2% barwniku Giemsy (10 minut). Po barwieniu szkiełka przemyto wodą podwójnie destylowaną - a tak otrzymane preparaty suszono na powietrzu, po czym analizowano pod mikroskopem świetlnym [10].
Autor: Lidia Koperwas
Literatura:
[1]. Brzuzan P., Woźny M., Łuczyński M.K., 2007. Toksykologi aMolekularna- przewodnik do ćwiczeń. UWM, Olsztyn 2007. http://biotechnology.keyland.biz/pdf/tox_mol_updated.pdf
[2]. Błaszczyk E., Mielżyńska- Švach D., 2012. Wykorzystanie komórek nabłonkowych z jamy ustnej do w monitoringu biologicznym ludzi. Medycyna Srodowiskowa - Enviromental Medicine 2012, Vol. 15, No.4, 129-138. http://www.medycynasrodowiskowa.pl/Downloads/File/2012Vol15N4/MS_2012-4_16.pdf
[3]. Podstawy techniki histologicznje, http://histologia.sum.edu.pl/files/Histotechnika1.pdf
[4]. Thomas P., Holland N., Bolognesi C., wsp., 2009. Buccal micronucleus cytome assay. Nat Protoc. 2009;4(6):825-37. doi: 10.1038/nprot.2009.53. Epub 2009 May 7.
[5]. http://www.ichtj.waw.pl/drupal/?q=node/529
[6]. http://www.cyprotex.com/toxicology/genotoxicity/in-vitro-micronucleus/
[7]. Gasińska A., 2006. Leksykon pojęć i definicji- radiobiologia kliniczna – cz.I.Number 5 • 595–604 Leksykon onkologii • Cancer lexicon, http://www.google.pl/url?sa=t&rct=j&q=&esrc=s&source=web&cd=5&cad=rja&uact=8&ved=0CEEQFjAE&url=http%3A%2F%2Fwww.nowotwory.edu.pl%2Fpobierz.php%3Fid%3D1261&ei=mhIeU6KzH6zy7AargIGIBQ&usg=AFQjCNFc3gLpURSI4XppvOFQpvfqnVhcdw&bvm=bv.62578216,d.ZGU
[8]. Bubak A. Biomoritoring mutagenności powietrza atmosferycznego i wody. Instytut Medycyny Pracy i Zdrowia Środowiskowego, Sosnowiec. http://www.ietu.katowice.pl/wpr/Dokumenty/Materialy_szkoleniowe/Szkol2/18-bubak.pdf
[9]. Fenech M., 2000. The in vitro micronucleus technique. Mutation Research 455 (2000) 81–95. http://www.icb.ufmg.br/biq/prodap/2003/micronucleos/mn1.pdf
[10]. Sellappa S., Prathyumnan S., Joseph S., Keyan K.S., 2011. Micronucleus Test in Exfoliated Buccal Cells from Chromium Exposed Tannery Workers . International Journal of Bioscience, Biochemistry and Bioinformatics, Vol. 1, No. 1, May 2011. http://www.ijbbb.org/papers/11-X00055.pdf
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje