Elektroforeza jest zjawiskiem elektrokinetycznym, w wyniku którego pod wpływem przyłożonego pola elektrycznego dochodzi do przemieszczania się makrocząsteczek obdarzonych niezrównoważonym ładunkiem elektrycznym. Prędkość przemieszczania się naładowanej elektrycznie makrocząsteczki zależy od kilku czynników tj.: od jej ładunku, rozmiaru, kształtu oraz oporów ruchu środowiska. Wykorzystując elektroforezę możliwe jest szybkie separowanie makrocząsteczek takich jak: kwasy nukleinowe (DNA, RNA) czy białka [4]. Wyróżnia się kilka rodzajów elektroforezy, które różnią się między sobą składem żeli elektroforetycznych, warunkami rozdziału, a także zastosowaniem: inny rodzaj elektroforezy stosuje się do rozdziału kwasów nukleinowych, a inny do rozdziału białek.
Elektroforeza białek w żelu poliakrylamidowym
Żele poliakrylamidowe są polimerami akrylamidu i bisakrylamidu, a od ich proporcji zależy gęstość żelu oraz wymiary porów. Gęstośc żelu dobiera się w zależności od wielkości analizowanych cząsteczek (tj. w zależności od ich masy cząsteczkowej). W przypadku wysoko-cząsteczkowych białek do rozdziału używa się żeli o niższej gęstości, zaś białka nisko-cząsteczkowe rozdziela się w żelach bardziej gęstych. W żelach 8% możliwe jest rozdzielanie cząsteczek o wielkości od 24 kDa do 205kDA, żele 10% stosuje się do rozdzielania cząsteczek o masie od 14kDa – 205 kDa, a żele 12% do rozdziału 14-66 kDa cząsteczek [9].
Elektroforeza w obecności SDS
Do rozdziału białek najczęściej stosuje się elektroforezę w obecności SDS tj. siarczanu dodecylu sodu (tzw. SDS-PAGE). SDS jest substancją powierzchniowo czynną, która przyczynia się do poprawy rozdzielczości danej techniki elektroforetycznej. Zastosowanie siarczanu dodecylu sodu podczas rozdziału przynosi wiele korzyści, ponieważ większość białek jest rozpuszczalna w elektrolitach zawierających SDS (a szczególnie takie po redukcji mostków disiarczkowych), a ponadto separacja (rozdział) białek odbywa się zgodnie z ich masami cząsteczkowymi. Należy również dodać, że barwienia kompleksów tworzonych przez białko i SDS jest znacznie wydajniejsze niż barwienie samego białka, a dodatkowo obecność SDS skutecznie eliminuje enzymatyczną degradację białek w trakcie ich separacji [4], [1]. SDS nadaje polipeptydom ładunek ujemny, dzięki czemu moga one migrować w polu elektrycznym. Ilość związanego SDS przez białko jest prawie zawsze liniowo zależna od masy danego polipeptydu, co z wykorzystaniem markera masy umożliwia wyznaczanie masy rozdzielanych białek [1]. SDS powoduje zrywanie prawie wszystkich wiązań niekowalencyjnych w białku, co w konsekwencji prowadzi do rozfałdowania się łańcucha polipeptydowego [6].
Elektroforeza natywna
Ten rodzaj elektroforezy prowadzi się w poliakrylamidzie, w warunkach, w których makrocząsteczki pozostają niezdenaturowane, dzięki czemu możliwe jest odzyskanie cząsteczek białkowych w stanie pełnej aktywności biologicznej. Próbka nałożona na żel rozpuszcza się w buforze, który nie powoduje denaturacji zawartych w niej białek. Elektroforeza natywna jest przeciwieństwem elektroforezy przeprowadzanej w obecności czynników denaturujących (np. SDS). Wadą metody jest słaba rozdzielczość [7], [9].
W celu rozdziału białek w zależności od ich masy cząsteczkowej, próbkę przed nałożeniem na żel należy zredukować w odpowiednim buforze (tzw. buforze redukującym) oraz odpowiedniej temperaturze. Związkami redukującymi (w buforach redukujących) najczęściej są:
- merkaptoetanol oraz
- DTT (ditiotreitol), związki te przecinają (redukują) mostki disiarczkowe (S-S) pomiędzy białkami.
Elektroforeza zachodzi najefektywniej, gdy objętość próbki nakładanej na żel nie przekracza 10% objętości ścieżki, a ilość białek nakładanych na studzienkę znajduje się w pzredziale od 1 do 50 µg. Ważne jest również, by próbka nie zawierała zbyt dużych ilości soli wystęujących w postaci zjonizowanje, ponieważ powodują one powstawanie smug na żelu podczas rozdziału oraz niejednorodność prążków[9].
Przygotowanie próbek do elektroforezy:
Bufor do próbek (2 x stężony) - przepis wg mercka(hefera):
- 0,5 M TRIS-HCl o pH 6,8 (stężenie końcowe 0,125 M)
- 4% SDS (siarczan dodecylu sodu)
- 20 %glicerol
- bromofenol blue (dodawać kroplami do uzyskania odpowiedniego granatowego koloru)
Bufor do elektroforezy (5x stężony) :
- 25mM Tris
- 192 mM glicyna
- 0.1% SDS (pH 8.3)
Wykonanie:
Badane białko (1ng-50µg) zawiesić w buforze do próbek. Docelową objętość jaka ma być nałożona na studzienkę (około 10-30 µl) należy podzielić na pół: jedną połowę stanowi bufor do próbek (stężony 2x), a drugą badana próbka rozcieńczona w odpowiedniej ilości wody, lub buforu do elektroforezy.
Tak otrzymane próbki należy zredukować, dodając w tym celu 1% merkaptoetanol lub DTT. Redukcję próbek prowadzić przez 5 minut w temperaturze 100°C. Bezpośrednio przed naniesieniem próbek na żel, należy je odwirować celem usunięcia wszystkich nierozpuszczonych składników. Tak przygotowane próbki można nanieść na studzienki w żelu poliakryloamidowym.
Rozdział elektroforetyczny prowadzić w buforze do elektroforezy poczatkowo przy napięciu 80V -20 minut (mniejsze napięcie ma na celu wyrównanie ładunków w żelu oraz wolniejszą migrację białek w żelu zbierającym), a następnie przy zwiększonym napięciu (150 V przez ok. 50 minut) [9].
Elektroforeza nieciągła
Prowadzi do jeszcze lepszych rezultatów rozdziału (separacji) białek, a dodatkowo otrzymuje się bardzo ostre prążki, które zawierają białka charakteryzujące się taką samą ruchliwością elektroforetyczną (często interpretowane jako białka o tej samej masie cząsteczkowej) [7].
Przygotowanie żelu poliakrylamidowego do rozdziału białek
Żele polakrylamidowe przygotowywane są z roztworu monomerów akryloamidu oraz z substancji sieciujących określanych często jako cross-linkers. Substancją sieciującą najczęściej jest N,N’-metylenobisakryloamid (bisakryloamid). APS (nadsiarczan amonu) stosuje się do zainicjowania chemicznej polimeryzacji żelu , będącą reakcją wolnorodnikową. Reakcja ta zachodzi w obecności katalizatora, którym najczęściej jest TEMED (N,N,N’,N’-tetrametyloetylenodiamina) [2], [3], [5].
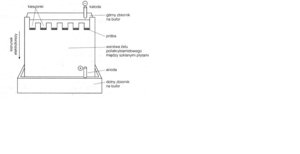
Zdjęcie: Elektroforeza w żelu poliakryloamidowym, [6].
Wykananie:
Żel poliakrylamiodowy przygotowuje się (wylewa) dwustopniowo: jako pierwszy przygotowuje się żel rozdzielający o procentowości zależnej od wielkości rozdzielanych cząsteczek. W żelu rozdzielającym zachodzi właściwy rozdział białek.
Na wylany żel rozdzielający nanosi się izobutanol (w celu usunięcia ewentualnych pęcherzyków powietrza ). Dodatkowo izobutanol zapobiega dostępowi powietrza, który utrudnia proces polimeryzacji żelu (polimeryzacja trwa od 30 do 120 minut). Po upływie czasu polimeryzacji, należy wypłukać izobutanol z góry żelu , po czym delikatnie osuszyć go bibułą, nie dopuszczając tym samym do przesuszenia górnej warstwy żelu. Następnie, wylewa się żel górny ( 4% ), który jest tzw. żelem zagęszczającym ( w tym żelu umieszcza się grzebień w celu powstania tzw. studzienek) [2], [3], [5], [9].
Przygotowanie żelu rozdzielającego i zagęszczającego [9].
W skłąd buforu do elektroforezy wchodzi Tris-glicyna o pH=8.3, żel rozdzielający zawiera Tris-HCl ( o pH=8.8), zaś żel zatężający Tris-HCl o niższym pH= 6.8 . Wyższe pH w żelu rozdzielającym powoduje jonizację glicyny, w związku zczym podczas rozdziału migruje ona tuż za jonami chlorkowymi [1].
Przygotowanie żelu:
Odczynniki:
- mieszanina monomerów: akrylamid – bisakryloamid (37,5 / 1) 30%
- 10% SDS
- 10% nadsiarczan amonu (APS)
- TEMED
- 1.5 M Tris o pH= 8.0
- 1M tris o pH= 6.8
- 5x stężony bufor do elektroforezy
Na początku należy przygotować odpowiednią ilość roztworu żelu rozdzielającego ( o odpowiedniej procentowości). Przygotowany roztwór należy wlać pomiędzy dwie szklane płytki przedzielone przekładkami i połączone klamerkami, pozostawiając odpowiednią ilość miejsca, w celu późniejszego wylania żelu zatężającego, oraz włożenia grzebienia (studzienki w żelu) [1].
Po wylaniu, roztwór żelu trzeba bardzo ostrożnie zalać wodą lub alkoholem izoamylowym, i tak przygotowany żel pozostawić do polimeryzacji (na ok. 30 minut). PO upływie czasu polimeryzacji, zlać roztwór znad żelu, po czym żel przepłukać wodą (w celu usunięcia resztek nie spolimeryzowanego akryloamidu). Kolejnym krokiem jest przygotowanie roztworu żelu zatężającego. Roztwór ten należy bezpośrednio wylać na żel rozdzielający, a następnie (delikatnie) wsunąć grzebień- uważając by nie powstały pęcherzyki powietrza, które przeaszkadzają podczas rozdziału elektroforetycznego[1].
Ponownie pozostawić żel do polimeryzacji (ok. 30 minut). Gdy żel spolimeryzuje delikatnie usunąć grzebień i przepłukać kieszonki wodą dejonizowaną, żeby usunąć resztki niespolimeryzowanego akryloamidu (jak wyżej).
Tak przygotowany żel poliakryloamidowymieścić umieścić w aparacie do elektroforezy i zalać 5x stężonym buforem do elektroforezy (tj.: 125mM Tris, 1.25M glicyna (pH 8.3), 0.5% SDS) [1].
Przygotowanie próbek do rozdziału elektroforetycznego:
Badane próbki należy zawiesić w buforze Leammeliego (tj.: 0.065M Tris-HCl, 2% SDS, 5% b -merkaptoetanol (pH 6.8), 0.01 % błękit bromofenolowy, 5% glicerol). Następnie, inkubować je przez 3 minuty w 100C w celu denaturacji białek. Po denaturacji próbki można nakładać na żel [1].
Warunki rozdziału elektroforetycznego:
Elektroforezę najlepiej prowadzić przy napięciu ok. 15 V na centymetr długości żelu (do momentu, kiedy barwnik dojdzie do dolnej krawędzi żelu) [1].
Autor: Lidia Koperwas
Literatura:
[1]. Zakład Genetyki Uniwersytetu Warszawskiego, Genetyka molekularna- materiały do zajęć laboratoryjnych, Warszawa 2003. Skrypt przygotowany przez pracowników Zakładu Genetyki UW.s. 41-42]
[2]. Słomski R, 2008. Analiza DNA, teoria I praktyka. Wydawnictwo Uniwersytetu Przyrodniczego w Poznaniu, Poznań 2008. s. 72-73]
[3]. Rickwood D., Hames B.D., 1982. Gel electrophoresis of nucleic acids: a practical approach. IRL. Press Limited, Oxford.
[4]. Walkowiak B., Kochmańska V. Elektroforeza- przykłady zastosowań. Opracowanie zbiorowe. www.p.lodz.pl/biofizyka/elektroforeza.pdf
[5]. Westermeier R., 1993. Electrophoresis in practice. A guide to theory and practice. VCH Verlagsgeselschaft mbH, Weinheim.
[6]. Hames D.B., Hooper N.M., 2009. Biochemia-krótkie wykłady. Wydawnictwo Naukowe PWN, s. 68-71
[7]. http://microbio.gumed.edu.pl/materialy/biol_mol/Elektroforeza.pdf
[8]. http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=3423265
[9]. http://metlab.pl/Elektroforetyczny_rozdzial_bialek_p34.html
wstecz
Podziel się ze znajomymi


Recenzje