Wstęp:
Inżynieria biomedyczna jest interdyscyplinarną dziedziną wiedzy, na która składają się nauki techniczne, biologiczne oraz medyczne. Uważana jest za siłę napędową współczesnej medycyny. Główne zagadnienia jakie obejmuje to: informatyka medyczna, obrazowanie i przetwarzanie obrazów medycznych, elektronika medyczna, biomechanika, biomateriały, modelowanie procesów fizjologicznych, telemedycyna. Głównym celem inżynierii biomedycznej jest ciągły rozwój wszelkich technik medycznych [1]. Ponieważ obszar na jaki roztacza się inżynieria biomedyczna jest bardzo szeroki, konieczna jest ciągła współpraca specjalistów zajmujących się elektroniką i aparaturą medyczną, biomechaniką czy też biomateriałami. Inżynieria biomedyczna wszystkie swoje działania koncentruje na człowieku. Ciągłe ulepszanie sprzętu medycznego, wytwarzanie nowych materiałów dla potrzeb inżynierii regeneracyjnej, coraz bardziej zaawansowane techniki obrazowania wnętrza ludzkiego ciała i wiele innych pionierskich rozwiązań stosowanych jest po to, aby lepiej i skuteczniej leczyć. Wszelkie innowacje w technikach medycznych mogą przynosić ulgę w cierpieniu, skracać czas rekonwalescencji, czy też najzwyczajniej poprawiać komfort szpitalnego życia. Inżynieria biomedyczna jest dziedziną rozwijająca się bardzo dynamicznie. Obecnie czterema jej głównymi pod kategoriami są: biomechanika, elektronika i informatyka medyczna, bioinformatyka oraz inżynieria biomateriałów. Dziś uwaga zostanie skupiona na inżynierii materiałowej [4].
Inżynieria biomedyczna dzieli się na następujące działy: [3]
a) Informatyka i aparatura medyczna - informatyka i aparatura medyczna kładzie szczególnie nacisk na techniki teleinformatyczne, biocybernetykę, a także elektronikę dla urządzeń medycznych oraz sztucznych narządów. Zajmuje się ona projektowaniem sprzętu medycznego, poprawą parametrów dostępnych już urządzeń oraz systemów obrazowej diagnostyki medycznej, takich jak: CT, MRI, PET, EEG, EKG, USG.
b) Biomechanika - to przede wszystkim nauka o mechanizmach stosowanych w medycynie, rozwiązaniach konstrukcyjnych stosowanych w diagnostyce i terapii oraz budowie sztucznych narządów. Tak więc zajmuje się telechirurgią i robotyką medyczną, konstrukcją układów biomechanicznych z uwzględnieniem właściwości mechanicznych tkanek oraz anatomii połączeń stawowych. Jest to także dział zajmujący się bioniką, czyli nauką szukającą podobieństw pomiędzy.
c) Biomateriały - dotyczy wytwarzania i badania materiałów biozgodnych, przeznaczonych na implanty i sztuczne narządy. Zajmuje się wytwarzaniem nowych, biofunkcyjnych materiałów oraz klasyfikacją istniejących materiałów medycznych. W kręgu jej zainteresowań jest także inżynieria tkankowa i genetyczna pozwalająca na stworzenie implantów hybrydowych.
1. Czym są biomateriały?
1.1. Biomateriały są trójwymiarowymi, porowatymi i biokompatybilnymi strukturami, zwykle o charakterze polimerów, które odgrywają zarówno mechaniczną, jak i funkcjonalną rolę w stymulacji komórek macierzystych do odtwarzania tkanki. Wykorzystuje się je w inżynierii tkankowej w celu produkcji implantów mogących zastąpić organy utracone lub uszkodzone wskutek urazu, choroby nowotworowej czy genetycznej. Ich różnorodność i mnogie możliwości zastosowania – od przeszczepów skóry po bardziej skomplikowane narządy takie jak serce, sytuuje je w ścisłym centrum zainteresowania badań biomedycznych. [4]W 1987 roku w trakcie Konferencji Europejskiego Towarzystwa Biomateriałów grupa ekspertów zdefiniowała biomateriały jako abiotyczne materiały, wykorzystywane w charakterze urządzeń medycznych, które w założeniu mają wchodzić w interakcję z systemami biologicznymi. Ta definicja odzwierciedlała ówczesny stan rzeczy, kiedy to naukowcy stawiali sobie za zadanie opracowanie powłok zmniejszających ryzyko odrzucenia mechanicznych implantów. Od tego czasu dokonał się w tej dziedzinie ogromny postęp, umożliwiający przeszczepianie narządów niemal w całości składających się z biomacierzy [1]. Te osiągnięcia nabierają dużego znaczenia w obliczu coraz bardziej realnej wizji medycyny regeneracyjnej. Ideałem leczenia ubytków tkanki, zarówno dla lekarza jak i pacjenta, byłoby uzupełnianie komórek za pomocą zwykłego wstrzyknięcia, jednak jest to możliwe w bardzo niewielu przypadkach (choroby hematopoetyczne, choroby naczyń, niedobory substancji, np. insuliny). Większość narządów ma swoją szczególną trójwymiarową organizację i potrzebuje stałego podłoża do uformowania narządu z komórek. Stelaż stanowiący takie podłoże nazywany jest rusztowaniem, matrycą lub sztuczną macierzą zewnątrzkomórkową. Pełni tę samą funkcję, co naturalna macierz: wspomaga proliferację, różnicowanie i biosyntezę komórek, zapobiega także napływowi komórek z sąsiednich tkanek i substancji produkowanych przez fibroblasty masowo kolonizujące ubytek (ich obecność utrudnia regenerację narządu). Biomateriały nie tylko stanowią podporę, ale i aktywnie wspomagają regenerację tkanek. Marzeniem każdego inżyniera tkankowego jest stworzenie takiej biomacierzy, która zapewniałaby środowisko o organizacji i właściwościach mechanicznych podobnych do tych cechujących prawdziwą tkankę, udostępniając powierzchnię, do której mogą przylgnąć komórki i która jest także biokompatybilna, czyli integruje z otaczającą tkanką, wspomaga regenerację, a produkty jej degradacji nie powodują efektu toksycznego. Im dogłębniej poznajemy tajniki ECM, tym lepsze biomimetyczne materiały jesteśmy w stanie wymyśleć. Rola ECM w proliferacji, migracji i polaryzacji komórek jest przeogromna, dlatego biomateriał to komponent równie ważny co czynniki sygnalizacyjne i komórki macierzyste [3].
Pierwsze próby [2]:
a) materiały metaliczne:
• Rogers rok 1827 - zespolenie kości w postaci ściegu
• Listers rok 1877 - zespolenie kości za pomocą trzpieni srebrnych / zwrócił uwagę na septyczność implantów
• Hausman rok 1886 - po raz pierwszy użyto płytki ze srebra i mosiądzu, które połączono z kością przy pomocy śrub
• bracia Lambotte rok 1907 - po raz pierwszy zwrócono uwagę na problem wchłaniania metalu do kości tzw. metalozy
• Sherman rok 1912 – udoskonalanie konstrukcji aatabilizatora poprzez wprowadzenie płytek z aapoprzecznym wyżłobieniem ze stali aawanadowej
b) klejenie kości
• Hedri 1931 leczenie złamań i stawów rzekomych klejem „Ossocol”
• Żywice epoksydowe Pierwsze próby Golowin (ZSRR) 1956
• Osteoplast – zywica epoksydowa+mąka kostna+ proszek fibrynowy
• Żywice metakrylowe Hulliger 1962
• Palacos – szybko twardniejące tworzywo termoplastyczne
1.2. Właściwości fizyczne i chemiczne.
Dobry biomateriał, który wzorowo spisze się w roli zastępczej macierzy zewnątrzkomórkowej, musi sprostać nielichym wymaganiom. Powinien przede wszystkim charakteryzować się odpowiednią porowatością, co oznacza, że w jego wnętrzu znajdą się skomunikowane ze sobą mikropory, które zostaną zasiedlone przez komórki. Jednocześnie komórki powinny mieć swobodę migracji, namnażania się i łatwy dostęp do składników odżywczych oraz możliwość odprowadzania ubocznych produktów metabolizmu. Należy pamiętać, że struktura matrycy nie może być również zbyt „gąbczasta” i musi przy tym zachować doskonałą wytrzymałość mechaniczną. Drugą krytyczną dla regeneracji tkanki kwestią jest kinetyka absorpcyjna materiału. Dla przykładu, jeśli regeneracji ulega kość, czyli dość mozolnie odtwarzająca się tkanka, to czas degradacji macierzy powinien być relatywnie długi, aby utrzymać tkankę do momentu aż będzie kompletnie uformowana. Za to w przypadku skóry nie ma potrzeby, by matryca pozostawała w organizmie dłużej niż miesiąc. Zbędny materiał, nie mogąc ustąpić miejsca odtwarzającej się tkance, prawdopodobnie tylko zahamuje procesy regeneracyjne [3,4].
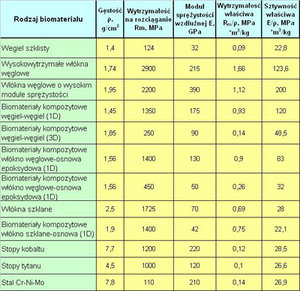
Tab. Właściwości przykładowych biomateriałów [4].
1.3. Właściwości charakteryzujące biomateriały: [3]
• fizyczne (gęstość, lepkość, przewodność cieplna i elektryczna)
• mechaniczne (wytrzymałość, sprężystość, odporność zmęczeniowa)
• technologiczne (obrabialność, kształtowanie powierzchni)
• odporność korozyjna
• biologiczne (biozgodność, biotolerancja)
• finansowe (możliwe do przyjęcia koszty wytwarzania)
1.4. Przy doborze materiałów bierze się zaś pod uwagę: [3]
• biozgodność oraz biotolerancję dla danego osobnika
• własności mechaniczne i wytrzymałościowe
• stopień kontaktu z ciałem ludzkim (stopień inwazyjności)
• oddawanie energii lub substancji do ciała lub na ciało
• okres zastosowania
• możliwości wykonawcze
• ekonomiczność rozwiązania
1.5. Jakie substancje mogą być wykorzystywane jako biomatryce?
Biomateriały tworzą substancje pochodzenia naturalnego, są to różnego rodzaju białka, peptydy, polisacharydy, ale i syntetycznego, jak polimery, ceramiki, metale i ich kompozyty. Przeważnie przygotowywane są w formie trójwymiarowej, ponieważ najlepiej oddaje ona architekturę naturalnej, zdrowej tkanki. Oczywiście optymalnie tolerowane przez organizm są peptydy, tj. wszechobecny w wielu tkankach kolagen, czy fibryna – biorąca udział w tworzeniu skrzepów. Na uwagę zasługuje również produkowany przez owady jedwab, charakteryzujący się znacznie lepszą wytrzymałością mechaniczną i przedłużonym czasem trwałości. Obok matryc peptydowych, innymi polimerami tworzącymi sztuczne, ale jednocześnie dość „przyjazne” ECM są polisacharydy. Łatwo przeprowadzić je w stan żelu, co ułatwia podanie do rany. Wśród tych najczęściej używanych polisacharydów znajdują się agaroza, alginian, hialuronian i chitosan. Alginian nie posiada żadnego wiązania ulegającego hydrolizie, a mimo to jest używany jako materiał wchłanialny. Dzieje się tak dlatego, że alginian wapnia nie rozpuszcza się w wodzie, ale w organizmie jony wapnia są stopniowo zastępowane jonami sodu. Powstający w tym procesie nowy związek doskonale rozpuszcza się w wodzie, tak więc implant przygotowany na bazie tej substancji niemal znika bez śladu.
Do produkcji biomateriałów bardzo powszechnie wykorzystywane są również polimery syntetyczne – polihydroksykwasy, zwłaszcza poliglikolid (PGA) i polimery kwasu mlekowego. Ich największą zaletą jest możliwość uzyskania powtarzalności, dzięki ściśle określonemu składowi chemicznemu. Także kontrolowania właściwości mechanicznych, kształtu oraz stopnia degradacji. Niemniej jednak często nie posiadają miejsc adhezji komórek macierzystych i wymagają z tego powodu dodatkowej modyfikacji. Nie są również biokompatybilne w równym stopniu, co macierze peptydowe, a produkty ich rozkładu mogą wywoływać odpowiedź układu odpornościowego. PGA i jego kopolimery, tj. mleczanowo-glikolidowy (PLGA) degradują zbyt szybko, ich wytrzymałość zmniejsza się o połowę już w czasie dwóch tygodni. Z kolei zaś polimleczany (PLLA) degradują zbyt wolno – od 3 do 6 lat. Coraz częściej więc wykorzystuje się ich kompozyty, np. ϵ-kaprolaktam mleczanu, odznaczający się pośrednią trwałością około 6 miesięcy. W bardziej wymagających zadaniach sprawdzą się ceramiki – nieorganiczne materiały o strukturze krystalicznej, porowatej i dość kruchej. Do najczęściej wykorzystywanych ceramik należą szkło bioaktywne, ortofosforan triwapnia (TCP) i hydroksyapatyt. Skład chemiczny szkła bioaktywnego sprawia, że powierzchnia materiału jest zdolna wchodzić w interakcję z żywą tkanką. Hydroksyapatyt zaś to ceramika naturalnie występująca w kościach, biokompatybilna i niezwykle wytrzymała. Często rusztowania nieorganiczne są wykorzystywane w połączeniu z polimerowymi, szczególnie jeśli chodzi o inżynierię tkankową kośćca. Te nieorganiczne substancje z uwagi na swoją kruchość, dopiero w komitywie z miękkimi polimerami dają solidny stelaż, który utrzymuje wysoką aktywność biologiczną [8].
Istnieje wiele technik formowania rusztowań polimerów. Wśród nich możemy wymienić np. przędzenie, spiekanie, wytłaczanie. Ale tak naprawdę w procesie produkcji trójwymiarowych macierzy ważnym etapem jest utworzenie porów wewnątrz materiału przez selektywne wypłukiwanie cząsteczek, rozdział faz lub metody wykorzystujące powstawanie pęcherzyków gazu. Materiał powinien mieć także odpowiednią teksturę, ponieważ kształt implantu wpływa na fizjologiczną reakcję organizmu, w tym adhezję komórek, ich proliferację i różnicowanie. Odpowiednia powierzchnia powstaje wskutek fałdowania, splatania i cięcia. Gotowe macierze przyjmują formę pianek, gąbek, żeli oraz hydrożeli z zawartymi w nich cząsteczkami sygnalizacyjnymi i ewentualnie komórkami macierzystymi. Żele i hydrożele są najbardziej znaczącymi biomateriałami [5]. Pozwalają na enkapsulację komórek, np. w celu produkcji zastępczej chrząstki lub ochrony komórek przed atakiem układu immunologicznego. Wadą takich matryc jest niemożliwość kontrolowania procesu ich samoorganizowania, co utrudnia uzyskanie odpowiedniej geometrii oraz kinetyki degradacji. Sprawia to kłopot przy przewidywaniu ich trwałości. Hydrożele produkuje się zarówno z niedegradowalnych polimerów, jak poliestry, poliamidy, jak i wchłanianych materiałów opartych na kolagenie, kwasie glikolowym, mlekowym, hialuronowym. Często też powstają półsyntetyczne pochodne. W ciągu ostatnich dwóch dekad opracowano wiele nowoczesnych metod produkcji biomatryc, w tym elektrospinning i różne wyszukane metody prototypowe (drukowanie matryc, FDM, SLS i SLA). Szybkie metody prototypowe ułatwiają precyzyjne tworzenie porów, doskonale spełniających swoje zadanie. Ciekawym kierunkiem rozwoju inżynierii tkankowej jest drukowanie organów, ale i drukowanie matryc. Opracowano metody drukowania matrycy, umożliwiające pozycjonowanie komórek, dzięki odpowiedniemu rozmieszczeniu kolagenu. Inną techniką “drukowania” jest bioelektrospray, wykorzystany do rozmieszczania komórek prekursorowych w spontanicznie utworzonych rusztowaniach. Inną możliwością uzyskania biomatryc są organy, z których usunięto komórki, dzięki czemu nie zawierają one żadnych antygenów, są immunokompatybilne, np. powszechnie stosuje się je w przypadku przeszczepów skóry i woreczka żółciowego. Niestety, trudno tego dokonać dla większych i bardziej skomplikowanych narządów, takich jak serce [8].
1.6. Rekonstrukcja tkanki.
Tkankę można rekonstruować in vitro w bioreaktorze lub wszczepić konstrukt jako implant i pozwolić, by regeneracja zachodziła in vivo. Produkty inżynierii tkankowej powstające w bioreaktorach mogłyby być produkowane komercyjnie na większą skalę jako potencjalne implanty allogeniczne dostarczane palcówkom służby zdrowia w zależności od potrzeb, niemal na zamówienie. Terapia in vivo jest natomiast bardziej zindywidualizowaną strategią – pacjent otrzymuje przeszczep na bazie jego własnych komórek, opracowany wyłącznie z myślą o nim [7]. Problemem, dotyczącym szczególnie dużych narządów, jest ciągle kwestia ukrwienia implantu. W warunkach in vitro trudniej zaindukować proces neowaskularyzacji, ponieważ składniki odżywcze są podawane w sposób sztuczny i często mają ograniczone możliwości dyfuzji. Większe szanse na utworzenie nowych naczyń mają transplanty regenerujące się w organizmie pacjenta, gdyż komórki napływające z ciała same zasiedlają macierz [7,8].
2. Rodzaje materiałów biomedycznych [4].
Materiały biomedyczne muszą wykazywać się wymaganą biokompatybilnością (biotolerancją), czyli zgodnością biologiczną i harmonią interakcji z żywą materią. Wymagana biotolerancja materiału daje pewność, że po wprowadzeniu go do organizmu nie wywoła on żadnych reakcji ani stanów zapalnych z otaczającymi go tkankami.
2.1. Biomateriały metalowe
Pierwszą wzmiankę w literaturze o zastosowaniu implantatu metalowego w chirurgii kostnej można znaleźć w pracy Petroniusa, który w 1565 r. przykrył wadę podniebienia złotą płytką. Jednak dopiero w 20 wieku panowie Menegaux i Odietta zwrócili uwagę na właściwy dobór składu chemicznego implantowanych stopów, co wpłynęło na bardziej szczegółowy ich dobór, a co za tym idzie wyraźną poprawę ich biotolerancji. Przypatrując się historycznemu rozwojowi tworzyw metalicznych stosowanych na implanty można stwierdzić, że próbowano stosować praktycznie większość metali i stopów, które cechowały się dobrą odpornością na korozję oraz odpowiednimi własnościami mechanicznymi. Wieloletnie doświadczenia kliniczne dały możliwość oceny ich przydatności użytkowej, na podstawie której wytypowano ostatecznie te metale i stopy, które mogą być z zadowalającym bezpieczeństwem stosowane w praktyce chirurgicznej.
Są to:
• stale Cr-Ni-Mo, o strukturze austenitycznej
• tytan i jego stopy
• stopy na osnowie kobaltu
• tantal, niob i ich stopy
• metale szlachetne
Szczególną grupę biomateriałów metalowych stanowią ponadto stopy z pamięcią kształtu , których szczególne właściwości związane są z odwracalnością przemiany martenzytycznej. Przemiana ta polega na powtórnej przemianie martenzytu w fazę macierzystą (austenit) podczas nagrzewania.
Metale i stopy przeznaczone na implanty powinny wykazywać:
• odpowiednie własności mechaniczne
• dobrą odporność na korozję
• dobrą jakość metalurgiczną i jednorodność
• odporność na zużycie ścierne
• brak tendencji do tworzenia zakrzepów
• odpowiednie własności elektryczne
• możliwe do przyjęcia koszty wytwarzania
• zgodność tkankową – nietoksyczność i niewywoływanie odczynów alergicznych
2.2. Biomateriały ceramiczne
Materiały bioceramiczne muszą mieć określony zespół własności użytkowych, które nie są identyczne z własnościami tworzyw metalicznych. Przypatrując się historycznemu rozwojowi tworzyw metalicznych stosowanych na implanty można stwierdzić, że próbowano stosować praktycznie większość metali i stopów, które cechowały się dobrą odpornością na korozję oraz odpowiednimi własnościami mechanicznymi. Wieloletnie doświadczenia kliniczne dały możliwość oceny ich przydatności użytkowej, na podstawie której wytypowano ostatecznie te metale i stopy, które mogą być z zadowalającym bezpieczeństwem stosowane w praktyce chirurgicznej.
Do odmiennych własności bioceramiki od biomateriałów metalowych, można zaliczyć:
• większą biotolerancję
• większą odporność na ścieranie oraz wytrzymałość na ściskanie
• porowatość, umożliwiającą wrastanie tkanek i trwalsze połączenie tkanek z implantami
• większą odporność korozyjną w środowisku tkanek i płynów ustrojowych
Z badań wynika, że materiały ceramiczne są tworzywami kruchymi o małej wytrzymałości na zginanie. Są nieodporne na obciążenia dynamiczne i nie wykazują odkształcalności. Największą zaletą materiałów bioceramicznych jest fakt, że przy odpowiedniej porowatości powierzchni wrasta w nie tkanka. Polega to na tym, że do porów o regulowanej wielkości wrastają unaczynione tkanki miękkie oraz kapilary z osteocytami. Na bazie takiego ceramicznego rusztowania rozwija się nowa regenerowana kość.
Wyróżnia się trzy kategorie materiałów bioceramicznych:
- materiały ceramiczne resorbowane w organizmie
-materiały z kontrolowaną reaktywnością powierzchniową
- biomateriały obojętne
2.3. Biomateriały węglowe.
Dzielimy je na:
• biomateriały kompozytowe
- włókna węglowe (carbon fibres)
-biomateriały kompozytowe węgiel-węgiel (carbon-carbon composite)
• warstwy węglowe
-diamentowe (DF - diamond films), zawierające diament nanokrystaliczny, tetraedryczny i amorficzny o rozmiarach ziarn nieprzekraczających kilkudziesięciu nanometrów
-diamentopodobne (DLC - diamond-like carbon), które są mieszaniną amorficznego i nanokrystalicznego węgla z przeważającym udziałem diamentu o sieci romboedrycznej lub regularnej.
Biomateriały węglowe mają duże znaczenie w chirurgii, gdyż cechują się:
• dobrą biotolerancją
• dobrymi własnościami fizykochemicznymi
• odpornością na promieniowanie jonizujące i niejonizujące
• atrombogennością (własność materiału eliminująca powstawanie skrzepów) i dobrą hemozgodnością (biozgodnością z krwią). Włókna węglowe, biomateriały kompozytowe wzmacniane włóknami węglowymi o osnowie węglowej i węgiel szklisty cechują się dobrą biotolerancją i charakteryzują się korzystnym zespołem własności mechanicznych (tabl.).
2.4. Biomateriały polimerowe
Tworzywa sztuczne w chirurgii narządu ruchu mają długą historię sięgającą lat trzydziestych obecnego stulecia. Zastosowanie tworzyw sztucznych w chirurgii wiąże się z próbami stosowania ich także w innych dziedzinach medycyny. O przydatności poszczególnych grup czy gatunków tworzyw zdecydowała ostatecznie weryfikacja użytkowa i praktyka kliniczna. Polimery to substancje złożone z makrocząsteczek charakteryzujących się regularnym lub nieregularnym cyklicznym rozmieszczeniu jednostek podstawowych (merów) jednego lub kilku rodzajów.
Powinny mieć następujące cechy:
• łatwość uzyskiwania powtarzalnej jakości materiału dla różnych partii wyrobów
• łatwość formowania, pozwalająca kształtować odmienną postać użytkową wyrobów bez degradacji tworzywa
• łatwość sterylizacji bez zmian własności lub kształtu
• odpowiednią jakość fizykochemiczną tworzywa i wyrobów finalnych
• nieinicjowanie odczynów toksycznych lub alergicznych
• biotolerancję w środowisku tkankowym
• odpowiednią trwałość funkcjonalną i niezawodność
W odniesieniu do zastosowań medycznych można je podzielić na naturalne i sztuczne. Polimery naturalne wytworzone zostały w organizmach żywych jako składniki strukturalne tkanek. Do nich zaliczyć można białka (kolagen, fibrynogen, jedwab, wszczepy tkankowe) i wielocukry (celuloza, chityna). Polimery sztuczne można podzielić na: silikony, politetrafluoroetylen, poliuretany, polietylen, polipropylen, politereftalen etylenu, polimetakrylan metylu, poliamidy. Przydatność do implantacji określonego polimeru syntetycznego jest uwarunkowana budową głównego związku wielocząsteczkowego, oraz zależeć będzie od udziału i rozmieszczenia w nim związków pomocniczych, do których można zaliczyć: napełniacze, plastyfikatory, pigmenty i barwniki, stabilizatory, środki smarujące, pofory, czy też szczególne środki pomocnicze, jak np. antystatyczne, atrobogenne i inne.
2.5. Implanty
2.5.1. Implantami nazywamy wszelkie przyrządy medyczne wykonane z jednego lub więcej biomateriałów, które mogą być umieszczone wewnątrz organizmu, jak również umieszczone częściowo lub całkowicie pod powierzchnią nabłonka, i które mogą pozostać przez dłuższy okres w organizmie. Zapotrzebowanie na implanty jest związane ze znacznym postępem i rozwojem różnych dziedzin chirurgii rekonstrukcyjnej i zabiegowej oraz protetyki.
Można wyróżnić:
• implanty chirurgiczne (umieszczane w zamierzonym miejscu w organizmie metodami chirurgicznymi)
• inne implanty (przykładowo igły, dreny, sączki)
• protezy implantowane (protezy wewnętrzne lub endoprotezy fizycznie zastępujące organ lub tkankę)
• sztuczne organy (zastępujące w całości lub częściowo funkcję jednego z głównych organów, często w sposób nie anatomiczny)
2.5.2. Ze względu na dziedziny medycznego zastosowania lub konkretnego umiejscowienia w organizmie wyróżniamy implanty:
• ortopedyczne - stosowane by wspomóc, zastąpić lub uzupełnić tymczasowo lub na stałe kość, chrząstkę, więzadła, ścięgna lub powiązane z nimi tkanki,
• ustne - stosowane w celu poprawy, zwiększenia lub zastąpienia jakiejkolwiek twardej lub miękkiej tkanki w jamie ustnej, obejmujące szczękę, żuchwę lub staw skroniowo-żuchwowy
• czaszkowo-twarzowe - stosowane w celu poprawienia lub zastąpienia tkanek twardych lub miękkich w obszarze czaszkowo-twarzowym z wyjątkiem mózgu, oczu i ucha wewnętrznego
• dentystyczne - stosowane do uzupełniania ubytków zębów
2.5.3. Przykładowe zastosowania implantów - implanty w leczeniu schorzeń kręgosłupa.
Kręgosłup, ze względu na funkcje jakie pełni w organizmie, jest niezbędnym narządem do prawidłowego funkcjonowania człowieka. Pomimo iż jest dobrze chroniony przez tkankę mięśniową jak i tłuszczową, często dochodzi do uszkodzenia (zarówno poprzez czynniki naturalne jak i losowe zdarzenia). Przywrócenie sprawności narządu stanowi często o życiu i śmieci człowieka. Istnieje wiele technik operacyjnych, które w większym lub mniejszym stopniu mogą się do tego przyczynić, jednak w ostatnich latach pojawiła się nowa grupa narzędzi chirurgicznych usprawniających proces leczenia i dająca nadzieję na powrót do zdrowia dla pacjentów. Są nimi implanty do leczenia schorzeń kręgosłupa [6].
a) Koszyk inaczej protezy trzonów kręgosłupa. Stosuje się je w momencie gdy konieczne jest usunięcie trzonu (np. z powodu nowotworu) i zastąpienie sztucznym elementem. W ten sposób pełnią one także funkcje wspierania przedniej kolumny kręgosłupa. Mają postać cylindrycznej, perforowanej siatki. Swoją nazwę zawdzięczają temu iż wypełnione są przeszczepami kostnymi, bądź też innymi materiałami (np. cementami kostnymi), których głównym zadaniem jest zapełnienie ubytku. Wyróżnia się dwa podstawowe typy koszyków: Koszyk stały - cylindryczna tuleja, która dzięki otworom umiejscowionym na ścianach umożliwiają przerosty kostne oraz koszyk rozsuwany - posiada śrubowy mechanizm rozsuwania [1].
b) Sztuczny dysk - ze względu na ilość usuwanego materiału kostnego, możemy wyróżnić dwa typy implantacji: całkowite zastąpienie dysku oraz zastąpienie jądra dysku W pierwszym przypadku usuwany jest dysk całkowicie i na jego miejsce wstawiany implant (pomiędzy dwa sąsiednie kręgi), natomiast w drugim zastępuje się zaledwie środek implantu (jądro)[1].
c) Czopy międzytrzonowe -obecnie bardzo często spotykanym schorzeniem są bóle krzyża. W przypadku niektórych pacjentów wymagane jest leczenie operacyjne polegające na stabilizacji części lędźwiowej kręgosłupa. Spondylodeza międzytrzonowa polega głównie na odtwarzaniu i utrzymaniu wysokości przestrzeni międzykręgowej, a także na zwiększeniu pojemności kanału kręgowego i kanałów korzeniowych. Bardzo dużą rolę w leczeniu odgrywają więc czopy międzytrzonowe. Wyróżniamy następujące typy czopów: czopy cylindryczne, prostopadłościenne i rotacyjne (prostokątne). Najczęściej stosuje się gwintowane czopy cylindryczne. Ich zasadniczą zaletą przy stabilizacji międzytrzonowej jest mocne zagnieżdżenie w kości trzonów ze względu na gwintowaną powierzchnię. Czop wkręcany jest z dostępu operacyjnego tylnego za pomocą specjalnego instrumentarium przypominającego śrubokręt, wykonanego np. z PEEK lub stopu tytanu [1,3].
d) Śruby jako implanty kręgosłupa
- Śruby transpedikularne (przeznasadkowe).
Śruba transpedikularna składa się z następujących części: część gwintowana, tzw. kostna, która jest trwale osadzona w tkance kostnej kręgu o największej gęstości i wytrzymałości; część chwytowo-mocująca (łeb śruby), która umożliwia na połączenie śruby z innym instrumentarium stabilizacyjno-korekcyjnym, jak płytki czy pręty; oraz część pośrednia łącząca łeb z gwintem. Dodatkowo śruby repozycyjne i wyciągowe zaopatrzone są na końcu w odcinek gwintowy, który może posłużyć jako element wykonujący czynności repozycyjne.
-Śruby transpedikularne z rozszerzaną końcówką - celu zwiększenia stabilizacji śruby po osadzeniu w kości stosuje się rozszerzanie jej końca, co zwiększa wytrzymałość na siłę wyrywającą o 30%, a u pacjentów z osteoporozą nawet o 50 %, w porównaniu z innymi rozwiązaniami [1,6].
e) Implanty oparte na PEEK- pierwsze zastosowanie polimerów PAEK miało miejsce w 1990 roku, kiedy firma AcroMed z Cleveland wprowadziła na rynek czopy miedzytrzonowe wykonane z tego polimeru. Czopy zostały wykonane do stabilizacji wewnętrznej, lędźwiowej i szyjnej części kręgosłupa, przy leczeniu degeneracji dysków międzykręgowych. Początkowo ze względu na wymagania związane z implantacją, czopy tworzone były z tytanu przy czym ich konstrukcja zawierała liczne przerwy aby kość mogła przerastać implant. Pojawił się jednak spore problem. Pierwszy poległa na wysokiej sztywności tytanu, który wprowadzony pomiędzy kręgi powodował wysoką kumulację naprężeń. Drugi związany był z obrazowaniem medycznym pooperacyjnym. Ze względu na duży wskaźnik pochłaniania przez tytan promieniowania rentgenowskiego, nie można obserwować kolejnych stadium wrastania kości w implant. Dopiero wprowadzenie do produkcji czopów polimerów z PAEK pozwoliło na pozbycie się występujących problemów. Na sukces kliniczny i komercyjny nie trzeba było długo czekać. Czopy nazwane później czopami Brantigana zyskały ogromne uznanie wśród chirurgów, i doprowadziły do zwiększenie zainteresowania rodziną polimerów PAEK [1,6].
Badania dotyczące gęstości radiologicznej implantów wykonanych z PEEK i PEKEKK były przeprowadzane wielokrotnie. Wszystkie wykazały, że obrazowanie polimerowych implantów jest bardzo łatwe i pozwala na dokładne oglądanie fuzji kości z instrumentarium w warunkach in vivo. Jest tak ze względu na słabe pochłanianie promieniowanie rentgenowskiego przez polimery z rodziny PAEK, które określone jest z pomocą skali Hounsfielda. Dzięki temu cień implantu nie zasłania zrastającej się wewnątrz kości, a chore miejsce może być obrazowane za pomocą np. RTG lub CT . Jest to zaledwie niewielki przegląd implantów do leczenia kręgosłupa. Grupa ta nieustannie się powiększa, dając ludziom coraz to nowe i efektywniejsze techniki walki ze schorzeniami głównego rusztowania organizmu [6].
2.6. Nici chirurgiczne.
Są to implantacyjne wyroby medyczne cechujące się określonym zespołem własności fizykochemicznych, a mianowicie”
• dobrą biotolerancją
• łatwością sterylizacji
• możliwością wykonywania pewnego i niezawodnego wiązania
• ewentualnym bezodczynowym wgajaniem dla nici nieusuwalnych z tkanek
• własnościami fizykochemicznymi dostosowanymi do rodzaju zespalanych tkanek, okresu implantowania i techniki zespalania. Oznakowanie nici uwzględnia średnią minimalną i maksymalną oraz wytrzymałość na rozciąganie, odnoszoną do węzła chirurgicznego. Ocenia się także elastyczność nici rozumianą jako rozciągliwość podczas obciągania, bez trwałego wydłużenia, jak również poręczność, która obejmuje właściwości nici chirurgicznych, ujawniające się podczas ich użytkowania, np. łatwość przenikania przez tkanki, sztywność, gładkość, łatwość dociągania węzłów, stabilność, itp.
Wyróżniamy nici: roślinne, zwierzęce, z tkanek ludzkich, polimerowe, z tworzyw metalicznych [1].
2.7. Cementy kostne
Cementy kostne stosowane są w alloplastyce stawu biodrowego i kolanowego, ale wykorzystuje się je także do innych zabiegów rekonstrukcyjnych, np. do uzupełniania tkanki kostnej i wzmocnienia stabilizacji wewnętrznej. W skład chemiczny cementu wchodzi polimerowy proszek, najczęściej polimetakrylan metylu (PMMA) lub kopolimer metakrylanu metylu (MMA) ze styrenem lun akrylanem metylu. W skład proszku wchodzi dodatkowo inicjacji polimeryzacji. Składniki cementu kostnego poddawane są sterylizacji tlenkiem etylenu lub promieniowaniami jonizującymi przez ultrafiltrację cieczą. Do cementów kostnych dodawane są często antybiotyki, takie jak: gentamecyna, nebacetyna, erytromecyna z kolostyną, zwiększające septyczność zabiegu. Po zmieszaniu wymienionych substancji następuje spęcznienie polimeru i odparowanie rozpuszczalnika. W tym stadium lepka substancja przechodzi poprzez stan elastyczny w stan utwardzony. Proces utwardzenia jest niekorzystnie egzotermiczny. Ze względu na reakcje cytotoksyczne wywoływane takiego rodzaju cementem, trwają badania nad użytecznością cementów wapniowofosforanowych nowej generacji [1].
3. Biodrukarki 3D-całkowicie nowe spojrzenie na transplantologię.
Medycyna poszukując wciąż nowych rozwiązańgodnych XXI wieku, coraz odważniej czerpie pomysły z dorobku techniki. Tym razem okazało się, że technologia druku atramentowego zainspirowała naukowców do niezwykłych zastosowań. Już istnieją maszyny, dzięki którym wkrótce pacjenci nie będą musieli czekać na organy do przeszczepów. Pierwsza komercyjna drukarka organów została zbudowana przez firmę biomedyczną Invetech i dostarczona do Ogranovo, firmy pionierskiej w technologi biodruków. Drukarka obecnie jest w stanie produkować arterie, które lekarze będą mogli używać w operacjach wszczepiania bajpasów i to już za około pięć lat. Na inne, bardziej złożone części ludzkiego ciała, takie jak kości, serce, wątroba, trzeba będzie poczekać jeszcze dziesięć lat. Prócz nadziei na wielki przełom w medycynie, przez skrócenie czasu oczekiwania na nowy organ dla chorego, jest także ogromna szansa na wyeliminowanie odrzutów. Jeśli zastosować by własne komórki pacjenta do produkcji tkanek, zagrożenie nieprzyjęcia przez ciało przeszczepu byłoby znikome [7].
Podsumowanie.
Biomateriały stanowią grupę naturalnych i syntetycznych substancji, wykorzystywanych do tworzenia polimerycznych trójwymiarowych rusztowań, mających za zadanie wspomaganie różnicowania i proliferacji komórek macierzystych, a w efekcie regeneracji uszkodzonej tkanki. Sukcesywnie unowocześniane metody ich otrzymywania i modyfikacji przyspieszają badania, kończące się uzyskaniem funkcjonalnych narządów do przeszczepu, które mogą pokryć ogromne zapotrzebowanie na organy zastępcze i dać nadzieję na normalne życie pacjentom od lat czekającym na przeszczep.
Opracowała: Katarzyna Sowa-Lewandowska
Literatura:
1. A. Białas Medycyna Praktyczna, nr 6 (100) VI 1999 – Horyzonty medycyny
2. Ikada Y., 2006. Challenges in tissue engineering. Journal of the Royal Society, 3: 589-601.
3. J. Marciniak Biomateriały, Wyd. Politechniki Śląskiej, Gliwice 2002
4. M.Nałęcz, Biomateriały, tom 4, WKiŁ 1990 Warszawa
5. R. Będziński, Biomechanika inżynierska Zagadnienia wybrane, OWPWroc. Wrocław 1997
6. Rustad K.C., Sorkin M., Levi B., Longaker M.T., Gurtner G.C., 2010. Strategies for organ level tissue engineering. Organogenesis, 6: 151-157
7. Tabata Y., 2009. Biomaterial technology for tissue engineering applications. Journal of the Royal Society, 6: S311-S324.
8. Willerth S.M., Sakiyama-Elbert S. E., 2008. Combining stem cells and biomaterial scaffolds for constructing tissues and cell delivery. Stembook.org: 1-18.
wstecz
Podziel się ze znajomymi


Recenzje