

|
Zamknij X
|
Wstęp
Betulina należy do organicznych związków chemicznych z grupy triterpenów. Występuje w znacznych ilościach w białej korze brzozy. Wyizolował ją w 1788 roku Lowitz i jest to jedna z pierwszych substancji naturalnych uzyskanych z roślin. Betulina i jej pochodne charakteryzują się szerokim spektrum aktywności biologicznej przy małych stężeniach. Dodatkową cechą tych substancji, wyróżniających je, jako nowe, potencjalne preparaty lecznicze, jest brak toksyczności, zarówno w warunkach in vitro, jak i in vivo [1].
Charakterystyka betuliny i jej pochodnych
Betulina może być izolowana w małych ilościach z wielu gatunków roślin. Jej obecność stwierdzono między innymi w korze leszczyny (Corylus avellana), grabu (Carpinus betulus) i kilku gatunków olchy (Alnus). Na skalę przemysłową jest ona jednak pozyskiwana z dwóch gatunków, brzozy brodawkowatej (Betula verrucosa) i brzozy omszonej (Betula pubescens). Zawartość betuliny w korze brzozy może się wahaćod 10% do 30%. Betulina jest zlokalizowana w postaci krystalicznych skupisk w warstwie korowej wdużych cienkościennych komórkach powstających na wiosnę. Białe zabarwienie kory brzóz pochodzi od betuliny wypełniającej wnętrze komórek perydermy [2].
Betulinę można wyizolować zkory brzozowej metodą sublimacji na drodze ekstrakcji rozpuszczalnikami organicznymi (dichlorometan, chloroform, aceton) ikrystalizację z odpowiednich rozpuszczalników. Występuje ona w korze brzozy razem ztowarzyszącymi jej w śladowych ilościach lupeolem, kwasem betulinowym, aldehydembetulinowym i allobetuliną [3].
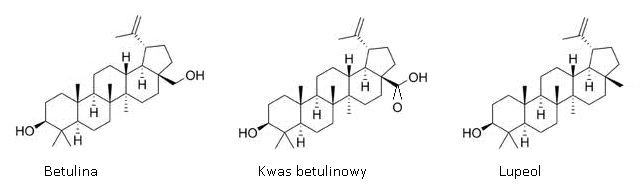
Rys.1. Wzory strukturalne betuliny oraz jej pochodnych.
Kwas betulinowy jest karboksylową pochodną betuliny. Naturalnie występuje on w śladowych ilościach w korze brzozy oraz w innych roślinach. Główne źródło pozyskiwania kwasu betulinowego stanowi kosztowna synteza chemiczna. Metoda ta polega na utlenieniu betuliny odczynnikiem Jonesa (Na2Cr207, H2SO4 w acetonie, w temperaturze bliskiej 0°C), a następnie redukcji uzyskanego kwasu betulonowego za pomocą NaBH4 w tetrahydrofuranie. Właściwy (C-3β) epimer kwasu betulinowego jest wydzielany za pomocą krystalizacji. Metoda ta jest stosunkowo prosta lecz niezbyt wydajna (ok. 60%) [4]. Bardziej wydajną metodą syntezy kwasu betulinowego jest wysoce chemoselektywne utlenienie pierwszorzędowej grupy hydroksylowej bezpośrednio do karboksylowej za pomocą ATM. Wydajność tej reakcji wynosi aż 86% [5,10].
Właściwości betuliny i jej pochodnych
Betulina i jej pochodnecharakteryzują się wieloma użytecznymi właściwościami biologicznymi. Właściwości te występują już przy małych stężeniach tych związków. Ponadto betulina i jej pochodne charakteryzują się brakiem toksyczności zarówno w warunkach in vitro, jak i in vivo. Sprawia to, iż substancje te mogą zostać wykorzystane jako nowe potencjalne leki [2].
Betulina, kwas betulinowy oraz lupeol wyizolowane z licznych roślin, wykazują działanie przeciwalergiczne i przeciwzapalne. Zawarty w ekstrakcie z ziela głowienki pospolitej (Prunella vulgaris) kwas betulinowy posiada właściwości przeciwalergiczne. Hamuje on degranulację mastocytów oraz uwalnianie β-heksozaminidazy i znajdującej się w tych samych ziarnistościach histaminy [6].
Betulina oraz kwas betulinowy wyizolowane z kłączy wodnej rośliny Nelumbo nucifera, wykazują wysoką aktywność przeciwzapalną. Substancje te hamują obrzęk łapy szczura indukowany karageniną oraz serotoniną, porównywalnie do standartowych substancji przeciwzapalnych. Również lupeol wyizolowany z kory (Crataeva nurvala) wykazuje efekt przeciwzapalny w ostrych i chronicznych stanach zapalnych u szczurów. Zmniejsza on obrzęk łapy szczurów ze sztucznie wywołanym zapaleniem stawów przez czynnik CFA ( z Mycobacterium tuberculosis) o 39%. Działanie przeciwzapalne lupeolu zostało także zaobserwowane u szczurów z artretyzmem wywołanym formaldehydem. Lupeol skutecznie redukował objętość wysięku i wpływał hamująco na ogólną liczbę leukocytów u szczurów. Prawdopodobnie przeciwzapalna aktywność tego związku wynika z immunosupresyjnego działania i wiąże się z hamowaniem migracji komórek do miejsc objętych procesem zapalnym a także redukcją prozapalnych czynników chemotaktycznych [2].
Kwas betulinowy indukuje apoptozę komórek wielu linii ludzkich nowotworów. Skuteczność kwasu betulinowego przeciwko komórkom nowotworowym przebadano na myszach, które zakażono komórkami melanomy ludzkiej MEL-1, -2, -3 i -4. Wykazano zahamowanie wzrostu guza przy bardzo małych stężeniach związku, nie powodując przy tym efektów ubocznych takich jak ubytek masy ciała. Wybiórcze działanie kwasu betulinowego przeciwko komórkom melanomy ludzkiej nie wpływa na funkcje życiowe zdrowych komórek. Kwas betulinowy pozbawiony jest cytotoksyczności w stosunku do zdrowych komórek (pH > lub = 7), natomiast wykazuje cytotoksyczność w warunkach panujących wewnątrz komórek nowotworowych (pH < lub = 6.8). Biorąc pod uwagę brak toksyczności dla zdrowych komórek i dużą aktywność tego związku, można przypuszczać, że zostanie on wprowadzony do lecznictwa jako nowy lek w terapii czerniaka ludzkiego [7].
Kwas betulinowy wywołuje apoptozę nie tylko komórek czerniaka, ale również słabo podlegających na większość czynników proapoptycznych komórek nerwiaka niedojrzałego, rdzeniarka oraz glejaka [2].
Prawdopodobny mechanizm działania kwasu betulinowego polega na wywołaniu apoptozy, czyli programowanej śmierci komórki nowotworowej. Proces ten zachodzi z pominięciem kaskad przekaźnikowych uruchamiających programową śmierć komórki oraz bez udziału białka p53, które jest odpowiedzialne za uruchamianie apoptozy w wielu liniach komórkowych. Natomiast niektóre komórki traktowane kwasem betulinowym wykazują zwiększona ekspresję białka p21, którego podwyższona zawartość związana jest z zatrzymaniem cyklu komórkowego [7].
Przeprowadzone badania wykazały, że kwas betulinowy oddziałuje na mitochondria. Powoduje on zmianę w przepuszczalności kompleksu białkowego błon mitochondrialnych, który jest odpowiedzialny za utrzymanie odpowiedniej różnicy potencjałów. Zaburzenie potencjału mitochondrialnego spowodowane jest wpływem modulującym na białka z rodziny BCL/BAX. Białka te są endogennymi inhibitorami zmian przepuszczalności błon mitochondrialnych i kontrolują aktywację kaspaz. Pod wpływem kwasu betulinowego poziom BCL/BAX jest podwyższony, jednak zostaje zachowana pomiędzy nimi równowaga. Zwiększona ilość proapoptycznego białka BAX rekompensowana jest podwyższoną zawartością antyapoptotycznego BCL-2. Białko BCL-2 tworzy heterodimer z białkiem BAX, unieczynnia je i przez to uniemożliwia uruchomienie programu śmierci. Poziom innych białek kontrolujących uwalnianie cytochromu c jest niezmieniony. Komórki z nadekspresją genów BCL-2 lub BCL-XL nie podlegają apoptozie indukowanej przez kwas botulinowy, co potwierdza hipotezę, że związek ten wpływa na białka kontrolujące potencjal mitochondrialny. W następstwie dochodzi do uwolnienia do cytozolu białek apoptogennych z przestrzeni międzybłonowej mitochondriów: cytochromu c i czynnika indukcji apoptozy (AIF). Białka te powodują aktywację kaspaz. Cytochrom c uaktywnia kaspazę-3, a AIF zarówno kaspazę-3 jak i kaspazę-8. Dochodzi do wzbudzenia endonukleaz, powodujących fragmentację jądrowego DNA, obkurczenie komórki i jej fagocytozę przez komórki układu odpornościowego. Izolowane mitochondria traktowane kwasem betulinowym powodują w ekstrakcie cytoplazmatycznym apoptozę całych komórek nowotworowych. Natomiast ekstrakt cytoplazmatyczny pozbawiony mitochondriów traktowany kwasem betulinowym nie ma właściwości apoptotycznych [2].
Wykazano, że kwas betulinowy oraz jego pochodne, wyizolowane z ekstraktu z liści Syzygium claviflorum, hamują replikację wirusa HIV w komórkach limfocytarnych H9. Związki te hamują cykl życiowy wirusa w zainfekowanej komórce już w początkowym stadium i chronią otaczające komórki przed rozprzestrzenianiem się HIV. Prawdopodobny mechanizm działania kwasu betulinowego i jego pochodnych polega na blokowaniu płaszcza proteinowego wirusa, co uniemożliwia mu wiązanie się z błoną zewnętrzną komórek gospodarza. Bez tego połączenia wirus nie ma możliwości reprodukcji. Kwas betulinowy i jego pochodne wymagają dalszych badań laboratoryjnych i klinicznych w celu wyjaśnienia ich przeciwwirusowego działania oraz wyselekcjonowania najaktywniejszych związków z tej grupy [8].
Betulina jest odpowiedzialna za działanie hepatoochronnie hepatocytów ludzkich Hep G2. Zmniejsza ona cytotoksyczność chlorku kadmu (II) w komórkach Hep G2. Związki kadmu (II) w komórkach nietraktowanych betuliną, powodują ich 80% umieralność. Najlepszy efekt hepatoochronny uzyskuje się podając betulinę na 24 godziny przed intoksykacją chlorkiem kadmu (II), co sugeruje, że działanie ochronne powodowane jest przez niezidentyfikowane białko, którego synteza wywołana jest przez betulinę [9].
Badania przeprowadzone na szczurach z hiperoksalurią wywołaną niedoborem pirydoksyny, wykazały, że betulina oraz lupeol zmniejszają uszkodzenie kanalików nerkowych i obniżają wskaźniki odkładania kryształów w nerkach tych zwierząt. Związki te wpływają na zwiększenie objętości wydalanego moczu (spada przesycenie moczu) oraz na zmniejszenie ilości wydalanych szczawianów. Świadczy to o hamowaniu niektórych enzymów syntetyzujących szczawian z kwasu glikolowego podawanego w diecie. Następuje normalizacja stężenia glikozoaminoglikanów i magnezu w moczu. Szczawian magnezu ma większy iloczyn rozpuszczalności niż szczawian wapnia, a glikozoaminoglikany utrudniają formowanie kryształów. Czynniki te mają działanie ochronne przed wytracaniem kamieni. Jednocześnie spada stężenie białek w moczu. Wyniki te wykazują, że betulina i lupeol zmniejszają ryzyko odkładania szczawianu wapnia w nerkach a zatem powstawania kamicy nerkowej [2].
Chemiczne przekształcenia betuliny i kwasu betulinowego
Odkrycie selektywnego oddziaływania kwasu betulinowego tylko na komórki nowotworowe, bez uszkadzania zdrowych komórek, przyczyniło się do rozpoczęcia badań nad modyfikowaniem struktury betuliny i kwasu betulinowego metodami chemicznymi i mikrobiologicznymi [10].
Kwas betulinowy jest słabo rozpuszczalny w roztworach wodnych, przez co jego aktywność biologiczna często nie może się ujawnić. Ogranicza to przenikanie związku przez błony komórkowe i docieranie do docelowych organelli. Prowadzone są badania nad syntezą pochodnych kwasu betulinowego, które wykazałyby większą polarność oraz aktywność w porównaniu do związku wyjściowego. Otrzymano wiele amidowych koniugatów kwasu betulinowego z α-aminokwasami, w postaci estrów metylowych oraz z wolną grupą karboksylową (Rys.2). Najlepsze wyniki otrzymano w przypadku połączenia kwasu betulinowego z glicyną lub alaniną. Amid kwasu betulinowego z glicyną rozpuszczał się w wodzie 100-krotnie lepiej niż sam kwas, natomiast pochodna z alaniną 50-krotnie lepiej. Przeprowadzono badania aktywności cytotoksycznej pochodnych kwasu betulinowego z α-aminokwasami wobec linii czerniaka Mel-2 i mięsaka włóknistego ust KB. Badania te wykazały, że najbardziej aktywne wobec linii Mel-2 są koniugaty z estrami metylowymi alaniny, waliny oraz z wolną resztą glicyny (odpowiednio EC50 = 3,5, 2,1 i 4,2 µg x ml-1). W stosunku do linii KB najaktywniejsze okazały się pochodne z wolną resztą alaniny i waliny (odpowiednio EC50 = 4,6 i 9,0 µg x ml-1) [10].
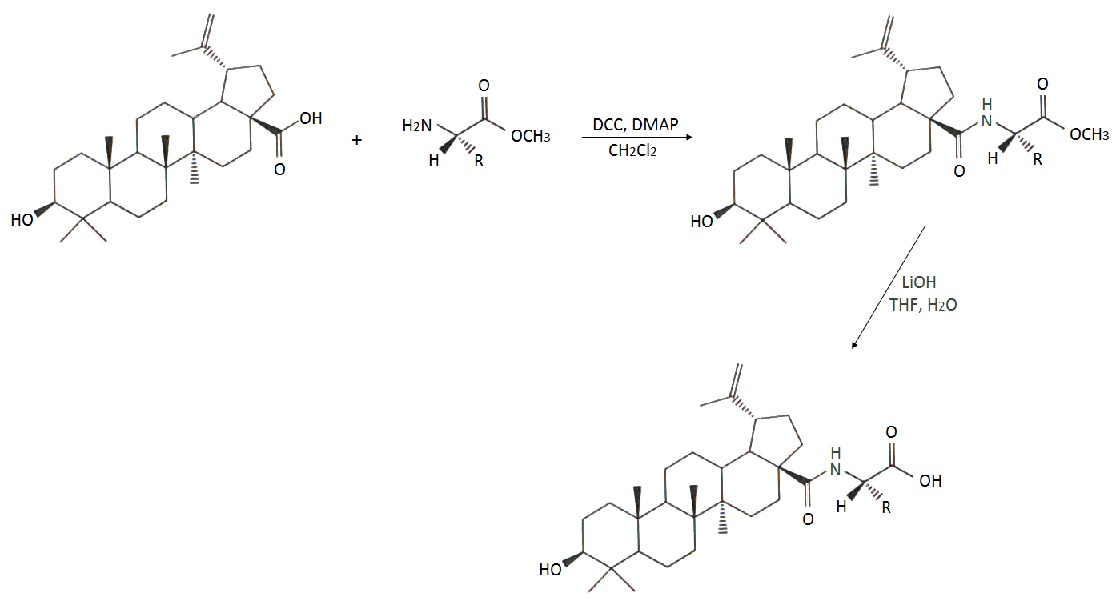
Rys.2. Synteza amidowych pochodnych kwasu betulinowego z α-aminokwasami.
Betulinę, kwas betulinowy oraz lupeol przeprowadzano także w pochodne glikozydowe, wcelu zwiększenia ich rozpuszczalności w wodzie. Związki te łączono z glukozą, ramnozą i arabinozą, otrzymując odpowiednio β-D-glukozydy, α-L-ramnozydy oraz α-D-arabinozydy. Przeprowadzono badania aktywności cytotoksycznej uzyskanych glikozydów na trzech liniach nowotworowych: płuc A-549, okrężnicy DLD-1, czerniaka B16-F1 oraz jednej zdrowej linii, fibroblastoidów skóry WS1. Wykazano, że wprowadzenie reszty cukrowej w pozycję C-3 lub C-28 w betulinie skutkowało utratą cytotoksyczności względem badanych linii. Natomiast korzystne okazało się kierowanie monosacharydów w pozycję C-3. Największą aktywnością charakteryzował się 3-O-α-ramnopiranozyd kwasu betulinowego (Rys.3), który w stosunku do linii nowotworowych płuc A-549, okrężnicy DLD-1 i czerniaka B16-F1 uzyskał odpowiednio IC50 = 2,6, 3,9 i 3,9 µM, natomiast względem zdrowej linii fibroblastoidów skóry WS1 tylko IC50 = 31 µM. Przeprowadzono także syntezę glukuronidu z kwasem betulinowych. W wyniku tej reakcji otrzymano 28-O-β-D-glukuronid kwasu betulinowego (Rys.3), który lepiej rozpuszczał się w wodzie niż wyjściowy kwas betulinowy. Związek ten, w badaniach cytotoksyczności, nie wykazał inhibicji wzrostu komórek nowotworowych płuc A-549 i okrężnicy DLD-1 oraz zdrowych komórek, fibroblastoidów skóry WS1 [10].
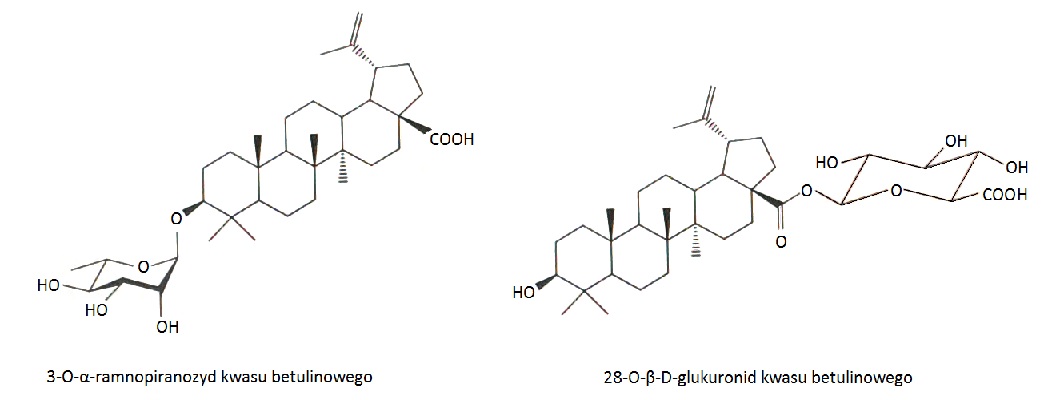
Rys.3. Synteza pochodnych betuliny i kwasu betulinowego z monosacharydami.
Pochodne betuliny z kwasami tłuszczowymi znajdują zastosowanie w produkcji kosmetyków oraz jako plastyfikatory przy produkcji PCV. Estry betuliny z takimi kwasami tłuszczowymi, jak: kwas laurynowy, palmitynowy, stearynowy, oleinowy i linolowy uzyskuje się na drodze estryfikacji w postaci mono- (C-28) i diestrów [10].
Obecnie prowadzone są liczne badania nad syntezą kwasu betulinowego z kwasami tłuszczowymi. Przeprowadzono estryfikację grupy hydroksylowej w pozycji C-3 w kwasie betulinowym kwasami tłuszczowymi o zróżnicowanej długości łańcucha (C4-C22). Jako czynnik sprzęgający użyto EDCI w obecności DMAP w pirydynie. Otrzymano wiele pochodnych kwasu betulinowego, które następnie przebadano w testach in vitro pod kątem hamowania nowotworu w linii limfoblastów Raji (zainfekowanych wirusem Epstein-Barr). Wykazano, że pochodne estrowe kwasu betulinowego z kwasami: krotonowym, sorbowym, 3,3-dimetyloakrylowym, linolowym i oleinowym hamowały aktywność wirusa Epstein-Barr w komórkach Raji [10].
Biotransformacje betuliny, kwasu betulinowego i kwasu betulonowego
Betulina i kwas betulinowy zostały także poddane różnym modyfikacjom mikrobiologicznym. Mikrobiologiczne przekształcenia tych związków zmierzają w kierunku otrzymania ich bardziej aktywnych farmakologicznie pochodnych oraz zwiększenia ich aktywności poprzez zmianę właściwości fizykochemicznych, jak na przykład zwiększenie rozpuszczalności w wodzie [10].
Przeprowadzono biotransformacje kwasu betulinowego przy użyciu wielu szczepów bakterii i grzybów (Rys.4). Poprzez zastosowanie Cunninghamella sp. NRRL 5695 do transformacji kwasu betulinowego otrzymano glukozyd kwasu betulinowego z wiązaniem β-glikozydowym (2). Związek ten odznaczał się lepszą rozpuszczalnością w wodzie niż wyjściowy kwas. Stosując szczep Bacillus megaterium ATCC 13368 uzyskano kwas betulonowy (3) oraz trzy inne produkty 4, 5 oraz 6, które następnie przebadano w kierunku cytotoksyczności na linii czerniaka Mel-1 i Mel-2. Wykazano związek budowy przestrzennej produktów biotransformacji z ich aktywnością cytotoksyczną wobec komórek nowotworowych. Pochodne kwasu betulinowego, w których grupy hydroksylowe znajdowały się w znacznej odległości od grupy karboksylowej, silniej hamowały rozwój komórek nowotworowych niż pochodna z grupami hydroksylowymi w sąsiedztwie grupy karboksylowej. Zastosowanie szczepu promieniowca Nocardia sp. NRRL 5646 skutkowało przemianą kwasu betulinowego w betulinian metylu (1) [10].
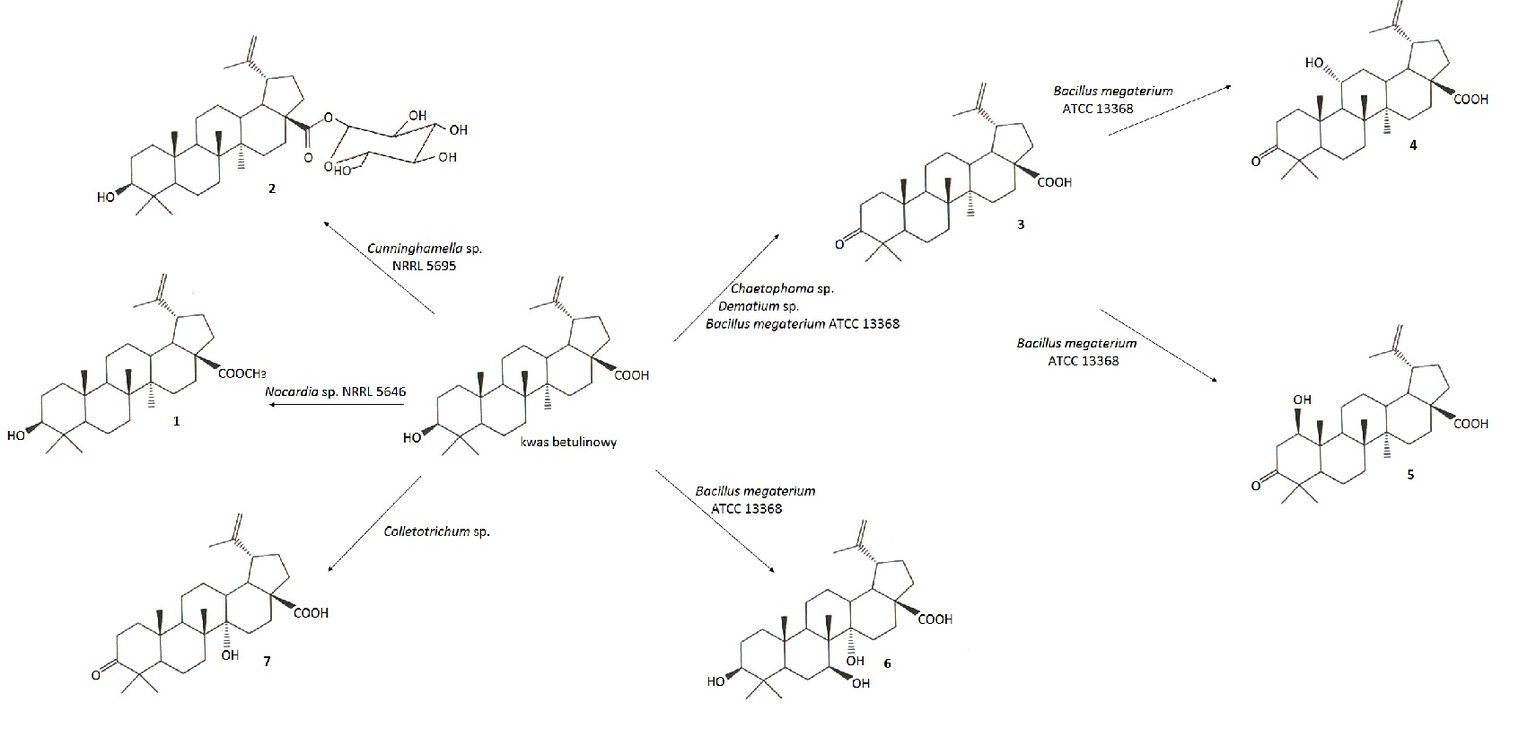
Rys.4. Biotransformacje kwasu betulinowego.
Do transformacji kwasu betulinowego i betulonowego użyto także grzybów strzępkowych: Arthrobotrys, Chaetophoma i Dematium, wyizolowanych z kory Platanus orientalis oraz Colletotrichum otrzymanego z liści kukurydzy. Szczepy Chaetophoma oraz Dematium przeprowadzały reakcje selektywnej hydroksylacji, utleniając kwas betulinowy do betulonowego (Rys.4). Chaetophoma wprowadził również grupę hydroksylową w pozycję C-25 kwasu betulonowego prowadząc do powstania związku 11 (Rys. 5). Zastosowanie szczepu Colletotrichum skutkowało przekształceniem kwasu betulinowego w produkt 7 (Rys.4), natomiast kwasu betulonowego w produkt 9 (Rys.5). Biotransformacje kwasu betulonowego z wykorzystaniem Arthrobotrys pozwoliły otrzymać trzy produkty 8, 9 i 10 (Rys.5) [10].
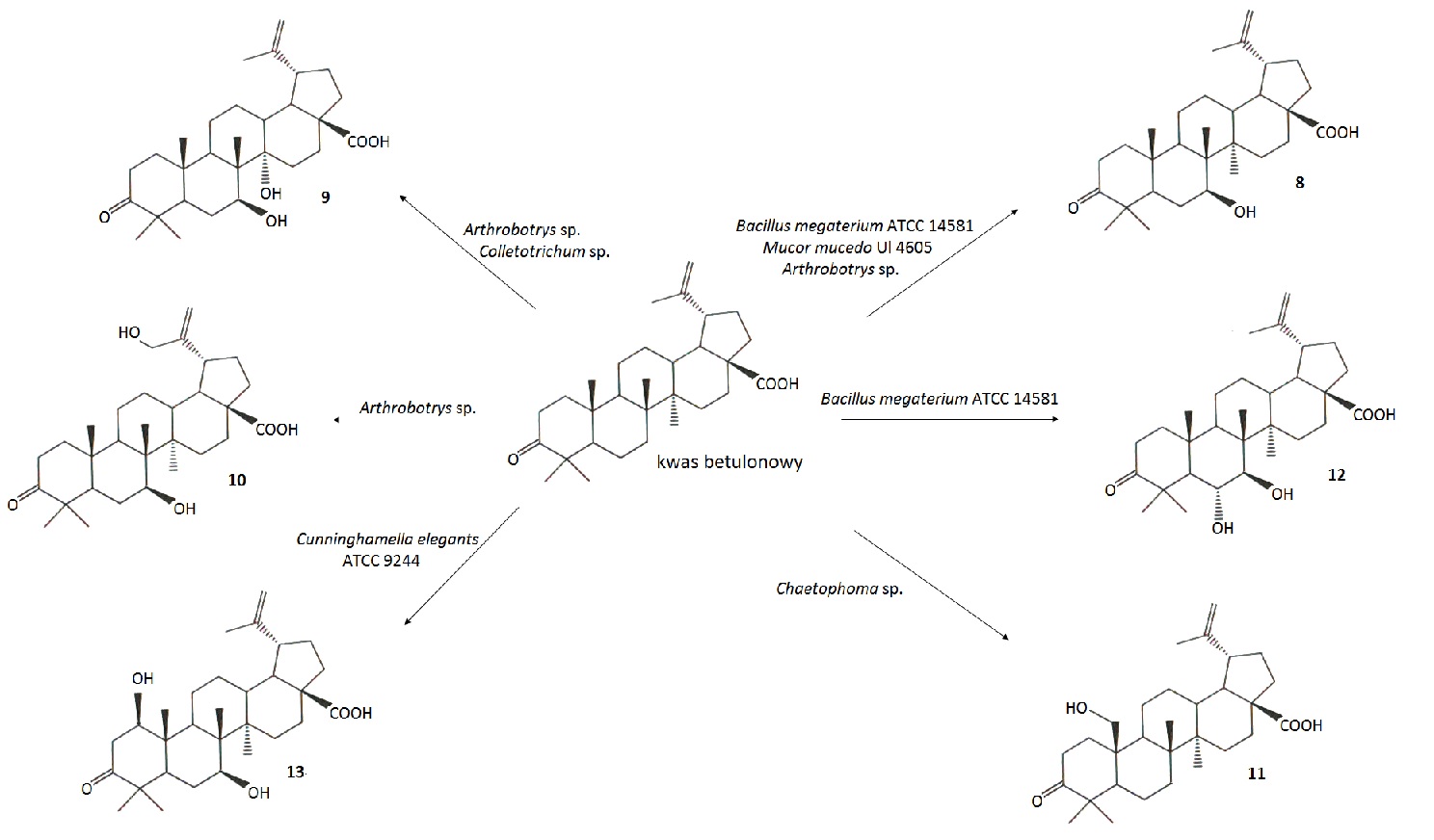
Rys.5. Biotransformacje kwasu betulonowego.
Do biotransformacji kwasu betulonowego stosowane są także inne mikroorganizmy: Bacillus megaterium ATCC 14581, Cunninghamella elegants ATCC 9244 oraz Mucor mucedo UI 4605 (Rys.5). Bacillus megaterium ATCC 14581 przekształcił kwas betulonowy do kwasów 8 oraz 12. Stosując szczep Cunninghamella elegants ATCC 9244 do transformacji kwasu betulonowego otrzymano produktu 13. Natomiast zastosowanie Mucor mucedo UI 4605 skutkowało przemianie kwasu betulonowego w kwas 7β-hydroksy-betulonowy (8). Wszystkie pochodne kwasu betulonowego zostały przebadane w kierunku cytotoksyczności na linii czerniaka Mel-1 i Mel-2. Jedynie produkt 8 wykazywał aktywność cytotoksyczną wobec linii czerniaka Mel-2 [10].
Przeprowadzono również biotransformacje betuliny do kwasu betulinowego w kulturach grzybów strzępkowych: Armillaria luteo-virens Sacc QH (CGMCC 1884) - mutant otrzymany po potraktowaniu promieniowaniem UV i gamma, Aspergillus foetidus ZU-G1 (CGMCC 1628) oraz Aspergillus oryzae AS 3.498 (Rys.6). Najlepszym biokatalizatorem spośród wymienionych mikroorganizmów okazał się szczep Armillaria luteo-virens Sacc QH, który produkował kwas betulinowy z wydajnością ponad 20% [10].
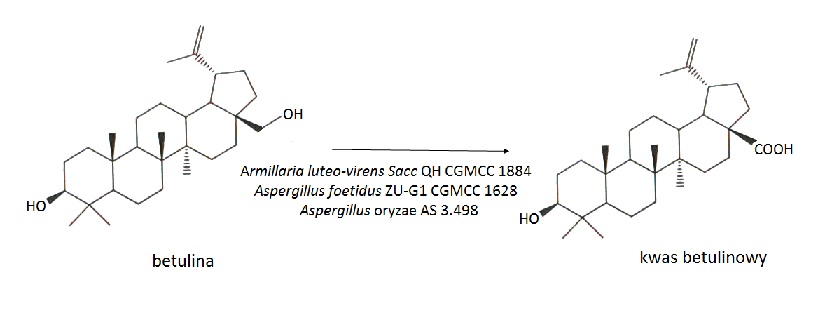
Rys.6. Biotransformacje betuliny.
Podsumowanie
Betulina i jej pochodne wykazują szerokie spektrum aktywności biologicznej przy małych stężeniach. Dodatkową cechą tych substancji, wyróżniających je, jako nowe, potencjalne preparaty lecznicze, jest brak toksyczności, zarówno w warunkach in vitro, jak i in vivo.
Do najważniejszych właściwości farmakologicznych betuliny i jej pochodnych należy działanie hamujące rozwój niektórych chemioopornych nowotworów, jak czerniak czy glejaki. Kwas betulinowy indukuje proces apoptozy – samobójczej śmierci komórki, tylko w komórkach zmienionych nowotworowo. Dzięki temu może być wykluczona część efektów ubocznych towarzyszących chemioterapii. Wśród innych działań betuliny i jej pochodnych można wymienić hamowanie rozwoju bakterii, wirusów, działanie przeciwzapalne, przeciwalergiczne, przeciwbólowe, ochronne dla wątroby. Istnieją również informacje, że betulina wspomaga gojenie się trudnych ran oparzeniowych i łagodzi obrzęki po ukąszeniach owadów. Obecnie betulina uznawana jest za potencjalnego prekursora wielu nowych preparatów leczniczych.
Dostępność betuliny jest duża, do 25% zewnętrznej warstwy kory białych gatunków brzóz, dzięki czemu może być ona łatwo pozyskiwana i poddawana rozmaitym przekształceniom chemicznym lub biotechnologicznym, w celu otrzymania nowych preparatów leczniczych.
Autor: Katrzyna Czuba
Literatura:
1.Dzubak P., Hajduch M., Vydra D., Hustova A., Kvasnica M., Biedermann D., Markova U., Urban M., Sarek J. Pharmacological activities of natural triterpenoids an their therapeutic implications. Nat. Prod. Rep. 2006. 23, 394-411.
2.Achrem-Achremowicz J., Janeczko Z. Betulina - prekursor nowych środków leczniczych. Farm. Pol. 2002. 58. 17, 799-804.
3.Eckerman C., Ekman R. Comparison of solvents for extraction and crystalization of betulinol from birch bark waste. Paperi ja Puu. 1985. 67, 100-106.
4.Kim D., Pezzuto J., Pisha E. Synthesis of betulinic acid derivatives with activity against human melanoma. Bioorg. Med. Chem. Lett. 1998. 8, 1707-1712.
5.Csuk R., Schuck K., Schafer R. A practical synthesis of betulinic acid. Tetrahed Lett. 2006. 47, 8769-8770.
6.Ryu S.Y., Oak M.H., Yoon S.K., Cho D.I., Yoo G.S., Kim T.S., Kim K.M. Antiallergic and anti-inflammatory triterpenes from the herb of Prunella mdgaris. Plant. Med. 2000. 66, 358-360.
7.Pisha E., Heebyung Ch., Lee I.S., Chagwedera T., Farnsworth N., Cordell G., Beecher Ch., Fong H., Kinghorn A.D., Brown D., Wani M., Wall M., Hieken T., Cupta T., Pezzuto J. M. Discovery of betulinic acid as a selective inhibitor of human melanoma that functions by induction of apoptosis. Nat. Med. 1995. 1, 1046-1051.
8.Hashimoto F., Kashiwada Y, Cosentino L. M., Chen C.H., Garrett P.E., Lee K.H. Synthesis and anti-HIV actiyity of betulinic acid and dihydrobetulimc acid derivatives. Bioorg. Med. Chem. Lett. 1997. 5, 12, 2133-2143.
9.Hiroya K., Takahashi T., Miura N., Naganuma A., Sakamoto T. Synthesis of betulin derivatives and their protective effect against the cytotoxity of cadmium. Bioorg. Med. Chem. 2002. 10, 3229-3236.
10. Tubek B., Wawrzeńczyk C. Właściwości biologiczne betuliny i jej pochodnych. Na pograniczu Chemii i Biologii. Wyd. Nauk. UAM w Poznaniu, 2010. 25, 33-46.
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje