Wstęp
Czerniak to złośliwy nowotwór skóry, błon śluzowych albo błony naczyniowej gałki ocznej, wywodzący się z komórek barwnikowych wytwarzających melaninę - melanocytów. Charakteryzuje się on dużą złośliwością z powodu szybkiego wzrostu, wczesnych i licznych przerzutów oraz niewielkiej podatności na leczenie [1].
W ciągu roku na czerniaki skóry umiera w Polsce ponad tysiąc osób. Oprócz znacznej śmiertelności niepokój budzi także utrzymujący się wzrost zachorowalności, która ulega podwojeniu co 10 lat. Problem stanowią również ograniczone możliwości leczenia w stadium zaawansowanym i nie satysfakcjonujące wyniki stosowanej terapii systemowej z wykorzystaniem cytostatyków. Podanie przeciwciał anty-CTLA-4 (ipilimumab) chorym na zaawansowanego czerniaka po niepowodzeniu wcześniejszej terapii wydaje się być obiecującą metodą leczenia [1].
Ipilimumab
Ipilimumab jest rekombinowanym ludzkim przeciwciałem monoklonalnym, w podklasie IgG1. Wiąże się on z antygenem CTLA-4 (CD152) na powierzchni limfocytów T po ich wcześniejszej aktywacji w węzłach chłonnych [Rys.1]. Limfocyty T, przeciwnie limfocyty grasicozależne, to typ limfocytów, odpowiedzialnych za odpowiedź odpornościową komórkową, tzn. niszczą komórki obce dla organizmu [2]. Aktywacja limfocytów T następuje w wyniku dwóch mechanizmów: rozpoznawania przez receptor limfocytu T (TCR, T-cell lymphocyte receptor) fragmentów antygenów prezentowanych przez cząsteczki głównego układu zgodności tkankowej (MHC, major histocompatibility complex), które są obecne na powierzchni komórek prezentujących antygeny (APC, antygen presenting cell) oraz w wyniku wiązania cząsteczki CD28 z białkami CD80 i 86. Dzięki wiązaniu z białkami CD80 i 86 na powierzchni APC CTLA-4, jest hamowana aktywacja limfocytów T, co powoduje ich anergię i zmniejszenie wydzielania IL-2. Jest to jeden z niezbędnych obwodowych mechanizmów tolerancji immunologicznej zabezpieczających przed nadmierną aktywacją układu immunologicznego w trakcie zakażenia [3]. Ipilimumab blokuje ten mechanizm, co następnie może indukować niekontrolowaną aktywację i proliferację limfocytów T o rożnej swoistości. Aktywowane limfocyty T poprzez wydzielane cytokiny i mechanizmy cytotoksyczności powodują apoptozę komórek czerniaka. Aktywacji mogą ulegać nie tylko limfocyty T, które są zdolne do rozpoznawania antygenów czerniaka prezentowanych przez cząsteczki zgodności tkankowej, ale również limfocyty autoreaktywne, co odpowiada za działania niepożądane obserwowane po podaniu ipilimumabu [4].
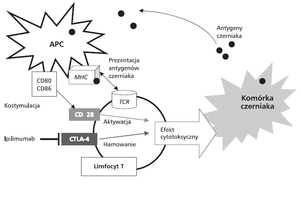
Rys.1. Mechanizmy przeciwnowotworowej odpowiedzi immunologicznej [1].
Korzyści kliniczne związane ze stosowaniem Ipilimumabu
Przeprowadzono badanie fazy II z zastosowaniem ipilimumabu w monoterapii u chorych na zaawansowanego czerniaka. W randomizowanym, zaślepionym podwójnie badaniu ipilimumabu uczestniczyło 217 chorych po niepowodzeniu wcześniejszego leczenia systemowego. Chorych losowo podzielono na grupy otrzymującej ipilimumab w dawkach 0,3 mg/kg (n = 72); 3 mg/kg (n = 72) i 10 mg/kg (n = 73). Lek podawano w 4 dawkach w odstępach co 3 tygodnie. Pierwszą ocenę leczenia przeprowadzano po 12 tygodniach, a następnie po kolejnych 12 tygodniach. Odsetek chorych, u których uzyskano odpowiedź na leczenie lub stabilizację choroby, był najwyższy w grupie leczonej dawką 10 mg/kg i 3 mg/kg i wynosił odpowiednio 11,1% (95% CI 4.9-20.7) oraz 4,2% (0.9-11.7), a u chorych otrzymujących dawkę 0,3 mg/kg — 0% (0.0-4.9). Wyniki tych badań sugerują, że skuteczność kliniczna rośnie wraz z dawką ipilimumabu. Mediana przeżycia wynosiła 8,6–11,4 miesięcy. Odsetek rocznych przeżyć u chorych leczonych ipilimumabem wyniosł 39–48%, a 2-letnich 18-29%. Estymowana krzywa prawdopodobieństwa przeżycia na wykresie Kaplana-Meiera utrzymuje się na stałym poziomie, co sugeruje, że w pewnej grupie chorych można spodziewać się długookresowych przeżyć po terapii ipilimumabem [Rys.2] [5].
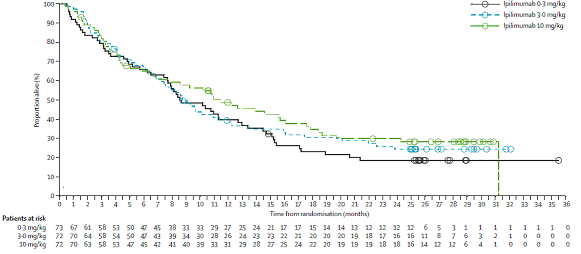
Rys.2. Estymowana krzywa prawdopodobieństwa przeżycia na wykresie Kaplana-Meiera [5].
Skuteczność i bezpieczeństwo stosowania Ipilimumabu w porównaniu z:
• Glikopeptydową szczepionką (gp100)
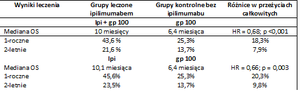
Na konferencji Amerykańskiego Towarzystwa Onkologii Klinicznej (ASCO, American Society of Clinical Oncology) zostały przedstawione rezultaty badań III fazy u chorych z czerniakiem złośliwym w stopniu III i IV [Tabela 1]. W randomizowanym, zaślepionym podwójnie badaniu ipilimumabu w połączeniu z glikopeptydową szczepionką, uczestniczyło 676 chorych. Chorych losowo podzielono na grupy w proporcji 3:1:1 do: grupy otrzymującej ipilimumab w skojarzeniu szczepionka peptydowa (n = 403), ipilimumab w monoterapii (n = 137) oraz tylko szczepionekę glikopeptydową (n = 136). Lek w dawce 3 mg/kg i/ szczepionkę glikopeptydową stosowano w 4 podaniach co 3 tygodnie. Zastosowanie ipilimumabu w skojarzeniu lub bez gp100 pozwoliło na zmniejszenie względnego ryzyka (HR, hazard ratio) zgonu o 32% i 34% w porównaniu z monoterapią szczepionką peptydową (HR = 0,68 p < 0,001; HR = 0,66, p = 0,003). Mediana czasu przeżycia chorych leczonych ipilimumabem wyniosła 10,0 miesięcy, leczonych ipilimumabem oraz szczepionką glikopeptydową 10,1 miesiąca i w obu przypadkach była znamiennie większa niż w grupie kontrolnej, gdzie mediana czasu przeżycia 6,4 miesiąca. Nie stwierdzono różnic pomiędzy obiema grupami leczonymi ipilimumabem. Odsetek rocznych przeżyć u chorych leczonych ipilimumabem wyniosł 46% (w grupie kontrolnej 25%), a 2-letnich 24% (14% w grupie kontrolnej). Estymowana krzywa prawdopodobieństwa przeżycia na wykresie Kaplana-Meiera utrzymuje się na stałym poziomie (ok. 20%), co sugeruje, że w pewnej grupie chorych można spodziewać się długookresowych przeżyć po terapii ipilimumabem [6].
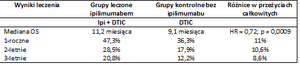
Tabela 1. Wyniki badań III fazy z zastosowaniem ipilimumabu w leczeniu zaawansowanego czerniaka [6].
Wyniki leczenia Grupy leczone ipilimumabem Grupy kontrolne bez ipilimumabu Różnice w przeżyciach całkowitych
OS (overall survival) – przeżycie całkowite; HR (hazard ratio) – ryzyko względne; Ipi – ipilimumab; gp100 - szczepionka peptydowa
• Dakarbazyną (DTIC)
Przeprowadzono również badania III fazy oceniające skuteczność ipilimumabu w dawce 10 mg/kg w skojarzeniu z dakarbazyną w porównaniu do dakarbazyny plus placebo [Tabela 2]. Dakarbazyna jest jedynym cytostatykiem zarejestrowanym do leczenia uogólnionego czerniaka. W randomizowanym, zaślepionym podwójnie badaniu uczestniczyło 502 chorych z dotychczas nie leczonym czerniakiem złośliwym. Chorych losowo podzielono na dwie grupy w proporcji 1:1. Pierwsza grupa otrzymywała ipilimumab w dawce 10mg/kg oraz 850mg/m2 powierzchni ciała dakarbazyny (n = 251) natomiast druga grupa otrzymała 850mg/m2 powierzchni ciała dakarbazyny oraz placebo (n = 251). Leki podawano w 1, 4, 7 i 10 tygodniu, a następnie tylko dakarbazyne co 3 tygodnie do 22 tygodnia. Zastosowanie ipilimumabu w skojarzeniu z dakarbazyną pozwoliło na zmniejszenie względnego ryzyka (HR, hazard ratio) zgonu o 28 % w porównaniu z dakarbazyną w połączniu z placebo (HR = 0,72; p=0,0009). Mediana czasu przeżycia chorych leczonych ipilimumabem + dakarbozyną wyniosła 11,2 miesięcy, leczonych dakarbozyna + placebo 9,1 miesiąca. Odsetek rocznych przeżyć u chorych leczonych ipilimumabem + dakarbozyną wyniosł 47,3% (w grupie z dakarbozyną + placebo 36,3%), a 2-letnich 28,5% (w grupie z dakarbozyną + placebo 17,9%), natomiast 3 letnich 20,8% (w grupie z dakarbozyną + placebo 12,2%). Estymowana krzywa prawdopodobieństwa przeżycia na wykresie Kaplana-Meiera utrzymuje się na stałym poziomie, co sugeruje, że w pewnej grupie chorych można spodziewać się długookresowych przeżyć po terapii ipilimumabem [7].
Tabela 2. Wyniki badań III fazy z zastosowaniem ipilimumabu w leczeniu zaawansowanego czerniaka [7].
Wyniki leczenia Grupy leczone ipilimumabem Grupy kontrolne bez ipilimumabu Różnice w przeżyciach całkowitych
OS (overall survival) – przeżycie całkowite; HR (hazard ratio) – ryzyko względne; Ipi – ipilimumab; DTIC – dakarbazyna
Działania niepożądane
Blokowanie przez ipilimumab białka CTLA-4 może prowadzić do wystąpienia działań niepożądanych związanych z nadmierną aktywacją odpowiedzi komórkowej zależnej od autoreaktywnych limfocytow T (irAEs, immune-related adverse events). ). Do najczęściej występujących działań niepożądanych związanych z leczeniem należy zaliczyć: biegunkę, nudności, wymioty, gorączkę, wysypkę, zmęczenie oraz zapalenie jelita grubego. Do najczęściej występujących działań niepożądanych o podłożu immunologicznym należą zmiany skórne i zaburzenia ze strony przewodu pokarmowego, rzadziej obserwowano zapalenie wątroby oraz zaburzenia endokrynologiczne (niedoczynność tarczycy i/lub niedoczynność przysadki). Działania niepożądane o podłożu immunologicznym wystąpiły u 19 pacjentów (26,4%) otrzymujących ipilimumab w dawce 0,3mg/kg, 46 pacjentów (64,9%) otrzymujących ipilimumab w dawce 3mg/kg oraz 50 pacjentów (70,4%) otrzymujących ipilimumab w dawce 10mg/kg. Większość irAEs występuje w okresie leczenia indukcyjnego ipilimumabem. Poważne działania niepożądane wystąpiły u 26 pacjentów (36%) otrzymujących ipilimumab w dawce 0,3mg/kg, 35 pacjentów (49,3%) otrzymujących ipilimumab w dawce 3mg/kg oraz 38 pacjentów (53,5%) otrzymujących ipilimumab w dawce 10mg/kg. Natomiast poważne działania niepożądane związane z podawanym lekiem wystąpiły u 6 pacjentów (8,3%) otrzymujących ipilimumab w dawce 0,3mg/kg, 13 pacjentów (18,3%) otrzymujących ipilimumab w dawce 3mg/kg oraz 19 pacjentów (26,8%) otrzymujących ipilimumab w dawce 10mg/kg. W większości przypadków wdrożenie odpowiedniego leczenia prowadziło do szybkiego ustąpienia działań niepożądanych [5].
Potencjalna populacja docelowa
Na podstawie dotychczas dostępnych danych klinicznych leczenie ipilimumabem należy przede wszystkim rozważać u chorych:
- z rozpoznaniem czerniaka skóry lub błon śluzowych w stadium zaawansowania nieoperacyjnym III lub w IV;
- po wcześniejszym nieskutecznym leczeniu systemowym (na podstawie dakarbazyny); maksymalnie 2 linie terapii lub nietolerancja leczenia systemowego;
- bez przerzutów do mózgu lub z bezobjawowymi przerzutami do mózgu;
- w dobrym stanie sprawności (0/1 według kryteriów Eastern Cooperative Oncology Group (ECOG)) [8].
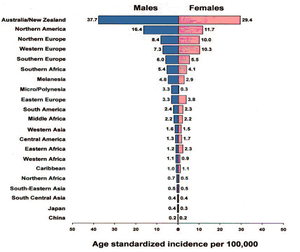
Czerniak stanowi zaledwie 1% nowotworów występujących u człowieka. Pomimo tego stanowi istotny problem współczesnej onkologii, ze względu na obserwowany ogólnoświatowy dynamiczny wzrost zachorowalności oraz z uwagi na stosunkowo młody wiek chorych (30-50 lat) i związane z tym konsekwencje społeczne. Badania epidemiologiczne wskazują, że zapadalność na czerniaka wzrasta średnio o 5% rocznie, a co 10 lat liczba nowych przypadków ulega podwojeniu. Wzrost zachorowań dotyczy przede wszystkim rasy białej. Obecnie liczbę zachorowań na świecie szacuje się na 133 tys. rocznie. Zachorowalność wykazuje znaczne różnice geograficzne. Najwyższe współczynniki zachorowalności obserwuje się wśród ludności napływowej Australii i Ameryki Północnej oraz w Europie [Rys.3] [10].
Rys.3. Standaryzowany współczynnik zachorowalności na czerniaka [9].
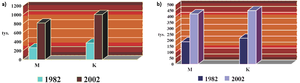
Polska należy do krajów o średnio-niskiej zachorowalności na czerniaka. Według danych Krajowego Rejestru Nowotworów w 2002 roku w Polsce rozpoznano 1831 nowych zachorowań na czerniaka skóry, co daje 15 miejsce wśród zachorowań na nowotwory złośliwe. Natomiast jako przyczyna zgonu na nowotwór złośliwy czerniak zajął w 2002 roku 19 miejsce z liczbą zgonów 875 u obu płci (424 mężczyzn i 451 kobiet). Podobnie jak na świecie, także w Polsce obserwuje się dynamiczny wzrost zachorowań. W latach 1982-2002 liczba nowych przypadków czerniaka skóry wzrosła w polskiej populacji blisko 3-krotnie, a liczba zgonów w tym samym okresie – ponad 2-krotnie [Rys.4] [10].
Rys.4. Liczba zachorowań (a) oraz liczba zgonów (b) z powodu czerniaka skóry w Polsce w latach 1982-2002 [10].
Miejsce leku w praktyce i zapotrzebowanie na lek
Ipilimumab został zarejestrowany do stosowania w leczeniu zaawansowanego czerniaka (nieresekcyjnego lub przerzutowego) u dorosłych pacjentów poddanych wcześniejszej terapii. Oznacza to, że nie ma prawnej możliwości zastosowania tego leku w I linii leczenia. Ipilimumab może otrzymać tylko pacjent, który otrzymał wcześniej leczenie, po którym nastąpiła progresja choroby. Cała terapia składa się z 4 podań leku w dawce 3mg/kg masy ciała, co 3 tygodnie. Lek w chwili obecnej nie jest refundowany, ale można składać do NFZ wnioski o chemioterapię niestandardową. Istnieje możliwość, że zostanie otwarty program terapeutyczny pozwalający stosować ten lek w określonej grupie pacjentów [11].
Opłacalność stosowania
Cena dakarbazyny, najczęściej stosowanego leku w I linii leczenia chorych na zaawansowanego czerniaka wynosi $200,20 za 600 mg/ml - 1 fiolkę. Dakarbazyna podawana jest dożylnie w dawkach 200-250 mg/m2 powierzchni ciała/dobę przez 1-5 dni z przerwą 21-28 dniową. Średni dzienny koszt takiej terapii dla pacjenta o wadze 70 kg i powierzchni ciała 1,7 m2 wynosi od $20,26 do $33,76. Natomiast średni koszt 28-dniowej kuracji wynosi od $567,23 do $945,39 [12].
Vemurafenib jest stosowany w pierwszej linii leczenia chorych na nieoperacyjnego lub przerzutowego czerniaka z obecną mutacją BRAF V600E. Cena katalogowa vemurafenib wynosi $46,54 za 240 mg – 1 tabletka. Zalecana dawka to 960 mg dwa razy na dobę (8 tabletek dziennie). Dzienny koszt leczenia vemurafenib wynosi $372,32. Natomiast średni koszt 28-dniowej kuracji wynosi $10 425,34 [13].
Cena katalogowa 10 ml fiolki ipilimumabu (5 mg/ml) wynosi $ 5800,00. Ipilimumab podawany jest dożylnie w dawce 3 mg/kg masy ciała, co 3 tygodnie. Cała terapia składa się z 4 podań leku. W przedstawionej cenie, jedna dawka ipilimumabu kosztuje $ 24 360,00 a cała kuracja $ 97 440,00 zakładając pacjenta o masie ciała 70 kg [12].
Wyniki analizy koszty‐efektywność, przeprowadzonej dla badanej populacji pacjentów wskazują, że terapia ipilimumabem jest strategią droższą, jednakże bardziej efektywną w porównaniu z obecnie stosowanymi schematami leczenia. Należy wziąć także pod uwagę uwarunkowania: całkowite przeżycie, jakie daje lek, i przede wszystkim jego jednorazowe podanie. Jest to jednorazowy cykl leczenia, w przeciwieństwie do terapii ukierunkowanych molekularnie, w których leczenie może być przewlekłe, nawet kilkuletnie, co poniekąd bilansuje koszty ipilimumabu [12].
Podsumowanie
Trwają dyskusje nad skutecznością ipilimumabu i jego rolą w leczeniu czerniaka. Jednakże jest to niewątpliwie pierwszy lek od bardzo długiego czasu o udowodnionym wpływie na wydłużenie przeżycia pacjentów z czerniakiem.
Autor: Czuba Katarzyna
Literatura:
1. Świtaj T., Wysocki P., Wojtkiewicz M. i wsp. Ipilimumab — postęp w terapii chorych na zaawansowanego czerniaka. Onkologia w Praktyce Klinicznej. 2011; tom 7, nr 5: 231–245.
2. Ridolfi L., Ridolfi R. Anti-CTLA-4 therapy in melanoma: role of ipilimumab (MDX-010). Expert Rev. Dermatol. 2009; 4: 199–210.
3. Walker L.S., Abbas A.K. The enemy within: keeping self-reactive T cells at bay in the periphery. Nat. Rev. Immunol. 2002; 2:11–19.
4. Weber J. Ipilimumab: controversies in its development, utility and autoimmune adverse events. Cancer Immunol. Immunother. 2009; 58: 823–830.
5. Wolchok J.D., Neyns B., Linette G. i wsp. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study. Lancet Oncol. 2010; 11: 155–164.
6. Hodi F.S., O’Day S.J., McDermott D.F. i wsp. Improved survival with ipilimumab in patients with metastatic melanoma. N. Engl. J. Med. 2010; 363: 711–723.
7. Robert C., Thomas L., Bondarenko I. i wsp. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N. Engl. J. Med. 2011; 364: 2517–2526.
8. Wolchok J.D., Hoos A., O’Day S.J. i wsp. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin. Cancer Res. 2009; 15: 7412–7420.
9. Parkin D. M., Bray F., Ferlay J., and Pisani P. Global Cancer Statistics, 2002. CA Cancer J Clin. 2005; 55: 74-108.
10. Wronkowski Z., Zwierko M.: Epidemiologia czerniaka skóry. [W:] Czerniaki skóry u dorosłych. Ruka W., Nowecki Z.I., Rutkowski P. (red.). MediPage, Warszawa 2005, 9-16.
11. http://hylostet.pl/igm/article/ipilimumab-rola-po-rejestracji/
12. http://www.pcodr.ca/idc/groups/pcodr/documents/pcodrdocument/pcodr-yervoy-adv-mel-fn-rec.pdf
13. http://www.pcodr.ca/idc/groups/pcodr/documents/pcodrdocument/pcodr-zelboraf-in-egr.pdf
14. http://www.inpharm.com/news/165332/bms-skin-cancer-vaccine-yervoy-uk
Tagi:
czerniak,
ipilimumab,
immunoterapia,
badania kliniczne,
lab,
laboratoria,
laboratorium
wstecz
Podziel się ze znajomymi


 Ipilimumab jest rekombinowanym ludzkim przeciwciałem monoklonalnym, w podklasie IgG1. Wiąże się on z antygenem CTLA-4 (CD152) na powierzchni limfocytów T po ich wcześniejszej aktywacji w węzłach chłonnych [Rys.1]. Limfocyty T, przeciwnie limfocyty grasicozależne, to typ limfocytów, odpowiedzialnych za odpowiedź odpornościową komórkową, tzn. niszczą komórki obce dla organizmu [2]. Aktywacja limfocytów T następuje w wyniku dwóch mechanizmów: rozpoznawania przez receptor limfocytu T (TCR, T-cell lymphocyte receptor) fragmentów antygenów prezentowanych przez cząsteczki głównego układu zgodności tkankowej (MHC, major histocompatibility complex), które są obecne na powierzchni komórek prezentujących antygeny (APC, antygen presenting cell) oraz w wyniku wiązania cząsteczki CD28 z białkami CD80 i 86. Dzięki wiązaniu z białkami CD80 i 86 na powierzchni APC CTLA-4, jest hamowana aktywacja limfocytów T, co powoduje ich anergię i zmniejszenie wydzielania IL-2. Jest to jeden z niezbędnych obwodowych mechanizmów tolerancji immunologicznej zabezpieczających przed nadmierną aktywacją układu immunologicznego w trakcie zakażenia [3]. Ipilimumab blokuje ten mechanizm, co następnie może indukować niekontrolowaną aktywację i proliferację limfocytów T o rożnej swoistości. Aktywowane limfocyty T poprzez wydzielane cytokiny i mechanizmy cytotoksyczności powodują apoptozę komórek czerniaka. Aktywacji mogą ulegać nie tylko limfocyty T, które są zdolne do rozpoznawania antygenów czerniaka prezentowanych przez cząsteczki zgodności tkankowej, ale również limfocyty autoreaktywne, co odpowiada za działania niepożądane obserwowane po podaniu ipilimumabu [4].
Ipilimumab jest rekombinowanym ludzkim przeciwciałem monoklonalnym, w podklasie IgG1. Wiąże się on z antygenem CTLA-4 (CD152) na powierzchni limfocytów T po ich wcześniejszej aktywacji w węzłach chłonnych [Rys.1]. Limfocyty T, przeciwnie limfocyty grasicozależne, to typ limfocytów, odpowiedzialnych za odpowiedź odpornościową komórkową, tzn. niszczą komórki obce dla organizmu [2]. Aktywacja limfocytów T następuje w wyniku dwóch mechanizmów: rozpoznawania przez receptor limfocytu T (TCR, T-cell lymphocyte receptor) fragmentów antygenów prezentowanych przez cząsteczki głównego układu zgodności tkankowej (MHC, major histocompatibility complex), które są obecne na powierzchni komórek prezentujących antygeny (APC, antygen presenting cell) oraz w wyniku wiązania cząsteczki CD28 z białkami CD80 i 86. Dzięki wiązaniu z białkami CD80 i 86 na powierzchni APC CTLA-4, jest hamowana aktywacja limfocytów T, co powoduje ich anergię i zmniejszenie wydzielania IL-2. Jest to jeden z niezbędnych obwodowych mechanizmów tolerancji immunologicznej zabezpieczających przed nadmierną aktywacją układu immunologicznego w trakcie zakażenia [3]. Ipilimumab blokuje ten mechanizm, co następnie może indukować niekontrolowaną aktywację i proliferację limfocytów T o rożnej swoistości. Aktywowane limfocyty T poprzez wydzielane cytokiny i mechanizmy cytotoksyczności powodują apoptozę komórek czerniaka. Aktywacji mogą ulegać nie tylko limfocyty T, które są zdolne do rozpoznawania antygenów czerniaka prezentowanych przez cząsteczki zgodności tkankowej, ale również limfocyty autoreaktywne, co odpowiada za działania niepożądane obserwowane po podaniu ipilimumabu [4]. 

Recenzje