W metodzie tej wykorzystuje się chromatografię powinowactwa z zastosowaniem odpowiedniego ligandu. Ligand musi zawierać grupy chlorotriazynylowe, dlatego najczęściej stosuje się odpowiednie barwniki, mające zdolność łatwego reagowania w środowisku zasadowym z matrycami polisacharodowymi, tworząc w ten sposób trwałe barwne produkty. Barwnik Cibacron-Blue wykazuje wysoką specyficzność do dehydrogenazy mleczanowej i innych dehydrogeaz (czyli enzymów współdziałających z NAD+) [15].
Barwnik Cibacron-Blue jest mieszaniną dwóch izomerów 1 i 2, które różnią się położeniem grupy sulfonowej w pierścieniu A (para lub meta). Barwnik połączony do dektranu (niebieski dekstran) wytwarza się z mieszaniny tych dwóch izomerów związanych do dekstranu poprzez wiązanie eterowe do pierścienia triazynowego B. Ponieważ barwnik ma wysokie powinowactwo do niektórych białek, niebieski dekstran jest często stosowany do ich oczyszczania. Zwiększone zainteresowanie specyficznymi oddziaływaniami pomiędzy barwnikami i białkami, nastąpiło z powodu podobieństw strukturalnych pomiędzy barwnikami i dinukleotydami (jak np. NAD+) . Co więcej, uważa się, że obie cząsteczki powinny wiązać się w taki sam sposób do tego samego miejsca i że Cibacron-Blue działa jak sonda w obecności nukleotydów [17].
Zdjęcie: Struktura Cibacron-Blue 3G-A, [18].
Wykonanie:Około 0,5 – 1 ml roztworu białka z frakcji cytosolowej należy nałożyć na przygotowane złoże chromatograficzne- kolumna chromatograficzna wypełniona żelem Sepharose 4B z barwnikiem Cibacron –Blue (błękit cibakronowy). Cibacron-Blue jest barwnikie, który wykazuje duże powinowactwo do wielu enzymów i białek, w związku z czym często wykorzystywany jest w chromatografii. Po wniknięciu próbki w żel należy kolumnę zrównoważyć w celu uniknięcia zapowietrzenia. Do zrównoważenia użyć kilku kropli 0,1M buforu Tris-HCl o pH=7.5 - pozwala to na uniknięcie zapowietrzenia kolumny. Po przemyciu kolumny należy ja zamknąć, by doszło do zrównoważenia frakcji cytosolowej (ok. 15 minut). Po upływie tego czasu kolumnę przemyć za pomocą 4,5 ml 0.1 M buforu Tris-HCl o pH= 7.5. W trakcie przemywania zebrać 3 frakcje po 1,5 ml eluatu. W dalszej kolejności kolumnę przemywa się zwiększoną ilością 0,1 M buforu Tris-HCl o pH=7.5 (10,5 ml) zawierającym dodatkowo 1M KCl. W trakcie przemywania nadal należy zbierać 1,5 ml frakcje eluatu w 7 powtórzeniach, umieszczając probówki z eluatem w łaźni lodowej. W przypadku, gdy tego samego dnia po zebraniu frakcji nie będzie się wykonywać oznaczania aktywności dehydrogenazy mleczanowej, próbki z eluatem muszą być zamrożone w temperaturze -80C. Po zebraniu frakcji kolumnę trzeba przemyć 4 ml 0,1M buforu Tris-HCl (pH=7.5) z dodatkiem 1M KCl oraz 8 ml samego buforu Tris-HCl o takim samym pH [15], [19].
Zastosowanie dehydrogenazy mleczanowej jako wskaźnika uszkodzenia płucMonitorowanie poziomu aktywności dehydrogenazy mleczanowej (LDH) oraz jej izoenzymów, znalazło zastosowanie jako wskaźniki określania zmian patologicznych w płucach takich jak np. uszkodzenie komórek czy pojawienie się stanów zapalnych. Z racji tego, że LDH jest enzymem obecnym w prawie wszystkich tkankach i narządach organizmu, odchylenia od normy w aktywności enzymu w surowicy pojawiają się przy wielu zaburzeniach w organizmie. Ponieważ wzrost całkowitej aktywności LDH w surowicy jest małoswoistą informacją, dodatkowo mierzy się aktywność enzymu w wydzielinie oskrzelowo-pęcherzykowej, co dostarcza dodatkowych informacji o kondycji płuc i uszkodzeniu nabłonka. W celu optymalizacji wartości diagnostycznej mogą być mierzone także izoenzymy LDH. Chociaż izoenzymy LDH w surowicy cechują się trochę lepszą swoistością, wartość kliniczna jest raczej niska. W przeciwieństwie do tego,pomiar LDH i izoenzymów LDH płynu opłucnowego jest użyteczny do określenia uszkodzeń tkanki płuc i śródbłonka.
Stężenia enzymu w różnych tkankach są bardzo wysokie w porównaniu do tych w surowicy krwi (wartości dla różnych narządów: np. wątroba 9000; serce 25000; nerki 15000; mięśnie szkieletowe 9000; płuca 9500). . Tak więc, poziom enzymów w tkankach jest około 500 razy większy niż w surowicy, tak więc wyciek enzymu z nawet niewielkiego uszkodzenia tkanki może w znacznym stopniu zwiększyć obserwowany poziom LDH w surowicy [20].
Izoenzym LDH-6Niektóre z nietypowych izoenzymów LDH, takie jak np. LDH-6, mogą mieć duże znaczenie diagnostyczne, jednak większość to „rarytasy laboratoryjne”. Obecność LDH-6 w surowicy pacjenta wiąże się zazwyczaj z bardzo złym rokowaniem. W przeprowadzonych badaniach wszystkie wcześniej zgłoszone przypadki były w stanie krytycznym. Ketchum i wsp. opisali dziewięciu pacjentów z LDH-6, z czego osiem zmarło w czasie ich pobytu w szpitalu. W innym badaniu z 18 pacjentów, którzy wykazali się obecnością enzymu LDH-6 w surowicy, 15 zmarło. Jak zauważono w trakcie prowadzonych badań, zgon pacjentów nie był jedynie przyczyną LDH-6, gdyż w tym samym czasie obserwowano u nich także inne objawy- wszyscy pacjenci mieli niedociśnienie, a większość z nich także nie udokumentowane epizody hipoksemii, które tylko poprzedzały test izoenzymu LDH [20].
Gromadzenie się płynów w klatce piersiowej może być wynikiem wielu różnych czynnikówi. Najczęściej przypisuje sie temu pojawienie się zatoru bądź rozmaitych zmian pourazowych, zapalnych lub zakaźnych. Często również gromadzeniu się płynów towarzyszy nowotwór w obrębie opłucnej, płuc, serca lub śródpiersia.
Wysięk opłucny charakteryzuje się różnymi objawami klinicznymi takimi jak. m.in.: duszność, ból w klatce piersiowej czy kaszel. W większości przypadków diagnostyka wysięku opłucnowego odbywa się w oparciu o badanie radiologiczne, ponieważ płyn gromadzi się zarówno pomiędzy płucami i ścianą klatki piersiowej, a także w szczelinach opłucnej pomiędzy płatami płuc, co można zauważyć na zdjęciu rentgenowskim. W celu ustalenia konkretnych przyczyn choroby wykonuje się badania, które opierają się na analizie:
- makroskopowej (ocena konsystencji płynu gromadzącego się w klatce piersiowej)
- fizykochemicznej (badania mają na celu różnicowanie pomiędzy przesiękiem, przesiękiem zmodyfikowanym i wysiękiem i chłonką),
- cytologicznej (ocenie poddaje się liczbę komórek, po czym dochodzi do identyfikacji poszczególnych rodzajów komórek).
Materiał do powyższych badań pozyskiwany jest na drodze punkcji [21].
Wartości dehydrogenazy mleczanowej będące powyżej 200 IU/l uznawane są za marker procesów wysiękowych. Płyny gromadzące się w obrębie opłucnej w związku z obecnością złośliwego guza mają często charakter wysięku, ponadto towarzyszą jeszcze inne objawy: normalne lub podwyższone pH (> 7,4), glukoza w przedziale od 10 do 80 mg/dl, a także poziom neutrofili znajdujący się poniżej 30% [21].
Wartości dehydrogenazy mleczanowej będące powyżej 200 IU/l uznawane są za marker procesów wysiękowych. Płyny gromadzące się w obrębie opłucnej w związku z obecnością złośliwego guza mają często charakter wysięku, ponadto towarzyszą jeszcze inne objawy: normalne lub podwyższone pH (> 7,4), glukoza w przedziale od 10 do 80 mg/dl, a także poziom neutrofili znajdujący się poniżej 30% [21].
Izoenzymy LDH i ich znaczenie diagnostycznePomiar aktywności LDH jest szeroko stosowany w analizie diagnostycznej wysięku w płucach, zwłaszcza rozróżniania przesięku i wysięku, a także pomiędzy wysiękiem niezłośliwym i złośliwym.. Pierwsze z przeprowadzonych wyników badań wartości diagnostycznej płynu opłucnej pod kątem wzorcowych izoenzymów LDH- były sprzeczne. Richterich i Burger poinformowali, że wzór izoenzymów LDH łagodnych wysięków ma odbicie we wzorze w surowicy, natomiast złośliwe wysięki zawierają izoenzymy LDH-4 i LDH-5. W przeciwieństwie do tych wyników badań, inni naukowcy donoszą, że złośliwe wysięki charakteryzują się maksymalną aktywnością enzymatyczną LDH-2, LDH-3 i LDH-4, podczas gdy łagodne wysięki enzymami LDH-4 i LDH-5.
Z kolei, Vergnon i in. w swoich badaniach zauważyli, że wzrost poziomu izoenzymu LDH-5 jest dobrym markerem wysięku złośliwego z płuc, ponadto stwierdził, że nawiązanie do poziomu izoenzymu LDH-5 w płynie opłucnej wydaje się być dokładnym markerem ewolucji wysięku złośliwego w opłucnej [20].
Kity do pomiaru aktywności dehydrogenazy mleczanowejAktualnie dostępne są gotowe kity, dzięki którym można w stosunkowo szybki i prosty sposób badać aktywnośc wielu enzymów, nie tylko dehydrogenazy mleczanowej. Przedstawiona poniżej metoda pomiaru LDH jest prosta, dokładna i daje powtarzalne wyniki. Test opiera się na redukcji NAD przez LDH. Redukcja NAD (NADH) jest wykorzystywana w stechiometrycznej przemianie barwnika tetrazolowego, w wyniku czego powstały kolorowy związek mierzony jest metodą spektrofotometryczną.
Jeśli komórki poddaje się lizie przed oznaczaniem podłoża, zwiększenie lub zmniejszenie liczby komórek w wynikach powoduje równoczesne zmiany ilości substratu przekształconego. To wskazuje na stopień hamowania wzrostu komórek (cytotoksyczność) ze strony materiału testowego. Aktywności LDH może być stosowana jako wskaźnik względnej żywotności komórek.
Procedura pomiaru aktywności LDH z wykorzystaniem kitu Sigma-Aldrich, Inc. pochodząca ze strony: http://www.sigmaaldrich.com/etc/medialib/docs/Sigma/Bulletin/tox7bul.Par.0001.File.tmp/tox7bul.pdf
Metoda opierająca się na monitorowaniu cytotoksyczności in vitro dobrze sprawdza się z zastosowaniem wielodołkowych płytek. Aby uzyskać najlepsze wyniki pomiaru powinno się używać komórki, które znajdują się w fazie logarytmicznego wzrostu, a ostateczna liczba komórek nie powinna przekraczać 106 komórek/ cm2. Każdy test powinien uwzględniać także próbę zerową, zawierającą pełną pożywkę bez komórek. Należy mieć na uwadze, że nierówne parowanie płynu hodowlanego ze studzienek płytki może powodować błędne wyniki. Ze względu na to, że NADH podlega fotodegradacji, nadmierna ekspozycja na światło może także powodować zmniejszenie czułości i dokładności testu.
Aktywność dehydrogenazy mleczanowej można badać za pomocą jednej z dwóch metod. Metoda 1 stanowi miarę całkowitej liczby komórek, z kolei druga metoda ocenia integralności błony komórek pod kątem ilości wycieku LDH do pożywki hodowlanej.
Metoda 1 (całkowite LDH):- Komórki znajdujące się na płytce należy usunąć z inkubatora hodowlanego (przenieść do sterylnego miejsce pracy)
- Dodać 1/10 roztworu do lizy do każdego dołka płytki (LDH Assay Lysis Solution) i ponownie przenieść płytkę z komórkami do inkubatora (inkubować przez 45 minut)
- Następnie, płytkę odwirować (250 x g, przez 4 minuty)
- Próbkę przenieść do sterylnego miejsca po czym kontynuować analizę enzymatyczną
Metoda 2 (uwalnianie LDH):Poszczególne etapy w tej metodzie są identyczne z metodą 1, z pominięciem dodawania roztworu do lizy (etap 2).
Analiza enzymatyczna (z wykorzystaniem kitu Sigma-Aldrich, Inc. pochodząca ze strony: http://www.sigmaaldrich.com/etc/medialib/docs/Sigma/Bulletin/tox7bul.Par.0001.File.tmp/tox7bul.pdf)
- Należy przygotować mieszaninę testową (Lactate Dehydrogenase Assay Mixture) przez zmieszanie w równych objętościach roztworów: badanego roztworu substratu (LDH Assay Substrate Solution), barwnika (LDH Assay Dye Solution) oraz 1x stężonego LDH Assay Cofactor Preparation.
- Usunąć porcję pożywki do badań (w przybliżeniu połowę objętości pożywki hodowlanej). Następnie, dodać mieszaninę testową LDH (Lactate Dehydrogenase Assay Mixture) do każdej próbki w objętości równej podwójnej objętości pożywki (użytej do badań).
- Tak przygotowaną płytkę należy zakleić nieprzeźroczystą folią, w celu ochrony przed światłem, a następnie płytkę inkubować w temperaturze pokojowej prze ok. 20 do 30 minut.
- Zachodzącą w trakcie inkubacji reakcję można zatrzymać przez dodanie 1/10 objętości 1M HCl – dodanego do każdej studzienki płytki.
- Spektrofotometrycznie zmierzyć absorbancję przy długości fali równej λ= 490 nm. Należy także zmierzyć absorbancję tła płytki wielodołkowej przy λ= 690 nm, po czym odjąć otrzymaną wartość od pierwotnego pomiaru długości fali (przy 490 nm).
- Wyniki z wielostudzienkowych płytkach moga być odczytane dzięki użyciu tzw. czytnika płytek, bądź też zawartość poszczególnych studzienek (dołków) może zostać przeniesiona do kuwet o odpowiednich rozmiarach do pomiaru spektrofotometrycznego [22].
Pomiar aktywności LDH u dzieci z różnymi typami chorób nowotworowychEmad A Al-Saadoon i wsp. (2003) w swoich badaniach przeprowadzili pomiar poziomu aktywności LDH w surowicy pobranej od dzieci ze zdiagnozowanymi róźnymi typami chorób nowotworowych. Ponadto, badali także relację pomiędzy LDH, a odpowiedzią na hemioterapię. Dehydrogenazę mleczanową oznaczano w surowicy w chwili rozpoznania u pacjentów różnych nowotworów zlośliwych (przebadano 53 pacjentów), a także u 37 zdrowych dzieci stanowiących kontrole (dzieci dobrane zostały do kontroli pod względem wieku i płci). Otrzymane wyniki potwierdziły wzrost aktywności LDH w różnych typach nowotworów. Zauważono, że średni poziom LDH był istotnie wyższy u osób z ostrą białaczką limfoblastyczną, w porównaniu z innymi grupami nowotworowymi. Znaczne zmniejszenie LDH zauważono z kolei u osób po chemioterapii. W chłoniakach litych podwyższony poziom enzymu skorelowana z masą guza oraz fazą choroby. Otrzymane wyniki potwierdzają przydatnoś pomiaru LDH- pełni on funkcję markera biologicznego [24].
LDH pełni przede wszystkim funkcje w metabolizmie glukozy, katalizując redukcję wolnego pirogronianu do mleczanu podczas ostatniego etapu glikolizy, jak również przekształcenie mleczanu do pirogronianu podczas glukoneogenezy. Komórki nowotworowe mają charakterystyczny typ metabolizmu, w którym sekwencja glikolityczna i cykl kwasu trikarboksylowego są słabo zintegrowane, stąd komórki nowotworowe dążą do wykorzystania od 5 do 10 razy więcej glukozy w porównaniu do normalnych tkanek (przekształcając większośc do mleczanu).
Glikoliza jest złożonym łańcuchem różnych reakcji, które w ostateczności prowadzą do przekształcenia glukozy w pirogronian. Reakcja ta zachodzi w cytoplazmie (prawie wszystkich) organizmów żywych. Jej głównym zadaniem jest wytwarzanie energii, która następnie gromadzona jest w postaci ATP. Ponadto, dostarcza elementów budujących składniki komórki.
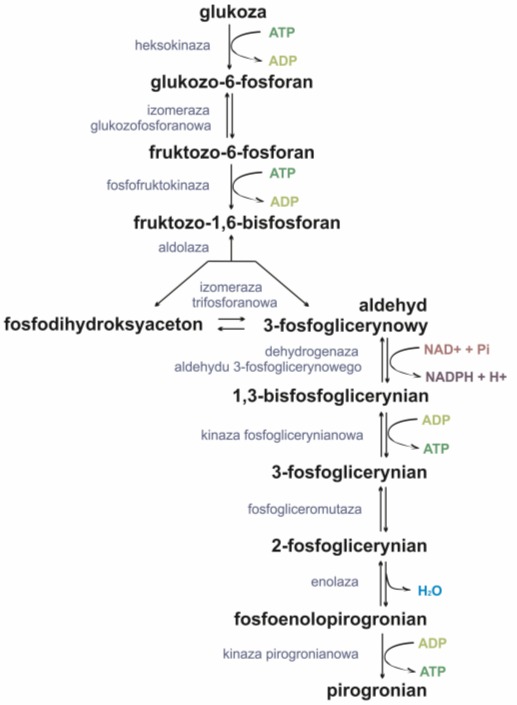
Na cały proces glikolizy składa się 10 reakcji, a wszystkie reakcje można podzielić na 2 główne fazy:
- w pierwszej fazie dochodzi do przekształcenia glukozy we fruktozo-1,6-bisfosforan. Etap ten wymaga zużycia 2 cząsteczek ATP przypadającą na każdą cząsteczkę cukru.
- w drugim etapie następuje rozszczepienie fruktozo-1,6-bisfosforanu na dwa związki,które następnie ulegają wzajemnym przekształceniom. Jednym z powstałych związków jest aldehyd 3-fosfoglicerynowy, który ulega dalszym przemianom (utlenianie i fosforylacja). Zachodzącym reakcjom towarzyszy utworzenie cząsteczki ATP [23].
Zdjęcie: Schemat przebiegu glikolizy, [23].
Dehydrogenaza mleczanowa (LDH) występuje w wielu różnych systemach komórek, w przypadku uszkodzenia tkanek lub komórek, stężenia LDH może być podwyższone. Związek między nowotworami i zwiększonym poziomem LDH został potwierdzony przez wielu naukowców i to zarówno w wielu guzach wykrytych u ludzi, jak i u zwierząt. Podwyższony poziom LDH występują w tkance nowotworowej, jak i w surowicy pacjentów z różnymi typami nowotworów nabłonkowych. Wysoki poziom w surowicy LDH obserwowano u pacjentów z guzami litymi, białaczką, raku płuc i nowotworach jąder. Przeprowadzone badania sugerują, że poziom LDH wydaje się mieć dobrą korelację z aktywnością choroby i masą guza [24].
Aktualnie, znanych jest kilka chorób, których przyczyna jest brak aktywności enzymów glikolitycznych. Zasadniczym objawem wszystkich z nich jest niedokrwistość hemolityczna. W intensywnie rosnących komórkach nowotworowych zauważa się znacznie szybszy przebieg glikolizy. Szybka produkcja pirogronianu powoduje, że znacznie przewyższone są zdolności organizmu do jego metabolizowania, co w konsekwencji prowadzi do nadmiernego wytwarzania mleczanu, a dalej do zakwaszania środowiska w guzie [23].
Autor: Lidia Koperwas
Literatura:
[1].Murray
R.K., Granner D.K., Mayes P.A., Rodwell V.W.,1995. BIOCHEMIA HARPERA,
Wydanie III, Redaktor naukowy tłumaczenia Franciszek Kokot. S.913,
917-918. Wydawnictwo Lekarskie PZWL
[2]. Szutowicz A., Raszei-Szpecht
A., 2009. Diagnostyka laboratoryjna. Tom I.Gdański Uniwersytet
Medyczny, Zlecenie KW/224/09.Recenzent prof. dr hab.Wiesława
Łysiak-Szydłowska. S. 62-63
[3]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.529-531
[4].http://biochemistry.sote.hu/uploads/obi_okt_gra_en/obi_e_tananyag_en/obi_okt_gyakorlatok_en/obi_gya_en_LDH.pdf
[5]. http://www.intmedpress.com/servefile.cfm?suid=5c25afd7-440d-4590-881c-c1d70cf6484e
[6]. http://www.healthline.com/health/lactate-dehydrogenase-test#LDHIsoenzymes
[7]. http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=5892#itabs-2d
[8]. http://analiza.ovh.org/cw/cw2.pdf
[9]. http://pchba.amu.edu.pl/cw%20Fak/cw2.pdf
[10].
Dell E.J., Detection of NADH and NADPH with the Omega’s High Speed,
Full UV/Vis Absorbance Spectrometer , BMG LABTECH, Inc., Durham, USA.
http://www.bmglabtech.com/application-notes/absorbance/spectrometer-nadh-nadph-170.cfm
,
http://www.bmglabtech.com/db_assets/applications/downloads/applications/170-nadh-nadph.pdf
[11].
Ying W., 2008. NAD+/NADH and NADP+/NADPH in cellular functions and cell
death: regulation and biological consequences. Antioxid Redox Signal.
2008 Feb;10(2):179-206. Department of Neurology, University of
California at San Francisco, San Francisco, California 94121, USA.
[12]. http://www.uj.edu.pl/documents/2387936/4117775/cw8.pdf
[13].http://www.healthline.com/health/lactate-dehydrogenase-test#HighLDHLevels
[14]. Hames D.B, Hooper N.M, 2007. Biochemia-krótkie wykłady. Wydanie II, Wydawnictwo Naukowe PAN 2007, s.96-100
[15].
Bryła J., Drożak J., Garstka M., Jagielski A., Jarzyna R., Kiersztan
A., Kaniuga Z., Winiarska K., 2011. Enzymologia I, s. 20-25. Materiały
do ćwiczeń dla studentów kierunku Biotechnologia Wydziału Biologii UW.
Skrypt przygotowany przez pracowników Zakładu Regulacji
Metabolizmu,Instytut Biochemii Wydziału biologii.
http://www.biol.uw.edu.pl/zrm/Skrypty/2011EnzymI.pdf
[16]. http://www.wiener-lab.com.ar/wiener/catalogo/archivos/7702_mg_color_aa_pl.pdf
[17].
BIELLMANN J.F., SAMAMA J.P., BRANDEN C.I., EKLUND H., 1979. X-Ray
Studies of the Binding of Cibacron Blue F3GA to Liver Alcohol
Dehydrogenase. Eur.
J. Biochem. 102, 107-110 (1979). http://onlinelibrary.wiley.com/doi/10.1111/j.1432-1033.1979.tb06268.x/pdf
[18].
Angal S., Dean P.D.G., 1977. The Effect of Matrix on the Binding of
Albumin to Immobilized Cibacron Blue. Biochem J.(1997) 167, 301-303,
http://www.docstoc.com/docs/28020884/Immobilized-Cibacron-Blue
[19]. http://www.biofizyka.p.lodz.pl/ch8.pdf
[20].
Drent M., Cobben N.A.M., Herderson R.F., Wouters E.F.M., van
Dieijen-Visser M., 1996. Usefulness of lactate dehydrogenase and its
isoenzymes as indicators of lung damage or inflammation. Eur Respir J,
1996, 9, 1736–1742 DOI: 10.1183/09031936.96.09081736.
http://erj.ersjournals.com/content/9/8/1736.full.pdf
[21].http://www.laboklin.de/pdf/pl/wetinfo/aktualnosci/2012_01_analizy_wysiekow_oplucnowych.pdf
[22].
Sigma- Aldrich, In Vitro Toxicology Assay Kit, Lactic Dehydrogenase
based. Technical Bulletyn,
http://www.sigmaaldrich.com/etc/medialib/docs/Sigma/Bulletin/tox7bul.Par.0001.File.tmp/tox7bul.pdf
[23]. http://www.e-biotechnologia.pl/Artykuly/glikoliza/
[24].
Al-Saadoon E.A., MRCP (Pead)* Al-Naama L.M, Hassan J.K., 2003. Serum
Lactate Dehydrogenase (LDH) Activity in Children with Malignant
Diseases. Bahrain Medical Bulletin, Vol.25, No. 2, June 2003,
http://www.bahrainmedicalbulletin.com/june_2003/Serum.pdf
[25]. Baba
Ch., Yanagida K., Kanzaki T., Baba M., 2005. Colorimetric lactate
dehydrogenase (LDH) assay for evaluation of antiviral activity against
bovine viral diarrhoea virus (BVDV) in vitro. Antiviral Chemistry &
Chemotherapy 16:33–39. ©2005 International Medical Press


Recenzje