Odkrycie struktury DNA w 1953 roku, a także wykazanie istnienia RNA (co zasugerowało odkrycie rybozy w 1909 roku), stały się przełomem w nauce. Dzisiejsze spektakularne odkrycia, coraz to lepsze możliwości badawcze, a także wszystkie perspektywy związane z istnieniem kwasów nukleinowych potwierdzają, że eksperymenty wykonane na przestrzeni ostatnich 100 lat były kluczowymi dla nauki i dzisiejszego stanu wiedzy. Mowa tu nie tylko o wyodrębnieniu DNA (nukleiny) w 1869 roku przez Friedricha Miescher’a , ale także o poznaniu struktury genomu człowieka na początku XX wieku [5], [2], [6].
Słowa kluczowe: kwasy nukleinowe, DNA, RNA, struktura kwasów nukleinowych, ryboza, deoksyryboza, zasady azotowe, heliks, Watson i Crick, denaturacja DNA, denaturacja DNA, mRNA, rRNA, tRNA.Odkrycie niezwykłych właściwości kwasów nukleinowych było wielkim osiągnięciem naukowym. Dzięki temu, dziś już wiadomo, że informacja genetyczna zakodowana jest wzdłuż cząsteczki polimeru, która złożona jest z 4 rodzajów jednostek monomerycznych [11]. W 1944 roku Avery, MacLeod i McCarty, w serii doświadczeń wykazali, że DNA zawiera informację genetyczną. Badacze w swoich doświadczeniach zaobserwowali, że genetyczna determinacja otoczki swoistych pneumokoków może być przeniesiona do zupełnie innych pneumokoków, charakteryzujących się odmiennym typem otoczki, przez wprowadzenie oczyszczonego DNA od pierwszych pneumokoków, do drugich. Wtedy też naukowcy określili czynnik, za pomocą którego zachodzą wyżej opisane zmiany jako „czynnik transformujący”. Późniejsze doświadczenia wykazały, że było to właśnie DNA [11].
Badania Watsona i CrickaZastosowanie do badania DNA dyfrakcji promieni X wykazało, że kwas deoksynukleinowy ma uporządkowaną, a także powtarzalną strukturę. Fakt ten zachęcał do budowania modeli struktury DNA.
W 1951 roku, po wysłuchaniu wykładu Maurice’a Wilkinsona, James Watson podjął pracę w laboratorium Maxa Pertuza w Cambridge , w którym wykorzystywano techniki dyfraktometryczne do badań struktury. Maurice Wilkins, który badał cząsteczkę DNA w świetle spolaryzowanym, zauważył, że włókna tego kwasu nukleinowego Zbudowane są z długich, równolegle ułożonych cząsteczek. W 1950 roku, uzyskano pierwszy, czysty obraz rozpraszania promieni X na kryształach DNA (M.Wilkins i Reymond Gosling). W styczniu 1950 roku, do zespołu Wilkins’a i Gosling’a dołączyła Rosalind Franklin, która miała duże doświadczenie w pracy z technikami dyfraktometrycznymi oraz w krystalizacji DNA (w komorze dyfrakcyjnej w warunkach kontrolowanej wilgotności). Dzięki temu, uzyskano obraz dyfrakcyjny 2 rodzajów DNA( formy A i B). W styczniu 1953 roku Rosalind Franklin zwróciła uwagę na fakt, że forma A-DNA może zawierać 2 łańcuchy , które biegną w przeciwnych kierunkach. Z kolei, w lutym 1953 roku, Watson i Crick po wielu nieudanych próbach , powrócili do budowy modelu DNA. To właśnie wtedy Watson i Crick zbudowali i zaproponowali znany do dzisiaj model DNA [5],[3],[4], [1], [6]. Wyniki badań Watsona i Cricka zostały opublikowane w „Nature” 23 kwietnia 1953 roku. Wtedy też pojawiły się dwie kolejne publikacje dotyczące struktury DNA. Za odkrycie molekularnej struktury kwasów nukleinowych Francis Crick, James Watson i Maurice Wilkins w 1962 roku, otrzymali Nagrodę Nobla [6].
Z kolei, w 1957 roku, Francis Crick sformułował tzw. centralny dogmat biologii molekularnej. Według niego, kwasy nukleinowe są źródłem jednokierunkowego przepływu informacji, w którym DNA jest matrycą do syntezy RNA, a RNA do biosyntezy białka [3].
Budowa kwasów nukleinowychZarówno DNA jak i RNA są chemicznymi nośnikami informacji genetycznej. Informację tą stanowi odpowiednia kolejność deoksyrybonukleotydów w łańcuchach DNA. Pod wpływem transkrypcji informacja genetyczna przekazywana jest do cytoplazmy jako sekwencja polirybonukleotydowych łańcuchów RNA. Przepisana sekwencja na mRNA tj. jeden z rodzajów kwasów rybonukleinowych, stanowi bezpośrednią matrycę, na której zapisana jest informacja genetyczna w postaci sekwencji aminokwasów. Proces ten znany jest jako translacja [9]. Kwasy nukleinowe występują w formie nierozgałęzionych łańcuchów polinukleotydowych . Kolejne mononukleotydy połączone są wiązaniami 3’5’-fosfodiestrowymi. Dzięki temu tworzony jest ujemnie naładowany rdzeń fosfocukrowy. Od rdzenia odchodzą zasady azotowe [9]. Każdy łańcuch polinukleotydowy ma dwa różne końce, tj. koniec-5’ ( występujący przy 5 atomie węgla rybozy lub deoksyrybozy) i koniec-3’ (przy 3 atomie węgla). W związku z tym, strukturę pierwszorzędowa polinukleotydów (sekwencję nukleotydów) zapisuje się zawsze od końca-5’(z lewej strony), a to dlatego, że koniec ten jest uznawany za początek polinukleotydy [9].
Kwas deoksyrybonukleinowy (DNA) ma masę sięgającą 1,9x106 Da, wielkość 2,6x106 kilozasad(kb) i długość do ok. 12 cm [9]. DNA jest polimerem, który budują jednostki monomeryczne tj. deoksyrybonukleotydy. Każdy taki nukleotyd zbudowany jest z kilku zasadniczych elementów: z zasady azotowej- puryny lub pirymidyny, , cukru oraz grupy fosforanowej (pojedynczej lub wielokrotnej) [7]. Cukier w przypadku DNA jest deoksyryboza, zaś w RNA- ryboza. W związku z tym, w budowie RNA biorą udział rybonukleozydy, a DNA-deoksynukleozydy. W każdym z nukleozydów C-1 cukru połączony jest z zasadą azotową przez jeden z atomów azotu [8 ]. Połączenie cukru z jedną z zasad azotowych, określa się jako nukleozyd. Tak więc w DNA występują 4 rodzaje nukleozydów: deoksyadenozyna (połączenie z adeniną), deoksyguanozyna (połączenie z guaniną), deoksytymidyna (tymina) i deoksycytydyna (cytozyna) [7], [1].
Zasady azotowe, które budują DNA i RNA zaliczane są do związków aromatycznych. Ze względu na budowę, zasady azotowe podzielono na dwie grupy. Jedną stanowią puryny, które budują dwa sprzężone pierścienie węglowo-azotowe. Zaś drugą grupę stanowią pirymidyny. Pirymidyny zawierają pojedynczy pierścień węglowo-azotowy. W związku z tym podziałem purynami są adenina (A) i guanina (G), zaś pirymidynami: tymina(T) i cytozyna (C) [8 ], [1].
Pierwsze badania mające na celu przybliżenie struktury kwasów nukleinowych , wykazały, że zarówno DNA, jak i RNA, zawierają dwie zasady purynowe i dwie pirymidynowe. Zawartość puryn i pirymidyn występuje w przybliżeniu w równomolarnych proporcjach. Przez wiele lat uważano, że kwasy są małymi cząsteczkami, które składają się z jednego powtórzenia każdego nukleotydu. W związku z tym myślano, że tworzą one tetra nukleotyd. Sformułowana w 1931 roku hipoteza tetra nukleotydu, spowodowała, że podjęto systematyczne badania nad składem zasad w DNA.. Próby badania składu zasad w DNA podjęli najpierw Erwin Chargraff, a następnie Arthur Misky. I to właśnie ten drugi w 1943 roku zauważył (opierając się na badaniach Chargraffa), że ilość puryn jest zawsze równa ilości pirymidyn w cząsteczce, czyli A+G=C+T lub (A+G)/(T+C)=1 [3], [2], [9]. Łańcuch w DNA połączone są wiązaniami wodorowymi , które znajdują się między zasadami azotowymi tworzącymi komplementarne pary. Tak więc adenina zawsze tworzy parę z tyminą (łączą je dwa wiązania), a cytozyna zawsze łączy się z guaniną (poprzez wiązanie potrójne) [7], [1].
Szczegółowe badania cząsteczki DNA ujawniły, że w jej obrębie występują tzw. rowki, tj. rowek większy i rowek mniejszy. Rowki wiją się wzdłuż cząsteczki , równolegle do szkieletu fosfodiestrowego. Dzięki rowkom, z cząsteczką DNA mogą oddziaływać różnorodne białka, które wiążą się (głównie przez wiązania wodorowe) ze swoistymi sekwencjami nukleotydowymi. Dzięki temu, nie ma konieczności rozrywania sparowanych zasad w dwupasmowej cząsteczce DNA [11].
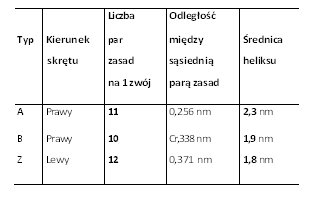
Rodzaje DNADotychczas opisano 6 postaci cząsteczek DNA (dwupasmowych heliakalnych struktur). Tak więc, wyróżniamy postać (formę): A, B, C, D, E oraz formę Z. Większość z tych struktur znaleziono tylko w rygorystycznych warunkach doświadczalnych. Wszystkie formy Dna różnią się między sobą kilkoma, zasadniczymi właściwościami. W związku z tym odróżnia je liczba par zasad (pz), które budują każdy zwój helisy, a także nachylenie (kąt między każdą parą zasad). Ponadto, różnią się średnicą heliksu cząsteczki oraz kierunkiem skrętu, tj. prawy lub lewy skręt podwójnego heliksu.
Z przeprowadzonych doświadczeń wiadomo, że niektóre z postaci DNA ulegają przekształceniu wewnętrznemu, po zadziałaniu na nie np. różnymi stężeniami soli, czy pod wpływem hydratacji [11].
Forma B-DNAPostać B uważana jest za główną, najczęściej pojawiającą się formę DNA w warunkach fizjologicznych. Wystąpieniu tej formy sprzyjają takie warunki jak: małe stężenie soli i duży stopień hydratacji. Wielkość skoku w formie B wynosi 3,4 nm na każdy zwój. Z kolei, na każdy skręt cząsteczki B-DNA przypada 10 par zasad. Jednakże, jak wynika z różnorodnych badań, liczba par zasad przypadających na skręt może się zmieniać między 10,0-10,6 pz [2], [9], [11].
Forma A-DNAOdmianą struktury B, jest forma A-DNA. Powstawaniu tego rodzaju cząsteczki DNA sprzyja środowisko bardziej bogate w jony Na+ i K+, a także mniej uwodnione niż w przypadku B-DNA. Forma A-DNA jest prawoskrętna, a jej cząsteczka zajmuje więcej miejsca w porównaniu do B-DNA. Jest to spowodowane tym, że w cząsteczce tej na jeden skręt przypada więcej par zasad. Forma ta przypomina strukturę dwupasmowego RNA i podwójnego hybrydu DNA-RNA [9], [11], [2].
Formy C, D, E-DNAPrawoskrętne są także formy C-E DNA. Są one obserwowane w bardzo swoistych warunkach doświadczalnych. Według przeprowadzonych badań sądzi się, że formy te nie istnieją in vivo, tylko w warunkach doświadczalnych [11], [2], [9].
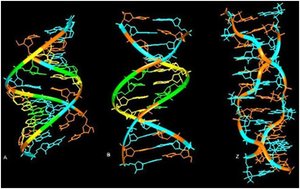 Zdjęcie: Formy A, B i Z-DNA [2].Źródło: http://www.ias.ac.in/currsci/dec102003/1556.pdf Forma Z-DNA
Zdjęcie: Formy A, B i Z-DNA [2].Źródło: http://www.ias.ac.in/currsci/dec102003/1556.pdf Forma Z-DNAForma Z zawdzięcza swą nazwę biegnącemu zygzakowato wzdłuż cząsteczki szkieletowi fosfodiestrowemu. Z-DNA jest podwójną, lewoskrętną helisą, która w porównaniu do pozostałych form jest najmniej skręcona. Na jeden skręt w cząsteczce przypada 12 pz (na zwój). Heliks charakteryzuje się najmniejszą znaną średnicą (2 nm), a ponadto występuje tylko jeden rowek. Z-DNA są sekwencjami naprzemiennie powtarzających się deoksynukleotydów purynowych i pirymidynowych, jednakże potrzebne są także odpowiednie warunki stabilizujące cząsteczkę. Wśród nich wymienia się m.in. obecność dużego stężenia soli, wiązanie białek, które są swoiste dla Z-DNA, czy duży stopień ujemnego skręcenia DNA. Obecność formy Z-DNA stwierdzono u muszki owocowej Drosophila melanogaster . Dokonano tego za pomocą przeciwciał, które mają zdolność rozpoznawania, a nastepnie wiązania się do Z-DNA. Ponadto, badania ujawniły, że w ludzkim DNA występują regiony, rozproszone w Abebie całego genomu, które mogą stanowić potencjalne odcinki do utworzenia postaci Z-DNA [11], [10], [9].
Tab. Cechy niektórych struktur DNA
Źródło: Biochemia Harpera, rozdz.37, str.446.Funkcje DNAInformacja genetyczna zapisana w postaci sekwencji nukleotydowej DNA, pełni dwie główne funkcje. Po pierwsze, jest ona źródłem informacji do syntezy wszystkich cząsteczek białek. Ponadto, dostarcza informację, która dziedziczona jest przez komórki potomne i potomstwo. W związku z tym, obie funkcje stawiają wymóg, że DNA musi służyć jako matryca (do transkrypcji informacji na RNA), a także do replikacji informacji (dla potomnych cząsteczek DNA) [11].
Kwas rybonukleinowy- RNAObok kwasu deoksyrybonukleinowego (DNA) w komórce żywej występuje także kwas rybonukleinowy (RNA) [5]. RNA jest długim i nierozgałęzionym polimerem. Budują go nukleotydy, które połączone są wiązaniami 3’5’ fosfodiestrowymi. Pod względem budowy RNA różni się od DNA dwoma cechami. Po pierwsze, cukrem budującym RNA jest ryboza, Ryboza zawiera grupę 2’-hydroksylową (grupa ta nie występuje w DNA). Po drugie, jedną z głównych zasad azotowych budujących RNA jest uracyl (U). Uracyl łączy się komplementarnie z adeniną. Ponadto, cząsteczki RNA mogą występować w formie jedno- lub dwuniciowej [7]. RNA nie magazynuje informacji dziedzicznej, jego zadaniem jest tylko jej przekazywanie z jądra komórkowego do cytoplazmy [10].
Rodzaje RNAInformacyjny RNA- mRNAKwas ten powstaje na matrycy jądrowego DNA ( zgodnie z regułą komplementarności), odpowiedzialny jest za przekazywanie informacji genetycznej do cytoplazmy. Tam bierze udział w biosyntezie białka, czyli procesie określanym jako transkrypcja (tj. proces powstawania mRNA na matrycy DNA). Następnie zachodzi biosynteza białek , która odbywa się na podstawie informacji zakodowanej w mRNA (proces translacji). mRNA występuje w postaci pojedynczego łańcucha polinukleotydowego [10]. Informacyjny RNA stanowi ok. 5% wszystkich kwasów, które występują w komórce [9].
Rybosomalny RNA- rRNARybosomalny RNA jest składnikiem wchodzącym w skład rybosomów. Z kolei, rybosomy są organellami, które w komórce odpowiedzialne są za produkcję białek [10]. rRNA występuje w postaci jednoniciowych polirybonukleotydów, stanowi on ok. 80% komórkowego RNA. Masa cząsteczkowa rRNA jest zazwyczaj bardzo dużo, a to dlatego, że może on zawierać kilka tysięcy nukleotydów(na pojedynczą cząsteczkę). W komórkach eukariotycznych zidentyfikowano 4 rodzaje rRNA. Jest to 28S rRNA (wielkocząsteczkowy rRNA), którego łańcuch polirybonukleinowy buduje 4718 nukleotydów, oraz 18S rRNA. Mniejsza cząsteczka ( 18SrRNA) składa się z 1874 reszt nukleotydowych. Niskocząsteczkowe rRNA dzieli się jeszcze na mniejsze jednostki : jedną z nich jest 5,8S rRNA, który występuje tylko u eukariontów, a drugą 5S rRNA- występujący u eukariontów i u prokariotów. Z kolei, w komórkach prokariotycznych występuje 3 rodzaje rRNA, a mianowicie: 23S rRNA, 16S rRNA oraz 5S rRNA [9].
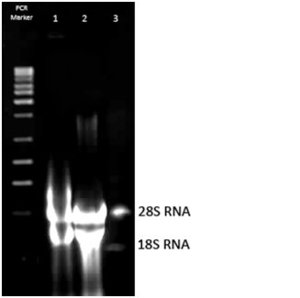 Zdjęcie: Wielkocząsteczkowe i niskocząsteczkowe rRNA izolowane z komórek drożdżowych. Źródła własne, autor: L. KoperwasTransportowy RNA- tRNA
Zdjęcie: Wielkocząsteczkowe i niskocząsteczkowe rRNA izolowane z komórek drożdżowych. Źródła własne, autor: L. KoperwasTransportowy RNA- tRNATen rodzaj RNA bierze udział w procesie translacji. Jego główną funkcją jest dostarczanie na teren rybosomów aminokwasów, które są niezbędne do budowy cząsteczek odpowiednich białek. Należy zaznaczyć, że każda cząsteczka transportowego RNA przyłącza zawsze tylko jeden, specyficzny dla siebie aminokwas. tRNA zawiera krótkie fragmenty, które mają postać podwójnego heliksu (w miejscach występowania na przeciwko siebie komplementarnych zasad azotowych) [10]. Transportujący RNA występuje w ok. 15% w komórce. Cząsteczki tego kwasu są małe, ich liniowa sekwencja może składać się z 60-95 nukleotydów, jednak zazwyczaj występuje ich 76. W strukturze pierwszorzędowej odnotowuje się występowanie licznych, liniowo oddalonych sekwencji. To właśnie one nadają cząsteczce tRNA określoną strukturę przestrzenną [9].
Tak więc wszystkie rodzaje RNA występujące w komórce zaangażowane są w proces biosyntezy białka. mRNA przekazuje informację genetyczną DNA z jądra komórkowego do cytoplazmy, a następnie tRNA umożliwia kolejne przyłączanie aminokwasów do powstającej cząsteczki białka. To wszystko odbywa się zgodnie z informacją zakodowaną w mRNA [10].
Specyficzne właściwości kwasów nukleinowychWedług przeprowadzonych badań, jedną z cech charakterystycznych kwasów nukleinowych jest to, że wykazują one różną wrażliwość na środowisko zasadowe i kwasowe. Wyniki przeprowadzonych badań wskazują, że kwas deoksyrybonukleinowy (DNA) jest odporny na działanie mocnych zasad. W przeprowadzonym w tym celu doświadczeniu, zastosowano 1M NaOH, w którym pozostawiono wyizolowane wcześniej DNA (na okres 20-40h, w temp. 37 ˚C). W tych warunkach kwas RNA rozpada się całkowicie do mieszaniny 2- i 3-monofosfonukleozydów. Spowodowane jest to obecnością grupy –OH przy atomie C-2’rybozy. Brak tej grupy w kwasie DNA jest podstawą jego oporności na działanie zasad [9]. Ponadto hydroliza kwasów nukleinowych jest przyczyną powstawania różnych jej produktów, które zależą zarówno od stężenia zastosowanych kwasów, czasu trwania procesu hydrolizy, jak i zastosowanej temperatury w przeprowadzanym doświadczeniu.
W doświadczeniu, w którym krótkotrwale ogrzewa się kwasy DNA i RNA (w 100˚C) z kwasami , np. HCl o niskim stężeniu (np. 1M), początkowo powstały kwasy apurynowe (tj. kwasy pozbawione łańcuchów purynowych), a następnie po dłuższej hydrolizie kwasowej (po ogrzewaniu przez 1h), powstały mononukleotydy pirymidynowe, pentozy oraz kwas fosforowy [9].
W doświadczeniu, w którym na DNA i RNA podziałano mocnymi kwasami mineralnymi (72% roztwór HClO4) , a także podwyższoną temperaturą, tj. 100˚C przez 1h, spowodowało, że z DNA i RNA zostały uwolnione zasady purynowe i pirymidynowe, oraz pentozy i kwas fosforowy. Kwasy w tym doświadczeniu uległy całkowitej hydrolizie [9].
Denaturacja i renaturacja kwasów nukleinowych
Podczas procesu denaturacji, w kwasach nukleinowych zostaje zniszczona II- i III-rzędowa struktura. Wśród czynników, które denaturują DNA wymienia się: wysokie pH, alkohole, fenole, a także wysoką temperaturę, ultradźwięki i promieniowanie.
W warunkach doświadczalnych, do indukcji procesu denaturacji używa się formamidu (HCONH2) i mocznika (H2NCONH2). Związki te odpowiedzialne są za rozrywanie wiązań wodorowych cząsteczek wody przez co uniemożliwiają umiejscowianie się wody pomiędzy zasocjowanymi warstwowo hydrofobowymi zasadami azotowymi, doprowadzając tym samym do denaturacji kwasów nukleinowych [9]. Proces denaturacji jest odwracalny. W tym celu należy usunąć czynnik denaturujący. Wtedy też ma miejsce odtworzenie komplementarnej struktury podwójnej helisy DNA. Zjawisko to określa się mianem renaturacji [9].
Badania kwasów nukleinowych w Polsce
W połowie ubiegłego wieku, w Warszawie zostały zainicjowane przez David’a Shugar’a badania nad uszkodzeniami kwasów nukleinowych przez promieniowanie ultrafioletowe i promieniowanie gamma. Zespół badawczy D. Shugar’a w latach 1950-1970 był jednym z wiodących na świecie, pod względem tematyki wpływu promieniowania na uszkodzenie DNA. Przeprowadzone przez ten zespół badania nad termodynamiczną stabilnością dwuniciowych, a także syntetycznych polirybonukleotydów, potwierdziły budowę modelu DNA przedstawionego przez Watsona i Cricka [5].
Choć kwasów nukleinowe badane są od ponad 100 lat, to nadal prowadzone są doświadczenia, które mają na celu zgłębienie struktury i właściwości tych małych, a jakże niezwykłych i niezbędnych cząsteczek.
Autor: Lidia Koperwas
Literatura:[1]. Pray L.A, 2008. Discovery of DNA Structure and Function : Watson and Crick. Nature Education 1(1). http://www.nature.com/scitable/topicpage/discovery-of-dna-structure-and-function-watson-397
[2]. Bansal M, 2003. DNA strukturę: Revisiting the Watson-Crick double helix. CURRENT SCIENCE, VOL. 85, NO. 11, 10 DECEMBER 2003
[3]. Gabryelska M.M, Szymański M, Braciszewski J, 2009. DNA-cząsteczka, która zmieniła naukę. Krótka historia odkryć. NAUKA 2/2009, s.111-134.
[4]. Josè Maria Riol Cimas, 2008. J.Watson y F.Crick ADN, LA MOLÈCULA DE LA VIDA. Diario de Avisos sábado 6 de diciembre 2008. http://www.losimprescindiblesdelaciencia.es/artpdf/19b.pdf
[5]. Braciszewski J, Markiewicz W.T. Kwasy nukleinowe. Kod genetyczny. http://fundacjarozwojunauki.pl/res/Tom1/Nauka%20swiatowa%20i%20polska%5B1%5D.Rozdzial%2002.pdf
[6]. Molecular Structure of Nucleic Acids,1953. NATURE, Vol 171, No .4356.
[7]. Stryer L, 2003. Biochemia. Przekład zbiorowy pod redakcją: Augustyniak J, Michejda J, z czwartego wydania amerykańskiego. Wydawnictwo Naukowe PWN, Warszawa 2003, s. 76-83, 91-92.
[8 ]. Hames D.B, Hooper N.M, 2007. Biochemia-krótkie wykłady. Wydanie II, Wydawnictwo Naukowe PAN 2007, s.167-170,
[9]. Żak I, Kwasy nukleinowe. http://biochigen.slam.katowice.pl/podrecznik/19.pdf
[10]. Nalepa G,1995. Genetyka, wydanie II. Wyd. Helion, s.61-64
[11]. Murray R.K, Granner D.K, Mayes P.A, Rodwell V.W, 1995. Biochemia Harpera, wydanie III. Edycja 22. Wydawnictwo Lekarskie PZWL, Warszawa 1995, s. 443-453.





Recenzje