Apoptoza, zwana również programowaną śmiercią komórki jest procesem niezwykle ważnym dla prawidłowego funkcjonowania organizmu. Jest to rodzaj śmierci samobójczej, altruistycznej. To za jej pomocą komórki poświęcają się na rzecz innych komórek organizmu. 
Proces apoptozy jest kluczowy w utrzymywaniu homeostazy organizmu- pomiędzy ilością komórek wytwarzanych, a tymi, które muszą ulec zniszczeniu( komórki uszkodzone, zmutowane, zbędne). W momencie, w którym apoptoza nie może być uruchomiona, dochodzi do powstawania różnorodnych skutków ubocznych . To właśnie z zaburzeniami tego procesu, kojarzone jest wystąpienie takich chorób jak zawał serca, udar mózgu czy nawet wystąpienie AIDS.Ponadto brak apoptozy w komórce doprowadza do rozwoju nowotworów. Apoptoza może być przeprowadzana na drodze dwóch głównych szlaków: szlaku wewnętrznego i zewnętrznego. Cały proces zależny jest od wielu specyficznych czynników, w tym od bardzo ważnych białek określanych jako białka pro- i antyapoptotyczne.
Komórki ulegające apoptozie przechodzą szereg przemian, zarówno na poziomie morfologicznym, jak i biochemicznym. Aktualnie prowadzone są badania mające na celu uruchomienie procesu apoptozy w komórkach nowotworowych, które normalnie jej nie podlegają.
Słowa kluczowe: apoptoza, morfologia komórki apoptotycznej, szlak wewnętrzny i zewnętrzny, białka antyapoptotyczne, białka proapoptotyczne, choroby związane z zaburzeniami apoptozy.Osoby dorosłe każdego dnia wytwarzają i tracą od 50 do 70 bilionów komórek. W przeliczeniu na sekundę liczba ta odpowiada ok. 1 milionowi komórek. I choć ciężko to sobie wyobrazić, to właśnie mniej więcej tyle komórek musi ulec zniszczeniu z każdą sekundą w naszym organizmie, by mógł on prawidłowo funkcjonować. W warunkach fizjologicznych, prawidłowych, procesy wytwarzania i degradowania komórek są ściśle ze sobą powiązane. Również ostateczna liczba komórek w organizmie jest ściśle ustalona, dlatego też każda dłużej utrzymująca się zmiana ich ilości, może mieć bardzo negatywny wpływ na nasze zdrowie [7].
Właśnie dlatego, programowana śmierć komórek- apoptoza ma tak duże znaczenie. To dzięki niej eliminowane są zbędne bądź uszkodzone komórki. W momencie gdy komórki wykazują odporność na śmierć na drodze apoptozy, może dojść do rozwoju nowotworów bądź autoimmunizacji [7]. Jeżeli z kolei komórki są bardzo podatne na apoptozę i w konsekwencji eliminowanych jest wiele komórek, to taki niekontrolowany proces może doprowadzić do rozwoju niektórych chorób degeneracyjnych lub być przyczyną pojawienia się ostrej niewydolności narządowej[7].
Po raz pierwszy termin apoptoza( pochodzący z greckich słów: ‘’apo”- oddzielony i „ptosis”- padać) znaczący w dokładnym tłumaczeniu „opadanie liści”, został użyty w 1972 roku przez Kerra, Wyle’a i Currie. Uczeni użyli tego słowa do określenia genetycznie zaprogramowanej śmierci komórek (ang. PCD- programmed cell death) [6], [1]. Zjawisko apoptozy charakteryzuje szereg stopniowo zachodzących przemian, zarówno tych morfologicznych- towarzyszących komórce apoptotycznej , jak i biochemicznych. Wszystkie zmiany w komórce objętej apoptozą determinowane są ekspresją odpowiednich genów, które są stale zaangażowane w ten złożony proces [6].
Apoptoza odgrywa istotną rolę w takich procesach jak np. embriogeneza, homeostaza komórkowa, atrofia tkanek, a także w procesie regresji nowotworów[1].Dzięki apoptozie organizm ma możliwość kontrolowania ilości komórek- zarówno pod względem ilościowym jak i jakościowym. Apoptoza stwarza możliwość usuwania niepotrzebnych, zużytych bądź uszkodzonych komórek(zmutowanych czy zainfekowanych) [1], [6]. Usuwanie nieprawidłowych komórek dotyczy głównie tych, które z czasem mogłyby stać się groźne dla samego gospodarza. Wśród nich wymienia się komórki nowotworowe[1].Tak więc apoptoza jest zjawiskiem zaplanowanym, jest samobójstwem komórki ale i zjawiskiem naturalnym w rozwoju i życiu organizmów żywych[1].Sam proces apoptozy jest wpisany w prawidłowe funkcjonowanie organizmu. Dzięki niej zastaje zachowana homeostaza – równowaga między proliferacją komórek a ich eliminacją[8].
Ponadto, apoptoza jest procesem aktywnym, który podlega zarówno zewnątrzkomórkowej jak i wewnątrzkomórkowej regulacji- prowadzącej w ostateczności do autodestrukcji komórki[2]. Co ciekawe, apoptoza ma wpływ na powstawanie w organizmie wielu schorzeń, np. infekcji wirusowych, chorób autoimmunologicznych, neurodegeneracyjnych czy na rozwój miażdżycy i nowotworów[2].
Zanim zaczęto badać zjawisko apoptozy, bardzo długo zastanawiano się nad wyborem właściwego organizmu eksperymentalnego, który miałby posłużyć do obserwacji procesów różnicowania się komórek [11]. Nie mógł to być organizm skomplikowany- i to zarówno pod względem budowy, jak i wymagań życiowych. Musiał dawać się łatwo hodować, a jego rozwój nie mógł trwać zbyt długo.
Po długim czasie poszukiwań- wykorzystując jako organizm modelowy nicienia Caenorhabditis elegans, uczeni zwrócili uwagę na fakt, że śmierć określonej liczby komórek jest niezbędnym procesem w rozwoju każdego zarodka [11]. Zauważono, że aby cały rozwój organizmu przebiegał prawidłowo, musi być zachowana równowaga pomiędzy podziałami komórkowymi, a ich śmiercią. Ze względu na to, że C. elegans jest organizmem wielokomórkowym, lecz mimo wszystko niezbyt skomplikowanym, to właśnie na nim możliwe było dokładne śledzenie procesów zachodzących podczas różnicowania. Ponadto C. elegans o długości ciała ok. 1 mm charakteryzował się bardzo szybkim tempem rozwoju, co znacznie skracało czas oczekiwania na przeprowadzenie dalszych badań i obserwacji. Przeźroczystość jego ciała umożliwiła obserwację podziałów komórkowych bezpośrednio pod mikroskopem, co z kolei znacznie ułatwiło pracę uczonych [11].
Pierwsze badania z wykorzystaniem C. elegans rozpoczęły się w latach 60-tych. Temu ciężkiemu wyzwaniu podjął się Sydney Brenner, następnie inny naukowiec- John Sulston opierając się na badaniach S. Brennera opracował metody umożliwiające badanie wszystkich podziałów komórkowych, które zachodzą w organizmie nicienia C.elegans . Badania te zaowocowały i w 1976 roku J. Sulston analizując część rozwijającego się układu nerwowego u C.elegans, opisał szereg rozwojowy jego komórek. Tym samym J.Sulston wykazał, że każdy nicień przechodzi identyczny program podziału komórek, a także identyczne procesy ich różnicowania [11].
Badania S. Brennera i J. Sulstona, z czasem kontynuował Robert Horvitz. I to właśnie on w 1966 roku w swojej pionierskiej pracy doniósł o odkryciu 2 genów, określanych jako „geny śmierci”. Nazwał je ced-3 i ced-4. R. R.Horvitz wykazał, że zidentyfikowane przez niego geny (prawidłowo funkcjonujące) są niezbędne do uruchomienia procesu programowanej śmierci komórek. W późniejszych badaniach odkrył, że inny gen (określany jako ced-9) , chroni komórki przed programowaną śmiercią [11].
Apoptoza zwana również programowaną śmiercią komórki (ang. PCD - programmed cell death), jest zjawiskiem występującym zarówno w warunkach fizjologicznych komórki, jak i jej stanach patologicznych [14]. Określenie „programowana śmierć komórki” zostało wprowadzone w celu podkreślenia, że jest to śmierć komórki regulowana genetycznie- śmierć samobójcza [18].Apoptoza jest procesem ściśle uporządkowanym, zachodzącym zawsze według określonego schematu. Tak jak wcześniej wspomniano, zjawisko to odgrywa wiele ważnych funkcji w organizmie. Odpowiada za takie procesy fizjologiczne jak embriogeneza, wzrost i rozwój narządów, a także bierze udział w odnowie komórek i tkanek [14]. Jej celem jest eliminowanie niepotrzebnych i starych komórek, a także komórek często występujących nadmiarze [13].
W porównaniu do procesu martwicy, apoptoza jest zjawiskiem przebiegającym dyskretnie i niezauważalnie. Jednakże towarzyszy jej wiele zmian- zarówno na poziomie morfologicznym jak i biochemicznym [9], [14], [2].
Apoptoza dotyczy zazwyczaj pojedynczych komórek. Komórka w której zostaje zapoczątkowana apoptoza początkowo ulega oddzieleniu od innych komórek i stopniowo traci wodę, co prowadzi do jej obkurczenia. Powierzchnia komórki apoptotycznej ulega charakterystycznemu pofałdowaniu [14]. Obkurczająca się komórka traci kontakt z sąsiadującymi z nią komórkami[6]. W jądrze komórkowym dochodzi do zagęszczenia chromatyny jądrowej w zbitą masę i gromadzenia się jej w okolicach błony jądrowej [6]. Następnie zagęszczona chromatyna wypełnia całe jądro komórkowe, co prowadzi do zmniejszenia jego rozmiarów i powstania tzw. jądra pyknotycznego . Wraz z dalszym zmniejszaniem się komórki, następuje rozpad jądra komórkowego na kilka mniejszych fragmentów. Równocześnie zachodzą zmiany w budowie błony komórkowej, która tworzy charakterystyczne dla apoptozy uwypuklenia. Na tym etapie powstają tzw. ciałka apoptotyczne, określane również jako anoikis [2]. Ciałka otoczone są fragmentami błony komórkowej, a w ich wnętrzu znajdują się nieuszkodzone organelle komórkowe oraz rozfragmentowana chromatyna [14],[17],[13].
Ciałka apoptotyczne usuwane są w organizmie przez makrofagi lub sąsiadujące komórki, dzięki czemu nie dochodzi do powstania stanu zapalnego w organizmie [4], [6]. Kolejnym charakterystycznym znacznikiem procesu apoptozy jest międzynukleosomalna fragmentacja DNA. W wyniku degradacji powstają fragmenty DNA liczące od 180 do 200 par zasad, lub ich wielokrotności. [14]. Zachodzi takżestopniowe gęstnienie cytozolu [6].
Jednym z najwcześniejszych zjawisk towarzyszących apoptozie jest zaburzenie asymetrii w rozmieszczeniu fosfolipidów błony komórkowej. Na powierzchni komórki pojawia się fosfatydyloseryna, która w normalnych warunkach jest składnikiem błon wewnątrzkomórkowych [14]. Dzieje się tak, ponieważ zapoczątkowanie szlaku apoptotycznego powoduje uaktywnienie się specyficznego białka błonowego, znanego jako floppaza. Floppaza odpowiedzialna jest za przenoszenie fosfatydyloseryny na powierzchnię komórki[14]. Apoptoza jest procesem, który wymaga syntezy ATP, a także syntezy odpowiednich białek i utrzymania ciągłości błony komórkowej. W trakcie trwania tego procesu dochodzi do aktywacji nukleaz i proteaz, a tym samy zachodzi degradacja proteolityczna i nukleolityczna [6].
Po raz pierwszy takie objawy towarzyszące śmierci komórek opisał w 1885 roku Walther Fleming. Jednakże proces ten nie został poprawnie określony jako apoptoza, lecz nazwano go chromatolizą[6]. W 1995 roku za sprawą Levin’a wyróżniono podział apoptozy w zależności od czynnika, który ją wywołuje. I tak sklasyfikowano apoptozę fizjologiczną, toksyczną oraz kompensacyjną. Apoptoza fizjologiczna to ta, która towarzyszy rozwojowi organizmu i doprowadza do utrzymania jego prawidłowej homeostazy [6]. Termin apoptoza toksyczna odnosi się do tego rodzaju przemian, które powodowane są za pośrednictwem różnego rodzaju środków chemicznych, bakterii czy w skutek niedotlenienia narządów. Jej efektem końcowym jest uszkodzenie zdrowej komórki. Z kolei apoptoza kompensacyjna doprowadza do obumierania komórek, powodując tym samym wyrównanie nieprawidłowego wzrostu ich podziałów( dzieje się tak np. w przypadku nowotworów wątroby)[6].
Proces apoptozy regulowany jest za pomocą odpowiednich białek, tzw. białek pro- i antyapoptotycznych. To właśnie te białka decydują ile komórek ulegnie apoptozie[1].
Początkowym etapem apoptozy jest tzw. faza inicjacji, która w zależności od organizmu ma różny przebieg. W trakcie trwania inicjacji, zostaje podjęta decyzja o śmierci komórki, oraz tego jaki czynnik zewnętrzny lub wewnętrzny ją zainicjował[6]. Następnie dochodzi do aktywacji wewnątrzkomórkowych kaspaz, które są bezpośrednio odpowiedzialne za śmierć komórki [6]. Enzymami tymi są kaspazy- grupa enzymów proteolitycznych[1].
Uruchomienie całego procesu apoptozy wiąże się aktywacją lub unieczynnieniem działania niektórych białek, stale występujących w komórce. To w jaki sposób będzie zachodzić programowana śmierć komórki, zależy od jej typu i bodźców, które ten proces zapoczątkują[6]. Białka pro- i antyapoptotyczne, a także kaspazy, określane są mianem markerów apoptozy, co znaczy, że są one zawsze obecne podczas trwania tego skomplikowanego zjawiska[1].
Kaspazy są znane także jako tzw. proteazy cysteinowe, są wewnątrzkomórkowymi enzymami, które działają na zasadzie przecinania cząsteczek białek po określonej sekwencji aminokwasów[6]. Poszczególne rodzaje kaspaz różnią się między sobą zarówno sposobem aktywacji, jak i swoistością substratową[6].Z kolei to, co łączy wszystkie kaspazy, to fakt , żewszystkie enzymy występują w komórkach w postaci nieaktywnych zymogenów - prokaspaz [15],[6].
Kaspazy zaangażowane w przebieg procesu apoptozy klasyfikowane są jako kaspazy inicjatorowe i kaspazy egzekutorowi. Zaliczane są do nich kaspazy: 8, 9 i 10, a także kaspaza 3, 6 i 7. Aktywacja kaspaz inicjatorowych nieuchronnie powoduje aktywację tzw. kaskady kaspaz [16]. Wszystkie kaspazy aktywowane są hierarchicznie: najpierw kaspazy inicjatorowe (występujące w początkowej fazie apoptozy) , a następnie kaspazy efektorowe. [4]. Jednakże za jedną z najważniejszych kaspaz wykonawczych procesu apoptozy uważa się kaspazę-3. Jest ona odpowiedzialna m.in. za kondensację chromatyny i degradację DNA. W badaniach, pomiar aktywności kaspazy-3 służy do oceny zaawansowania procesu apoptozy [15].
Odpowiednie kaspazy są uruchamiane w komórce w sposób lawinowy( aktywacja jednej kaspazy prowadzi do uruchomienia olejnych- kaskady kaspaz). Proces ten doprowadza do nieodwracalnego zniszczenia komórki[8]. Najpierw uruchomiane są kaspazy efektorowe, a następnie egzekutorowe. Cały proces aktywacji enzymów odbywa się za pośrednictwem receptorów błonowych, należących do rodziny TNF(ang. tumor necrosis factor- czynnik martwicy nowotworów)[8].
Białka należące do rodziny białek Bcl-2 odgrywają bardzo ważną rolę regulacyjną w procesie apoptozy. Białka te zostały podzielone na dwie podrodziny. Jedną z nich tworzą białka antyapoptotyczne: Bcl-2, Bcl-XL, Bcl-w i Mcl-1, a drugą proapoptotyczne: Bax ,Bak oraz Bik, Bad, Bid, Bim, NOXA i PUMA. [4], [13]. Głównym zadaniem białek proapoptotycznych jest tworzenie porów w błonie mitochondrialnej. Dzięki temu następuje uwolnienie z przestrzeni międzybłonowej mitochondrium do cytozolu różnych czynników apoptotycznych. Z kolei uwalnianie tych czynników może zostać zahamowane przez białka antyapoptotyczne. [12]. Białka Bcl-2 i Bcl-XL występując w bezpośrednim sąsiedztwie błon komórkowych, hamują apoptozę. [10].
Za jeden z głównych czynników proapoptotycznych uważa się gen p53. Pod kontrolą tego genu znajduje się białko Bcl-2 [4]. Aktywacja procesu apoptozy następuje w momencie, gdy uszkodzenie genomu komórki jest zbyt duże, aby mogła nastąpić jego samoistna naprawa [9]. Tak więc, produkt genu-białko p53, uruchamia proces samobójczej śmierci w przypadku poważnego uszkodzenia DNA. Gdy uszkodzenie genomu jest niewielkie dochodzi jedynie do zatrzymania wzrostu komórek w określonej fazie ich cyklu rozwojowego [5]. W związku z tym, białko to uważane jest za „strażnika genomu”. Decyduje ono o tym, czy komórka zatrzyma podziały komórkowe w celu naprawienia powstałych uszkodzeń, czy też od razu wejdzie w fazę apoptozy [4].
Cały proces zaplanowanej, samobójczej śmierci komórek, regulowany jest na drodze dwóch głównych mechanizmów. Jednym z nich jest aktywacja tzw. receptorów śmierci, znana również jako szlak „zewnętrzny”, zaś drugi mechanizm to tzw. szlak „wewnętrzny” powiązany z mitochondriami[1].
Szlak zewnętrzny aktywowany jest pobudzeniem receptorów śmierci, należących do nadrodziny receptorów TNF (ang. tumor necrosis factor) [4].Wspólną cechą receptorów śmierci jest posiadanie wewnątrzkomórkowej domeny śmierci (ang. death domain, DD) .Domeny śmierci są niezbędne do aktywacji procesu apoptozy[1].Wśród receptorów wyróżnia się: receptory CD95, TRAIL-R1 i R2 (ang. TNF-related apoptosis-inducing ligand-R1,R-2) . To właśnie do nich wiążą się określone ligandy, a następnie, po procesie oligomeryzacji zostaje utworzony promujący apoptozę kompleks zwany DISC (ang. death-inducing signaling complex- kompleks sygnalny indukujący śmierć)[4], [1].DISC powstaje przez połączenie domen śmierci z białkami adaptorowymi FADD (ang. Fas associated death domain protein) , oraz prokaspazą-8 [4]. W niektórych przypadkach, w komórce może dojść do wzmocnienia sygnału za pośrednictwem mitochondriów, ponieważ aktywna kaspaza-8 zdolna jest do proteolizy proapoptotycznego białka Bid, które aktywne (tzw. tBid-ang. truncated Bid), ma zdolność przemieszczania się do mitochondriów. Działanie takie umożliwia innym białkom wbudowanie się w zewnętrzną błonę mitochondrialną, co z kolei skutkuje wypływem cytochromu-c z przestrzeni międzybłonowej [4], [14].
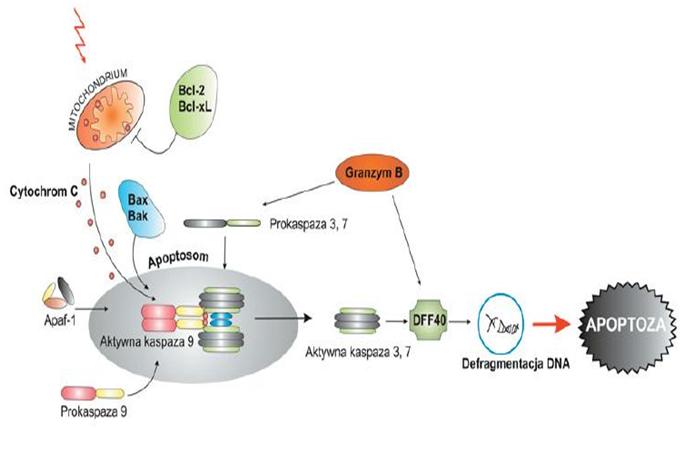 Rys.
Rys. Schemat przebiegu szlaku apoptozy związanego z uwalnianiem cytochromu C z mitochondrium (szlak mitochondrialny).Słupianek A ,Pytel D , Majsterek I, 2007. Rola onkogennych kinaz tyrozynowych w odpowiedzi komórek na terapię przeciwnowotworową, Postepy Hig Med Dosw. (online), 2007; 61: 819-827http://www.phmd.pl/fulltxthtml.php?ICID=621738
Podczasprzebiegu szlaku wewnętrznego dochodzi do zachwiania równowagi między ilością wytwarzanych białek pro- i antyapoptotycznych, w konsekwencji, zjawisko to ma negatywny wpływ na zachowanie prawidłowego rozwoju komórki[1].Szlak wewnętrzny apoptozy związany jest bezpośrednio z udziałem mitochondriów, w których dochodzi do zmiany w przepuszczalności błony pod wpływem białek proapoptotycznych[1].Szlak ten indukowany jest różnego rodzaju stresem, który zadziała na daną komórkę[4]. Kluczowym momentem jest wypływ cytochromu-c z przestrzeni międzybłonowej, przez kanały utworzone przez białka Bcl-2. Grupa tych białek uważana jest za regulatory apoptozy związanej z wypływem cytochromu-c (cyt c) . To właśnie wypływ cytochromu c jest sygnałem do tworzenia specyficznego kompleksu określanego mianem apoptosomu[1].Powstanie apoptosomu rozpoczyna się od związania cyt-c z białkiem Apaf-1 (ang. apoptotic protease activating factor-1) , ATP i prokaspazą-9 [4], [14]. Następnie prokaspaza-9 aktywuje efektorową kaspazę 3 [14]. Tak więc, apoptosom aktywuje kaskadę kaspaz, co w ostateczności prowadzi do destrukcji komórki[1].
Obydwie drogi wejścia w apoptozę prowadzą do aktywacji kaspazy-3. Kaspaza-3 jest enzymem egzekutorowym, który pośrednio przyczynia się do fragmentacji DNA [4]. Dzieje się tak, ponieważ kaspaza-3 przeprowadza proteolizę inhibitora endonukleaza (DFF45/ICAD) , czego wynikiem jest aktywacja endonukleaza DFF40/CAD (ang. DNA fragmentation factor 40 kDa/caspase-activated deoxyribonuklease) . Następnie endonukleaza przechodzi do jądra i tnie DNA na odcinki będące wielokrotnością nukleosomów. [4].
Apoptoza jest zjawiskiem obecnie bardzo intensywnie badanym. Dotychczas opracowano szereg metod umożliwiających identyfikację komórek apoptotycznych. Wśród nich wyróżnia się mikroskopię- zarówno świetlną jak i fluorescencyjną, a także elektronową, immunocytochemię, Westren Blot i coraz bardziej popularną i rozwijającą się- cytometrię przepływową. Dzięki tak szeroko rozwiniętym możliwościom, wiedza na temat mechanizmów apoptozy, jej aktywacji i przebiegu procesu, jest ciągle pogłębiana. Niezwykle ważnym problem stała się identyfikacja ilościowa komórek apoptotycznych, która aktualnie najdokładniej przeprowadzana jest właśnie za pomocą cystometrii przepływowej. Dzięki usprawnieniu metod diagnostycznych, możliwe jest szybsze diagnozowanie stanów patologicznych rozwijających się w organizmie, w tym również tych, które powiązane są ze zjawiskiem apoptozy[3].
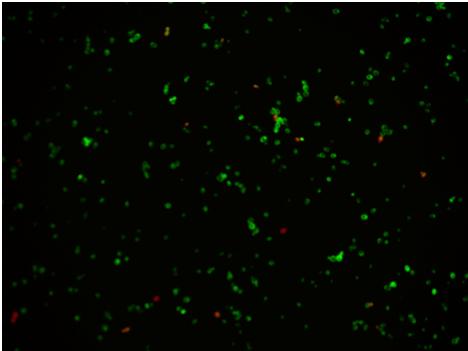
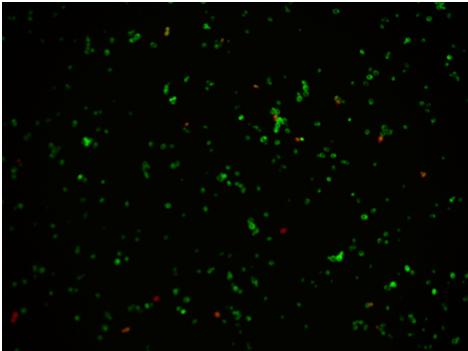 Zdjęcie:
Zdjęcie: źródła własne, autor: Lidia Koperwas. Komórki barwione barwnikami fluorescencyjnymi, w celu ich ilościowej identyfikacji. Komórki zielone- żywe, komórki czerwone- kom. apoptotyczne (martwe).
Przeprowadzone badania pozwoliły na powiązanie zjawiska apoptozy wraz z rozwojem określonych chorób. Dziś już wiadomo, że w przypadku zawału mięśnia sercowego, udaru mózgu, a także chorób zwyrodnieniowych czy AIDS, dochodzi do zachwiania równowagi pomiędzy powstawaniem nowych komórek, a ich likwidacją w wyniku apoptozy[11].Proces nowotworzeni również powiązany jest z tym procesem. Otóż, komórki nowotworowe to takie, które są „oporne” na działanie apoptozy. W związku z tym charakteryzują się niekontrolowanym wzrostem i namnażaniem[1].To właśnie dlatego, tak duże nadzieje w walce z nowotworami budzi poznanie szczegółowych mechanizmów związanych ze śmiercią komórkową. W przeprowadzanych badaniach dąży się bowiem nie tylko do osiągnięcia skutecznych metod zahamowania proliferacji komórek nowotworowych, lecz także do wyindukowania w tych komórkach procesu apoptozy[4].
Zarówno leki przeciwnowotworowe, jak i radioterapia, wywołują stres komórkowy, który w konsekwencji powinien doprowadzić do śmierci komórek „chorych”- nowotworowych. Jednakże znając realia, pewnie większość z nas zada sobie pytanie: dlaczego więc walka z nowotworami nie jest, aż tak prosta, jak sugeruje mechanizm niszczenia komórek? Otóż, transformacja nowotworowa prowadzi do nadekspresji czynników hamujących apoptozę, oraz do zmniejszonej lub braku ekspresji czynników, które z kolei powinny ją aktywować [4]. W wyniku przeprowadzonych badań, okazało się że częstą przyczyną braku wrażliwości komórek nowotworowych na chemioterapię lub radioterapię, jest nadekspresja białek z rodziny Bcl-2, czyli białek antyapoptotycznych[4]. Wśród stosowanych leków przeciwnowotworowych, w ostatnich latach kliniczne zastosowanie znalazła cytokina TNF-α. Jednakże ze względu na fakt, że cytokina ta wykazuje silne działanie toksyczne po podaniu, w związku z czym stosowana jest tylko do miejscowego leczenia nowotworów [1].W celu poszukiwania skutecznych leków przeciwnowotworowych, prowadzone są prace mające na celu wykorzystanie przeciwciał monoklonalnych , by z ich wykorzystaniem stworzyć mniej toksyczne, a zarazem bardziej efektywne związki chemiczne(leki)[1].
W piśmiennictwie istnieje wiele doniesień, dotyczących tego, jak ważne znaczenie ma apoptoza w rozwoju i przebiegu różnych chorób u osób dorosłych. Wystąpienie np. zanikowego zapalenia błony śluzowej żołądka, metaplazji jelitowej czy procesów karcinogennych, wiąże się z zaburzeniem równowagi między procesem apoptozy i proliferacją, które zachodzą w śluzówce żołądka[2].
W wyniku przeprowadzonych badań, odnotowano wzrost ilości wytwarzanych komórek apoptotycznych także w przebiegu zakażenia bakterią Helicobacter pylori(H.pylori). W zakażeniu tą bakterią, częstość występowania komórek apoptotycznych wzrasta od 3% do 16% w porównaniu do procesów fizjologicznych, gdy nie jest się zarażonym[2]. Jak donoszą badania, w warunkach fizjologicznych komórki błony śluzowej żołądka co 3-5 dni ulegają degeneracji i odnowie, w tym 2% do 3% komórek błony jest niszczonych w wyniku apoptozy[2]. Z kolei nasilona apoptoza (będąca wynikiem wieloletniego zakażenia H.pylori ), może doprowadzić do całkowitego zaniku błony śluzowej żołądka.Ponadto, wyniki badań wskazują , że proces tworzenia komórekapoptotycznych, może też mieć swój udział w przebiegu choroby wrzodowej żołądka[2]. Aktualnie znanych jest kilka czynników za pomocą, których bakteria Helicobacter pylori aktywuje procesy apoptozy w błonie żołądka. Wśród nich wymienia się m.in. składniki bakterii (tzw. czynniki zjadliwości) lub czynniki wydzielane w wyniku zakażenia bakterią (np. amoniak, ureaza, prozapalne cytokiny)[2].
Proces apoptozy jest niezbędny do prawidłowego funkcjonowania organizmu. Zaburzenia w przeprowadzaniu apoptozy mają bardzo negatywny skutek. Pojawiają się choroby których profilaktyka i sposób leczenia nie są jeszcze znane. Proces nowotworzenia i możliwość jego zapobieganiu od wielu lat jest numerem jeden wśród naukowców. Być może, stworzenie metody pozwalającej na uruchomianie procesu apoptozy w komórkach nowotworowych, już za niedługo okaże się zbawienny dla ludzkości nękanej przez tą wciąż nieuleczalną chorobę.
Autor: Lidia KoperwasLiteratura:[1]CHILMONCZYK Z, 2009. Receptory śmierci - cel molekularny leków przeciwnowotworowych. GAZETA FARMACEUTYCZNA 1/2009
[2] Maciorkowska E, Ryszczuk E, Kaczmarski M, 2008. Czynniki wzbudzające i hamujące apoptozę w błonie śluzowej żołądka u dzieci zakażonych Helicobacter pylori. Pediatria Współczesna. Gastroenterologia, Hepatologia i Żywienie Dziecka 2008, 10, 3, 143-145
[3] Smolewski P, Darzynkiewicz Z, 2003. Współczesne metody badania apoptozy. Acta Haematologica Polonica. 34,nr 1 str.35-47
[4] Bielak-Żmijewska A, 2003.Mechanizm oporności komórek nowotworowych na apoptozę. Kosmos, tom 52, nr 2-3 (259-260) , str. 157-166
[5] Lipiszko K,2006. Wpływ nowotworów i chorób wirusowych na mechanizm działania apoptozy. http://bioinfo.mol.uj.edu.pl/articles/Lipiszko06
[6]HORDYJEWSKA A, PASTERNAK K, 2005. Apoptotyczna śmierć komórki. Adv Clin Exp Med 2005, 14, 3, 545–554.
[7] Rupniewska Z, Bojarska-Junak A, 2004. Apoptoza: Przepuszczalność błony mitochondrialneji rola pełniona przez białka z rodziny Bcl-2. Postepy Hig Med Dosw. (online), 2004; 58: 538-547
[8] KOPACZEWSKA M, KOPACZEWSKI B, 2004. APOPTOZA – GENETYCZNIE ZAPROGRAMOWANA _MIER_ KOMÓRKI. Nowiny Lekarskie 2004, 73, 5, 389–392
[9] Żebrowski M.R, Kierus A, Żebrowska A, 2001. Dwa mechanizmy śmierci komórek w strefie zawału serca-martwica i apoptoza. Forum kardiologów, tom 6, nr 4. str.165-167
[10] Sanak M, 2007. Regulacja cyklu komórkowego i różnicowania. Podstawy medycyny molekularnej. Opublikowano w Medycyna Praktyczna 1998/07
[11] Gazeta Lekarska, 2002-12. Nobel za apoptozę. Pismo izb lekarskich. Wydawca: Naczelna Rada Lekarska.
http://www.nil.org.pl/xml/nil/gazeta/numery/n2002/n200212/n20021219
[12] Opiela J, Kątska-Książkiewicz L, 2006. Prace przeglądowe: Rola białek z rodziny Bcl-2 w kontroli apoptozy w pęcherzykach jajnikowych, str. 90-94 http://www.pfb.info.pl/files/kwartalnik/1_2006/Opiela.pdf
[13] Sasi N, Hwang M, Jaboin J, Csiki I, Bo Lu, Regulated cell death pathways: New twists in modulation of Bcl-2 family function http://mct.aacrjournals.org/content/8/6/1421.long
[14] Helewski K.J, Kowalczyk-Ziomek G.I, Konecki J, 2006. Apoptoza i martwica- dwie drogi do jednego celu. Wiadomości lekarskie 2006, LIX, 9-10, str. 679-683
[15] Korzeniewska-Dyl I, 2007. Kaspazy-struktura i funkcje. Pol. Merk. Lek. XXIII. Artykuł redakcyjny,UM w Łodzi, Klinika Chorób wewnętrznych , Nefrologii i Dializoterapii , kierownik: dr hab. med. D. Moczulski. http://pml.strefa.pl/eBUPLI/138/01.pdf
[16] Nakatsumi H, Yoneharo S, 2010, Identyfication of functional regions defining different activity between capase-3 and caspase-7 within cells, str. 1-2 http://www.jbc.org/content/early/2010/06/21/jbc.M110.126573.long
[17] Tsan Min-Fu, Goa B, 2009. Heat shock proteins and immune system. Journal of Leukocyte Biology, Volume 85. s. 905
[18] Marunkiewicz M, Wojtaszek P, 2007. Pochodzenie i ewolucja śmierci komórki, Postępy biologii komórki, tom 34, 2007 nr 4, str. 651-655; 657-658; 660-661 http://pbkom.pl/pbkom/tom34/34PDF04/07%20651-667.pdf


 Proces apoptozy jest kluczowy w utrzymywaniu homeostazy organizmu- pomiędzy ilością komórek wytwarzanych, a tymi, które muszą ulec zniszczeniu( komórki uszkodzone, zmutowane, zbędne). W momencie, w którym apoptoza nie może być uruchomiona, dochodzi do powstawania różnorodnych skutków ubocznych . To właśnie z zaburzeniami tego procesu, kojarzone jest wystąpienie takich chorób jak zawał serca, udar mózgu czy nawet wystąpienie AIDS.Ponadto brak apoptozy w komórce doprowadza do rozwoju nowotworów. Apoptoza może być przeprowadzana na drodze dwóch głównych szlaków: szlaku wewnętrznego i zewnętrznego. Cały proces zależny jest od wielu specyficznych czynników, w tym od bardzo ważnych białek określanych jako białka pro- i antyapoptotyczne.
Proces apoptozy jest kluczowy w utrzymywaniu homeostazy organizmu- pomiędzy ilością komórek wytwarzanych, a tymi, które muszą ulec zniszczeniu( komórki uszkodzone, zmutowane, zbędne). W momencie, w którym apoptoza nie może być uruchomiona, dochodzi do powstawania różnorodnych skutków ubocznych . To właśnie z zaburzeniami tego procesu, kojarzone jest wystąpienie takich chorób jak zawał serca, udar mózgu czy nawet wystąpienie AIDS.Ponadto brak apoptozy w komórce doprowadza do rozwoju nowotworów. Apoptoza może być przeprowadzana na drodze dwóch głównych szlaków: szlaku wewnętrznego i zewnętrznego. Cały proces zależny jest od wielu specyficznych czynników, w tym od bardzo ważnych białek określanych jako białka pro- i antyapoptotyczne.


Recenzje