

|
Zamknij X
|
Cholinoesterazy to hydrolazy estrów karboksylowych. Najważniejszą funkcją jaką pełnią jest hydroliza acetylocholiny w połączeniach nerwowo-mięśniowych, przez co inaktywują neuroprzekaźnictwo cholinergiczne. Wśród cholinoesteraz wyróżnia się: acetylocholinoesterazę AChE oraz butyrylocholinoesterazę BchE.
Cholinoesterazy są w większości enzymami zewnątrzkomórkowymi, które występują w postaci rozpuszczalnej, bądź też są przymocowane do zewnętrznych powierzchni komórek. U człowieka poziom tych enzymów, a także dystrybucja ich molekularnych form jest różna, w zależności od regionu mózgu [5].
Acetylocholinoesteraza (AchE) określana również mianem esterazy acetylocholinowej, (cholinoesteraza) oraz cholinoesteraza(ChE) są enzymami należacymi do klasy hydrolaz. Oba enzymy w odróznieniu od innych esteraz rozszczepiają estry choliny, oba też rozkładają acetylocholinę, przy czym acetylocholinoesteraza jest hamowana przez stężenia substratu (acetylocholiny) większe niż 10-2 M, a cholinoesteraza nie [3].
Cholinoesteraza występuje w surowicy, wątrobie, trzustce i innych tkankach organizmu, jednak w surowicy człowieka jest ona enzymem o największej aktywności estrolitycznej. Cholinoesteraza hydrolizuje butyrylocholinę (substancję toksyczną), która powstaje z choliny oraz butyrylo-CoA (metaboli w procesie biosyntezy i rozpadu kwasów tłuszczowych) [3]. ChE jest mukoproteiną, która syntetyzowana w wątrobie przedostaje się do krwi, przez co oznaczanie jej aktywności w surowicy ma duże znaczenie w przypadkach schorzeń wątroby. Badania wykazały zmniejszenie aktywności tego enzymu w marskości i nagminnym zapaleniu wątroby, a także w chorobie nowotworowej, chorobach zakaźnych i w zawale mięśnia sercowego [3].
Pomiar stężenia cholinoesterazy (wg procedury z wykorzystaniem zestawu odczynników BioSystems do oznaczania cholinoesterazy (ChE), http://chemklin.sum.edu.pl/uploaded/Chemia%20kliniczna/Cholinoesteraza.pdf)
Cholinoesteraza (ChE) katalizuje hydrolizę butyrylotiocholiny do tiocholiny i kwasu masłowego. Stężenie katalityczne oznacza się na podstawie szybkości spadku heksacyjanożelazianu (III), przy długości fali rónej 405 nm[4]
ChE
Butyrylotiocholina + H2O → Tiocholina + kwas masłowy
2 Tiocholina + 2HO + 2 Heksacyjanożelazian(III) → Ditiobis(cholina) + 2Heksacyjanożelazian(II) + H2O
Odczynniki:
Odczynnik A: Pirofosforan 95 mmol/l , heksacyjanożelazian (III) 2.5 mmol/l, pH=7.6
Odczynnik B: Butyrylotiocholina 60 mmol/l
Odczynnik C: Dibukaina 0,3 mmol/l po rozpuszczeniu [4].
Przygotowanie odczynników:
1)Odczynnik roboczy do cholinoesterazy całkowitej: zawartośc butelki z odczynnikiem B wlać do butelki z odczynnikiem A, całość delikatnie wymieszać.
2)Odczynnik roboczy z dibukainą: zawartość fiolki z odczynnikiem C rozpuścić w 15 ml odczynnika roboczego do cholinoesterazy całkowitej, całośc delikatnie wymieszać. Stabilnośc odczynnika to 3 dni w temperaturze 2-8°C.
Wyposażenie dodatkowe: Analizator, spektrofotometr lub fotometr z termostatowanym gniazdem na 37°C oraz filtrem o długości 405 nm, oraz kuwety z droga optyczną równą 1 cm.
Materiał do badań: jako materiał badawczy nalezy użyć surowicę lub osocze pobrane zgodnie ze standardowymi procedurami. Zalecane jest zastosowanie heparyny lub EDTA jakoantykoagulantów. Cholinoesteraza jest stabilna w osoczu lub surowicy przez 14 dni w temperaturze od 2-8°C.
Wykonanie oznaczenia:
Do obliczenia stężenia cholinoesterazy należy wykorzystać poniższy wzór:
∆A/min = Vt x 106 / e x I x Vs = U/ L
Gdzie: Absorbancja molowa (e) barwnik aprzy 405 nm wynosi 927; droga optyczna (I)-1 cm; całkowita objetośc reakcji (Vt)-1,525; objętość próbki (Vs)-0,025; 1U/L równa się 0,0166 µkat/L [4].
Oznaczanie aktywności acetylocholinoesterazy oraz cholinoesterazy opiera się na ilościowych pomiarach:
a)Powstającego w reakcji kwasu octowego (CH3COOH)
b)Zmian pH zachodzących w środowisku reakcji (pomiary metodami potencjometrycznymi lub kolorymetrycznymi)
c)Ilości dwutlenku węgla wypartego z buforu węglanowego pod wpływem CH3COOH, który powstaje w trakcie reakcji
d)Fenolu uwolnionego przez cholinoesterazę z benzoesanu fenylu jako substratu
e)Ilości nierozłożonego substratu w obecności hydroksylaminy i FeCl3 [3].
Acetylocholinoesteraza jest enzymem, uznawanym prezz enzymologów za ewolucyjnie perfekcyjny. Pojęcie to funkcjonuje ze względu na fakt, że wszystkie etapy katalizy (tj. przyłączanie substratu, transformowanie substratu, dysocjacja produktu) przebiegają w zbliżonym tempie. Miejsce aktywne enzymu AChE usytuowane jest wewnątrz łańcuchów białkowych na dnie wąskiego katalitycznego wgłębienia. Dzięki takiemu jego ułożeniu, dochodzi do ograniczenia migracji zaróno substratów do wnętrza, jak i produktó na zewnątrz centrum katalicznego enzymu.Bardzo ważną rolę w funkcjonowaniu miejsca aktywnego w enzymie odgrywają reszty aminokwasów , takich jak seryna, histydyna i kwas glutaminowy [1].
Znane są dwie formy AchE związane z funkcją enzymu:
1)Forma synaptyczna acetylocholinoesterazy (AchE-S), która zakotwiczona jest w błonie komórkowej, gdzie odgrywa bezpośrednią rolę w przewodnictwie synaptycznym.
2)Forma rozpuszczalna AchE (AchE-R), wydzielana jako monomer. Forma ta pozbawiona jest C terminalnej cysteiny, co uniemozliwia połączenie z receptorem błonowym. Forma R acetylochnoesterazy odgrywa ważną rolę w niesynaptycznej hydrolizie acetylocholiny oraz morfogenezie komórek [1].
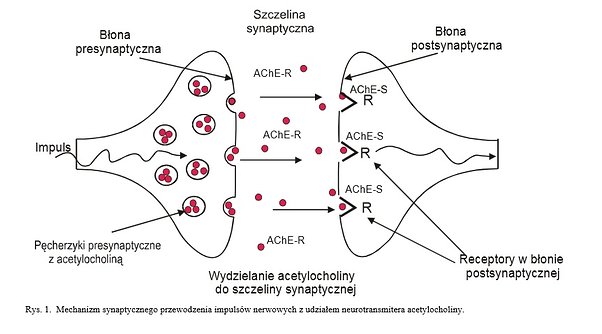
Zdjęcie: http://aleksandra.madaj.w.interii.pl/toksykologia/acetylocholinesteraza.pdf [1].
Działanie AChE-S związane jest z hydrolizą neurotransmitera acetylocholiny. Przewodzenie wszystkich impulsów nerwowych w organizmie odbywa się wzdłuż neuronów, zaś przewodzenie między dwoma neuronami przez szczelinę synaptyczną. W stanie spoczynku błona neuronowa jest spolaryzowana, z kolei w przypadku, gdy nastąpi jej depolaryzacja , impuls pzremieszcza się w kierunku zakończenia neuronu. W momencie, gdy impuls dotrze do synapsy dochodzi do depolaryzacji błony presynaptycznej, gdzie też znajdują się pęcherzyki z mediatorem (np. acetylocholiną). Depolaryzacja błony presynaptycznej powoduje, że do szczeliny synaptycznej zostaje uwolniony mediator. Wtedy to acetylocholina dociera do błony postsynaptycznej gdzie łączy się z receptorami dzięki czemu znów dochodzi do polaryzacji błony postsynaptycznej, umożliwiając impulsowi nerwowemu przemieszczanie się wzdłuż następnego neuronu. Funkcją AchE jest hydroliza mediatora tj. acetylocholiny w błonie postsynaptycznej po zakończeniu przewodzenia [1].Forma R AchE związana jest głównie z morfogenezą komórki, a także odgrywa kluczową rolę w tym odpowiedzi komórki na stres. Ponadto, AChE-R bierze udział w powstawaniu i przebiegu chorób, w np. w białaczce. Forma R hydrolizuje acetylocholinę zanim dotrze ona do błony postsynaptycznej. Nadmierna ekspresja formy R może powodować zakłócenie w przewodnictwie nerwowym [1].
Oznaczanie aktywności cholinoesterazy metodą Hestrina [3].
Cholinoesteraza rozkłada substrat acetylo- lub benzoilocholinę. Zaś nierozłożona częśc reaguje z hydroksylaminą w środowisku zasadowym, w wyniku czego tworzy się kwas acetylo- lub benzoilohydroksamowy. Kwas ten w środowisku kwaśnym , przy pH w granicach 1.0 do 1.4 i w obecności jonów Fe3+ tworzy kompleks o czerwonym lub fioletowym zabarwieniu. Czerwony kompleks świadczy o powstaniu kwasu acetylohydroksamowego, zaś fioletowy o kwasie benzoilohydroksamowym [3].
Substrat do reakcji: 0,16M roztwór chlorku acetylo- lub benzoilocholiny: 2,904 g chlorku acetylocholiny lub 3,89g chlorku benzoilocholiny rozpuścić w wodzie i uzupełnić do objętości 100 ml. Roztwó® jest trwalszy, gdy zostanie doprowadzony do pH=4.0 za pomocą kwasu solnego.
Wykonanie oznaczenia:
Za pomocą buforu fosforanowego należy rozcieńczyć 10x substrat oraz 25x surowicę. Do 1,5 ml rozcieńczonej surowicy dodać taką samą objętość rozcieńczonego substratu, po czym próbkę inkubować w temperaturze 37°C przez 60 minut. Po upływie inkubacji do próbki dodać 3 ml 10% roztworu CCl3COOH, odczekac 10 minut, po czym próbkę przesączyć (lub odwirować).
Równolegle należy wykonać oznaczenie próbki kontrolnej: w tym celu do 1,5 ml rozcieńczonej surowicy (jak wyżej) dodać 1,5 ml buforu oraz 3 ml 10% roztworu CCl3COOH. Inkubować próbkę 10 minut, a następnie pzresączyć (lub odwirować). Następnie, do 2 probówek odmierzyć po 2 ml przesączu próby badanej i kontrolnej, zaś do trzeciej probówki 0,5 ml rozcieńczonego substratu, 0,5 ml buforu i 1 ml 10% roztworu CCl3COOH. Przygotować także próbkę kontrolną na odczynnniki, do której dodać: 1 ml buforu i 1 ml 10% roztworu CCl3COOH.
Do wszystkich przygotowanych probówek dodać po 2 ml zasadowego roztworu hydroksylaminy (tj. zmieszać róne objętości 3,5M roztworu NaOH i 2 ml roztworu hydroksylaminy). PO upływie 2-minutowej inkubacji, do próbek dodać 1 ml roztworu kwasu solnego (rozcieńczony roztwór HCl: 1 część HCl + 2 części wody), całość wymieszać i odmierzyć po 1 ml roztworu FeCl3 (tj.: 0,37M roztwór FeCl3 w 0,1M roztworze HCl ). Na koniec należy oznaczyć absorbancję próby badanej wobec próbki kontrolnej, a roztworu wzorcowego (substratu) wobec próby kontrolnej na odczynniki przy długości fali λ=530 nm [3].
Obliczenia do przeprowadzonego oznaczenia:
Uzyskane wyniki podaje się w jednostkach aktywności tj. liczbie mikromoli substratu rozłożonego przez 1 ml surowicy w ciągu 1 godziny inkubacji . Ilośc jednostek można obliczyć według poniższego wzoru:
A wzorca – A próby badanej/ A wzorca x 8x 1/0,02 = A wzorca – A próby badanej / A wzorca x 400
Gdzie:
8 – liczba µmoli substratu w 0,5 ml
0,02 – liczba ml nierozcieńczonej surowicy w 2 ml przesączu
Wartość fizjologiczna: 160 – 250 j.
W trakcie oznaczenia należy mieć na uwadze, że stosując benzoilocholinę jako substrat do oznaczania aktywności ChE można stosować bufor o pH=7.5, ponieważ w tym przypadku pH znajdujące się w granicach od 6.8 do 8.0 nie ma wpływu na aktywność [3].
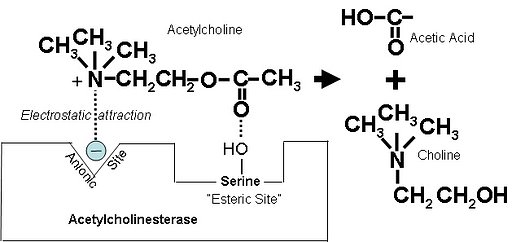
Zdjęcie: Rozkład acetylocholiny, http://www.atsdr.cdc.gov/csem/csem.asp?csem=11&po=5, [7].
Zastosowanie metody Ellama do określenia katywności potencjalnych inhibitorów acetylocholinoesterazy i butyrylocholinoesterazy
Acetylocholinoesterazy (AChE) i butyrylocholinoesterazy (BuChE) są enzymami obecnymi w błonach presynaptycznych i postsynaptycznych układu cholinergicznego, w krwinkach czerwonych oraz w osoczu krwi. Spektrofotometryczna metoda Ellmana,pozwala w prosty sposób określić aktywność potencjalnych inhibitorów AChE oraz BuChE. Niektóre z badanych związków charakteryzują się inhibicją enzymu acetylocholinoesterazy przy stężeniach rzędu nM, tak więc związki te mogą zostać poddane dalszym badaniom w kierunku poszukiwania substancji o działaniu leczniczym w chorobie Alzheimera lub jako potencjalne insektycydy [6].
Oznaczanie aktywności AChE i BuChE:
Aktywność inhibicyjną otrzymanych związków w stosunku do AChE i BuChE można określić metodą spektrometryczną, która wykorzystuje metodykę opisaną przez Ellmana (badania Skrzypek A. i wsp.)
Roztwór poddany analizie spektrofotometrycznej zawierał: 1 ml (0,1 mol/dm-3, pH = 8,0) buforu fosforanowego, 50μl barwnika DTNB (0,01 mol/dm-3), 50 μl jodku acetylotiocholiny (ATChI) lub jodku butyrylotiocholiny (BuTChI), 10 μl enzymu AChE (lub BuChE) oraz 50 μl testowanego związku.
W przeprowadzonym dośwaidczeniu sporządzono siedem różnych stężeń mieszczących się w zakresie od 10-3 do 10-9 mol/dm-3) badanych połączeń. Roztwory enzymów zostały przygotowane przez rozpuszczenie 2 U/ml w 2 ml buforu fosforanowego.
Nastęnie, badany roztwór termostatowano w kuwecie przez 10 minut w temperaturze 37 ±0,2°C. Przeprowadzona hydroliza acetylotiocholiny (butyrylotiocholiny) spowodowałą zmianę barwy, którą śledzono ilościowo, mierząc w tym celu absorbancję przy długości fali równej λ= 412 nm, przez 1 minutę. Jako odnośnika użyto 0,1 M roztworu buforu fosforanowego o pH = 8,0.
Jako związki referencyjne użyto stosowane w medycynie inhibitory AChE i BuChE tj.: donepezil i neostygmina. Wszystkie związki zostały zanalizowane w trzech seriach pomiarów,a następnie wyznaczono dla nich wartości IC50 (tj. takie stężenie substancji będącej potencjalnym inhibitorem, przy którym inhibicja osiąga wartość 50%). W tym celu za pomocą programu GraFit 4.09 sporządzono wykresy zależności % inhibicji związku w zależności od logarytmu ze stężenia potencjalnego inhibitora (log Cm) [6].
Acetylocholinoesteraza- znaczenie w wybranych jednostkach chorobowych
a)Choroby nowotworowe
W toku badań ujawniono, że AChE odgrywa istotną rolę w powstawaniu chorób nowotworowych. Wykazano, że aktywnośc tego enzymu wiąże się zarówno z procesem trombocytopoezy, jak i hematopoezy. Ponadto, enzym wpływa na proces różnicowania się komórki macierzystej szpiku. Przeprowadzone badania wykazały, że związku fosforoorganiczne mają zdolność hamowania ekspresji prekursora acetylocholinoesterazy oraz aktywnośc samego enzymu ,co z kolei powoduje, że u osób poddanych działaniu związków fosforoorganicznych częściej obserwowano wzrost ryzyka zachorowalności na białaczkę.
b)Fenyloketonuria
W fenyloketonurii (chorobie genetycznej spowodowanej mutacja pojedynczego genu kodującego hydroksylazę fenyloalaniny) zaobserwowano znaczące obniżenie aktywności AChE. Acetylocholinoesteraza katalizuje przemianę fenyloalaniny do tyrozyny, a gromadzące się w organizmie toksyczne produkty rozkładu fenyloalaniny powodują uszkodzenie układu nerowowego, prowadząc tym samym do upośledzenia umysłowego [1].
c)Choroba Alzheimera
Choroba Alzheimera zaliczana jest do schorzeń neurodegeneracyjnych, które przebiegają z otępieniem. Choroba charakteryzuje się zaburzeniami w sferze czynności poznawczych, postępującym zanikiem pamięci,a także zatracaniem zdolności do myślenia abstrakcyjnego. Chorzy nie są zdolni do wykonywania w sposób logiczny uporządkowany złożonych czynności, a w miarę postępu choroby,do wykonywania nawet prostych zadań [2]. Sama etiologia choroby Alzheimera nadal pozostaje niewyjaśniona jednak wiadomo, że jest to choroba heterogenna, co oznacza, że do jej powstania przyczynia się wiele czynników (w tym m.in. wiek ponad 65 lat). Schorzenie to związane jest ze zmianami zachodzącymi w układzie limbicznym z hipokampem i okolicą okołohipokampalną, cholinergicznym jądrem Meynerta (odpowiedzialnym za wytwarzanie około 93% acetylocholiny w ośrodkowym układzie nerwowym) i ciele migdałowatym, które to mają udział w funkcjonowaniu pamięci [2].
W mózgu ssaków odkryto dwa rodzaje cholinoesteraz:
W stanie fizjologicznym aktywność butyrylocholinoesterazy jest niewielka, jednak wraz z rozwojem choroby Alzheimera, kiedy to dochodzi do obumierania neuronów cholinergicznych, enzym ten staje się bardziej aktywny i jego zahamowanie pozwala na efektywniejsze zwiększenie stężenia acetylocholiny w mózgu. Wraz z postępem choroby poziom acetylocholinoesterazy w różnych rejonach mózgu spada o 85%, podczas gdy BuChE wzrasta, zmienia się więc stosunek butyrylocholinoesterazy do aceylocholinoesterazy. Badania ujawniły, że selektywne inhibitory BuChE mogłyby poprawić przekaźnictwo cholinergiczne poprzez wykorzystanie zwiększonego stężenia butyrylocholinoesterazy w ośrodkowym układzie nerwowym. Z badań histochemicznych wynika, że niektóre neurony cholinergiczne, zamiast acetylocholinoesterazy zawierają butyrylocholinoesterazę, a 10% do 15% komórek tzw. ciała migdałowatego oraz hipokampu jest regulowanych przez BuChE (niezależnie od AChE). Zależnośc ta wydaje się potwierdzać skuteczność nieselektywnego inhibitora acetylo- i butyrylocholinoesterazy – riwastygminy w poprawie funkcji poznawczych [2].
Przyczyną rozwoju choroby Alzheimera jest przyśpieszone wymieranie pewnych populacji neuronów, co prowadzi do pojawienia się zmian psychicznych, które wraz z rozwojem choroby nasilają się, a w ostateczności powodują pełne otępienie i śmierć. W chorobie Alzheimera dochodzi do postępującego uszkodzenia układu cholinergicznego. W konsekwencji powoduje to ciągłe zmniejszanie się stężenia neuroprzekaźnika acetylocholiny. Ma to bardzo ważne znaczenie, ponieważ system cholinergiczny odgrywa kluczową rolę w procesie uczenia się i pamięci, a choroba Alzheimera bezpośrednio wiąże się z dysfunkcją systemu cholinergicznego [1].
Autor: Lidia Koperwas
Literatura:
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje