

|
Zamknij X
|
Każdego roku przemysł farmaceutyczny wprowadza na rynek od kilkunastu do kilkudziesięciu innowacyjnych środków leczniczych. Musi jednak upłynąć wiele czasu, zanim dana substancja zostanie oficjalnym lekiem. Niezbędne jest przeprowadzenie wielu różnorodnych badań jak: in vivo, in vitro oraz badania przesiewowe z wykorzystaniem magnetycznego rezonansu jądrowego. Zanim nowa substancja lecznicza zostanie wprowadzona na rynek, musi najpierw przejść w procesie opracowywania trzy fazy. Pierwsza z nich to odkrycie leku, polegające na znalezieniu substancji aktywnej, która oddziałuje na wybrany obiekt docelowy. Faza 2 to projektowanie analogów substancji aktywnej mających ulepszone właściwości: działających silniej i selektywniej wobec wybranego celu i zdolnych do niego dotrzeć. W fazie 3 są przeprowadzane wszystkie testy oraz działania mające wpływ na ulepszenie leku, które są niezbędne do wprowadzenia go na rynek [1].
Poszukiwanie nowych substancji leczniczych towarzyszy człowiekowi już od starożytności. Do połowy XIX wieku do leczenia wielu dolegliwości stosowano surowce naturalne takie jak części roślin, minerały oraz narządy zwierzęce. Od czasu przeprowadzenia pierwszych udanych prób wyizolowania z roślin i oczyszczenia substancji biologicznie aktywnych, jako leków zaczęto używać syntetycznych związków organicznych. Istotny rozwój chemii organicznej i odkrycie istnienia pewnej zależności między strukturami związków chemicznych, a ich aktywnością biologiczną, przyczyniły się do wprowadzenia w lecznictwie wielu nowych syntetycznych leków. Obecnie prawie jedna czwarta substancji leczniczych w codziennej praktyce klinicznej, zawiera składniki pochodzenia roślinnego. Dlatego też wciąż intensywnie prowadzone są prace badawcze w poszukiwaniu nowych leków oraz substancji aktywnych biologicznie. Najważniejszym zagadnieniem jest określenie struktury tzw. związku wiodącego. Struktura ta powinna wykazywać właściwości o możliwej wartości terapeutycznej. Rośliny od zamierzchłych czasów były cennym źródłem wielu związków o różnych strukturach wiodących (morfina, chinina, nikotyna, kokaina). Wiele spośród tych substancji zastosowano jako leki bez zmiany ich budowy chemicznej, pozostałe zostały przekształcone w ich analogi syntetyczne. Związek wiodący służy jednak tylko jako podstawa do otrzymania innych, klinicznie użytecznych substancji [2].
Najpopularniejszymi metodami poszukiwania nowych związków, mogących wykazywać aktywność biologiczną i farmakologiczną są dokonywanie zmian w obrębie struktur znanych, aktywnych cząsteczek, zastąpienie fragmentu jednej cząsteczki innym, bądź zaprojektowanie nowej struktury z zachowaniem grup [2].
Naturalne źródła związków wiodących
Przyroda od tysięcy lat jest szczególnie bogatym źródłem potencjalnych surowców substancji biologicznie czynnych, które można stosować bezpośrednio w celach leczniczych, bądź wykorzystywać jako związki wiodące w projektowaniu innych leków. Struktura wiodąca jest to związek wykazujący określony kierunek działania biologicznego. Działanie to nie musi być silne, natomiast badana struktura może wykazywać pewne działania uboczne, gdyż taki związek stanowi tylko punkt wyjścia w procesie poszukiwania prawidłowej struktury nowego leku. Miliony lat ewolucji przyczyniły się do wyselekcjonowania biologicznie czynnych substancji naturalnych, które okazywały się pożyteczne dla człowieka. Ta charakterystyczna allelopatia, tj. wydzielanie przez organizmy odpowiednich związków chemicznych, może pobudzać rozwój innych organizmów (allelopatia dodatnia) bądź w sytuacji wydzielania związków szkodliwych może być formą obrony przed konkurentem (allelopatia ujemna). Jednym z przykładów mogą być rośliny wytwarzające substancje, które chronią je przed szkodnikami i insektami. Znanym przejawem tych oddziaływań są grzyby, które wytwarzają antybiotyki, produkują toksynę, dzięki której mogą zabić swoich mikrobiologicznych konkurentów i czerpać dostępne pożywienie [3]. Przypadkowym, lecz bardzo ważnym odkrytym w 1928 roku lekiem jest penicylina. Aleksander Fleming zauważył, że w hodowli bakterii Staphylococcus aureus rośnie zielona pleśń, która w momencie zetknięcia się z komórkami bakterii powoduje ich rozpad. Zjawisko to zostało wywołane przez antybiotyk, penicylinę, produkowany przez niektóre grzyby. Odkryto to dzięki przypadkowym okolicznościom panującym w laboratorium Fleminga, w którym wytworzyły się warunki klimatyczno-temperaturowe sprzyjające produkcji dość znacznej ilości penicyliny przez badaną pleśń Penicillium. Oprócz grzybów także bakterie są bardzo dobrym źródłem leków i struktur wiodących. Natomiast odkrycie penicyliny przyczyniło się do poszukiwań nowych szczepów bakterii i grzybów. Dzięki temu uzyskano związki o ważnym działaniu biologicznym, otrzymano nowe antybiotyki z grupy tetracyklin, cefalosporyn oraz aminoglikozydów. Wiele najstarszych leków, które zna medycyna otrzymano z roślin lub drzew. Wprowadzono je do lecznictwa bez żadnych modyfikacji, na przykład morfina została wyizolowana z maku czy też chinina z kory drzewa chinowego. Z kolei w starożytnym Egipcie znano działanie opium, otrzymywanego z wysuszonego maku, w Anglii wykorzystywano korę wierzby, będącej źródłem salicyny. Majowie i Aztekowie korzystali w leczeniu z kokainowca (źródło kokainy). Korzeń wymiotnicy zawierający emetynę był lekiem o działaniu pierwotniakobójczym. Znanych jest bardzo dużo takich przykładów, jednak substancje pochodzenia naturalnego stosowane w lecznictwie w „czystej” postaci zajmują tylko kilka procent współczesnego asortymentu farmaceutycznego. Interesujące jest jednak to, że w obecnych czasach nadal wydziela się związki roślin, w celu zbadania ich aktywności biologicznej i możliwego zastosowania jako leków lub struktur wiodących. Przykładem może być wyizolowany w 1967 r. lek przeciwnowotworowy – taksol (Rys.1) z północno-amerykańskiego gatunku cisa. Cis zachodni i taksol są istotnym przykładem dotąd niepoznanych wartości lasu [4]. W 1971 roku z rośliny o nazwie bylica roczna (Artemisia Anna), wykorzystywanej w tradycyjnej chińskiej medycynie, wyizolowano lek przeciwmalaryczny - artemizynę (Rys.2). Z najnowszych badań naukowców z Uniwersytetu Waszyngtońskiego wynika, że te same własności, dzięki którym artemizyna jest skuteczna w leczeniu malarii, mogą odpowiadać za jej działanie przeciwnowotworowe [5].
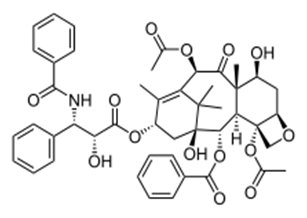
Rys. 1. Wzór strukturalny taksolu
Rys. 2. Wzór strukturalny artemizyny.
Źródłem związków wiodących lub substancji leczniczych są także zwierzęta. Odkrycie wielu ciekawych leków było wynikiem stwierdzenia, że jady i toksyny można traktować jako związki wiodące. Silnie trujące substancje, mające określoną przydatną aktywność, są wykorzystywane przy opracowywaniu leków. Ich toksyczność pokazuje, że silnie oddziałują z receptorami bądź enzymami obecnymi w organizmie. Przykładem może być grupa antybiotyków peptydowych, otrzymanych ze skóry żaby afrykańskiej oraz epibatydyna wyizolowana ze skóry żaby ekwadorskiej, będąca lekiem przeciwbólowym. Na świecie również stosowany jest jad pszczeli występujący w formie naturalnej lub jako lek wyprodukowany na jego bazie. Związki te są powszechnie wykorzystywane w terapiach medycyny konwencjonalnej. Jako związki wiodące okazały się także bardzo przydatne jady węży i pająków. Niektóre z nich nie są użyteczne w lecznictwie, ponieważ jako struktury polipeptydowe posiadają silną aktywność i są podatne na hydrolizę. Jednak ich działanie pozwala badaczom zaprojektować prostsze cząsteczki, będące łatwiejszymi do zsyntetyzowania i bardziej odpornymi na działanie enzymów metabolizujących i trawiennych. Takie pochodne można następnie podawać pacjentom w dawkach działających terapeutycznie [6].
Przykładem takim może być kaptopryl (Rys.3a) stosowany w celu obniżenia ciśnienie krwi. Otrzymano go przez modyfikację teprotydu - nonapeptydu wyizolowanego z jadu węża zawierającego prolinę (Rys.3b). Teprotyd został wyodrębniony w 1971 roku przez Miguela Ondetti wraz z jego współpracownikami z firmy Squibb, a po raz pierwszy podano go choremu na nadciśnienie tętnicze w 1974 roku. Kaptopryl natomiast jest pierwszym wprowadzonym na rynek doustnym ACE (inhibitorem konwertazy angiotensyny), zaaprobowanym w 1975 roku [6].
Rys. 3. Wzór strukturalny kaptoprylu i teprotydu.
Syntetyczne źródła związków wiodących Na całym świecie w laboratoriach badawczych wykonywane są rozmaite projekty naukowe. Wiążą się one z syntezą bardzo dużej liczby nowych związków chemicznych. W badaniach, których celem jest otrzymanie struktury wiodącej oraz jej analogów, realizuje się trzy różnorodne metody: biosyntezę, pełną syntezę i procedury półsyntetyczne [6,7].
Przemiany biosyntetyczne, wykorzystując żywe organizmy, pozwalają otrzymać analogi związku wiodącego. Poprzez zmianę warunków rozwoju organizmu, wpływa się na indukcję produkcji analogów naturalnie wytwarzanych związków. Taką metodą, poprzez dodawanie różnych kwasów karboksylowych do pożywki fermentacyjnej otrzymano po raz pierwszy pochodną penicy-liny. Dodatek kwasu fenylooctowego (PhCH2C02H) spowodował biosyntezę benzylopenicyliny (penicylina G), a w obecności kwasu fenoksyoctowego (PhOCH2C02H) tworzyła się enoksymetylopenicylina (penicylina V), która różniąc się od penicyliny benzylowej wykazała dużo większą trwałość w stosunku do kwasów i mogła być używana doustnie (Rys. 4). Metoda biosyntezy analogów przez organizmy żywe ma jednak wady. Posiada ona niewielki wybór substratów, mogących być zaakceptowanymi przez enzymy biosyntetyczne [6,7].
Rys. 4. Wzór strukturalny penicyliny G i penicyliny V.
Pełna synteza polega na otrzymaniu związku wiodącego z prostych substratów. Ta metoda ma zastosowanie wówczas, gdy struktura związku wiodącego jest możliwie prosta. Pełna synteza powinna zawierać jak najmniejszą liczbę etapów, a także dawać możliwość korzystania z wielu różnych reagentów w taki sposób, aby można było otrzymać jak najwięcej rozmaitych analogów. W przypadku, gdy posiadamy złożone struktury, które pochodzą z naturalnych źródeł bądź też zawierają wiele grup funkcyjnych i zawiłe układy pierścieniowe, wówczas pełna synteza jest najczęściej strategią zupełnie niepraktyczną. W takiej sytuacji trwa ona zbyt długo oraz ponoszone są duże koszty, w stosunku do uzyskanej zbyt niskiej wydajności. Obecnie farmacja stanowczo odchodzi od klasycznego podejścia chemicznej syntezy, która dotyczy wieku XIX i XX [6,7].
Procedury półsyntetyczne polegają na syntezie związku wiodącego i jego analogów ze związków jakie występują w naturze. Są dwa sposoby prowadzenia półsyntetycznych procedur. W pierwszej metodzie wyodrębnia się z naturalnego źródła prekursora związku wiodącego, a w kolejnym etapie poddaje się go przekształceniom chemicznym. Krystaliczny kwas 6-aminopenicylanowy (6-APA), jest biosyntetycznym produktem pośrednim do otrzymywania penicyliny (Rys.5). Wyizolowany z brzeczki fermentacyjnej po Penicillium chrysogenum, a następnie poddany reakcjom z rozmaitymi chlorkami kwasowymi, staje się sposobem na uzyskanie dość znacznej serii półsyntetycznych penicylin (ampicyliny, amoksycyliny, metycyliny) [6,7].
Rys. 5. Wzór strukturalny kwasu 6-aminopenicylanowego (6-APA).
Druga metoda dotycząca procedur półsyntetycznych polega na wykorzystaniu syntezy chemicznej do modyfikowania cząsteczek związku wiodącego, jaki uzyskuje się z surowców naturalnych. Na określenie niezbędnych ugrupowań w analizowanej cząsteczce pozwalają badania zależności między budową chemiczną a aktywnością biologiczną. Wiąże się z tym usunięcie zbytecznych grup bez utraty aktywności związku. Do projektowania nowego, skuteczniejszego leku o lepszym powinowactwie do miejsca działania stosuje się: powiększanie, usztywnianie lub upraszczanie struktury cząsteczki, wymianę podstawników a także wydłużanie bądź skracanie łańcucha, który łączy dwie grupy. Od nich zależy związanie się z miejscem docelowym [6,7].
Tysiące związków syntetycznych, które mogą być źródłem struktur wiodących, znajdują się w tak zwanym rejestrze banku związków i są dostępne do badań biologicznych. Często są to analogi danej grupy chemicznej np. pochodne penicylin, co nie daje możliwości na znalezienie nowej struktury wiodącej leku. Jednak firmy farmaceutyczne dość często kupują nowe związki, syntetyzowane w laboratoriach naukowych. Stanowi to dobre źródło do szukania nowych struktur substancji leczniczych [7].
Strategie poprawiające oddziaływania pomiędzy lekiem a jego miejscem działania
Wymiana podstawników dzięki prostemu przekształceniu chemicznemu jest znanym sposobem łagodnego dopasowania modyfikowanego leku do jego miejsca docelowego. Jest to sposób, gdzie szybko można uzyskać dostęp do nowych analogów. Przez ponad sto lat stosowano strategię, dzięki której na rynek wprowadzono pierwszy syntetyczny lek – aspirynę. W 1899 roku firma Friedrich Bayer zaczęła syntetyzować aspirynę, pochodną kwasu salicylowego (Rys.6), często występującego w niektórych roślinach [6].
Rys. 6. Synteza kwasu acetylosalicylowego (aspiryny).
Masa związku jest zwiększana przez większe grupy alkilowe, co może wpływać na jego selektywność. Analogiem adrenaliny jest izoprenalina. W cząsteczce adrenaliny grupę metylową zastąpiono grupą izopropylową (Rys.7). Zamiana ta wpłynęła na zwiększenie selektywności izoprenaliny w taki sposób, że posiada ona powinowactwo tylko do receptorów β-adrenergicznych, natomiast adrenalina wykazuje powinowactwo zarówno do receptorów α-, jak i β-adrenergicznych [6,8].
Rys. 7. Zamiana podstawnika alkilowego w cząsteczce adrenaliny.
Związki pochodzące z źródeł naturalnych mają zwykle skomplikowaną budowę i dlatego też są przedmiotem modyfikacji mających na celu uproszczenie ich struktury z zachowaniem aktywności biologicznej. Badanie zależności między budową chemiczną a aktywnością biologiczną przyczynia się do określenia nieodzownych ugrupowań w analizowanej cząsteczce, a w związku z tym usunięciu zbytecznych grup bez utraty aktywności związku. Pomyślnie uproszczono cząsteczkę alkaloidu - kokainy, otrzymując prokainę, lek służący do miejscowego znieczulenia o krótkotrwałym działaniu [6,8].
Badania farmakologiczne
Początki postępowego projektowania leków datuje się na lata 40-ste XX wieku. Głównie opierały się one na określaniu i modyfikacji struktury wiodącej znanych związków chemicznych, jakie były wówczas wykorzystywane w lecznictwie. W tych badaniach wykorzystywano dane z obserwacji klinicznych, badania przesiewowe oraz badania metabolizmu leków. Były to tylko testy kliniczne, badało się w nich różnice w działaniu pochodnych związków względem działania leku wyjściowego [7].
Obecnie na etapie projektowania prowadzi się wstępne testy farmakologiczne, które określają działanie, a także zakres aktywności leku, uwzględniając jego toksyczność. Każdy nowy związek zanim zostanie wprowadzony na rynek musi przejść próby kliniczne. Pozwolą one stwierdzić czy lek posiada ustanowione mu działanie terapeutyczne, a także czy nie wywołuje niepożądanych skutków ubocznych. Celem następnych badań jest porównanie aktywności nowego leku ze znanymi preparatami, a także ustalanie czasu i mechanizmu działania leku oraz zależności między dawką a reakcją. W kolejnym etapie lekarstwo poddane jest skomplikowanej procedurze, która rozpoczyna się badaniami przedklinicznymi. Badania te polegają na testowaniu nowych cząsteczek w warunkach laboratoryjnych na zwierzętach bądź komórkach ludzkich. Następnym krokiem są cztery fazy badań klinicznych. Każda z nich prowadzona jest z udziałem ludzi w celu potwierdzenia bądź odkrycia farmakologicznych i klinicznych skutków działania badanych substancji leczniczych. Celem badań klinicznych jest również zidentyfikowanie niepożądanych działań danej liczby badanych leków oraz mając na uwadze bezpieczeństwo i skuteczność, śledzenia wchłaniania, metabolizmu, dystrybucji oraz wydalania jednego bądź większej liczby badanych leków. Pierwsza faza badań klinicznych polega na wstępnej ocenie bezpieczeństwa leku. Jej celem jest charakterystyka wchłaniania, dystrybucji, metabolizmu oraz wydalania leku, a także toksyczność nowej substancji i jej interakcja z popularnymi lekami. W I fazie po raz pierwszy badany produkt jest podawany ludziom, biorą w niej udział zdrowi ochotnicy. Badania tej fazy mają charakter poznawczy, nieterapeutyczny. Celem II fazy badań jest określenie skuteczności terapeutycznej u chorych, a więc czy nowy lek działa u określonej grupy pacjentów i czy jest bezpieczny. Określa się także dawkę i sposób podawania leku. W III fazie badań klinicznych, prowadzonej z udziałem dużej grupy chorych (300-3000 osób) definitywnie potwierdza się skuteczność testowanego leku w danym schorzeniu. Są to przeważnie wieloośrodkowe, duże międzynarodowe projekty, a badania prowadzone są głównie metodą podwójnie ślepej próby (jest zaślepiona wiedza jaki konkretnie lek podawany jest osobie uczestniczącej w badaniu). Pozytywne zakończenie III fazy badań klinicznych umożliwia zapoczątkowanie starań o rejestrację nowego leku oraz wprowadzenie go do farmakopei, a kolejnie na rynek. Celem fazy IV badań klinicznych jest długotrwała ocena bezpieczeństwa w dużej zbiorowości chorych [7].
Rozpoczęcie badań klinicznych w Polsce oraz we wszystkich Krajach Członkowskich UE jest możliwe poprzez uzyskanie pozytywnej opinii Komisji Bioetycznej, a także zgody Ministra Zdrowia na prowadzenie badania. Procedura ta odbywa się przez pośrednictwo CEBK - Centralnej Ewidencji Badań Klinicznych, która wchodzi w skład Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Kontrolę nad prawidłowym przebiegiem badań klinicznych w Polsce sprawują Komisje Bioetyczne i Urząd Rejestracji, natomiast Minister Zdrowia w koniecznych przypadkach może cofnąć bądź wstrzymać pozwolenie na prowadzenie badania [7].
Podsumowanie:
Zadaniem nowych produktów farmakologicznych bez względu na sposób ich otrzymywania, klasycznej syntezy organicznej bądź też coraz popularniejszej, wykorzystywanej biotechnologii lub inżynierii genetycznej, mają na celu wspierać ochronę zdrowia społeczeństwa, wydłużać życie i poprawiać jego jakość. Projektowanie substancji leczniczych wciąż stanowi istotną, nieprzerwalną potrzebę opracowywania skutecznych leków przeciwko zakażeniom bakteryjnym, zaburzeniom autoimmunologicznym, infekcjom wirusowym czy wielu innym chorobom. Przemysł farmaceutyczny musi nieustannie odkrywać nowe strategie do zwalczania różnorodnych chorób. Wszystkie leki innowacyjne, które są wprowadzone na rynek podlegają długiemu i kosztownemu procesowi badawczo-rozwojowemu. Warto wiedzieć, że na każde 10.000 substancji jakie są przebadane w laboratoriach, tylko 1-2 z powodzeniem przechodzą wszystkie fazy badań, a następnie trafiają na rynek. Pomimo tych utrudnień każdego roku wprowadza się około kilkudziesięciu nowych środków leczniczych. Najważniejszym kierunkiem badań w farmacji jest ulepszanie oddziaływań pomiędzy lekiem i jego miejscem działania. Ma to na celu opracowanie leków o zwiększonej aktywności biologicznej i ograniczonym działaniu niepożądanym, które będą docierać do określonych miejsc w organizmie.
Autor: Katarzyna Czuba
Literatura:
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje