

|
Zamknij X
|

Rośliny odgrywają ważną rolę jako źródło związków biologicznie czynnych o szerokim spektrum działania. Po raz pierwszy przeciwnowotworowe właściwości związków pochodzenia roślinnego wykryto u alkaloidów barwnika, winblastyny i winkrystyny, we wczesnych latach 50 ubiegłego wieku. Półsyntetyczne pochodne tych alkaloidów są obecnie stosowane w leczeniu różnych postaci nowotworów. Do związków o działaniu przeciwnowotworowym, które wzbudzają zainteresowanie badaczy ze względu na potencjalne właściwości terapeutyczne, należą także kwas jasmonowy i jego pochodne [1].
Biosynteza i funkcja kwasu jasmonowego u roślin
Jasmoniany zostały po raz pierwszy wyizolowane z olejku eterycznego z jaśminu (Jasminum grandiflorum) w 1962 roku. Dotychczas występowanie tych związków stwierdzono u przedstawicieli 160 rodzin. Związki jasmonowe należą do występujących powszechnie u roślin fitohormonów, stanowiących cykliczne pochodne nienasyconych kwasów tłuszczowych. Jasmoniany wykazują aktywność optyczną. Możliwe są cztery stereoizomery tych związków. Forma (-) jest łatwo przekształcana do izomeru (+), który posiada niższą aktywność biologiczną. Do naturalnie występujących jasmonianów zalicza się cis-jasmon (CJ), kwas jasmonowy (JA) oraz ester metylowy kwasu jasmonowego (MeJA) (Rys.1) [2].
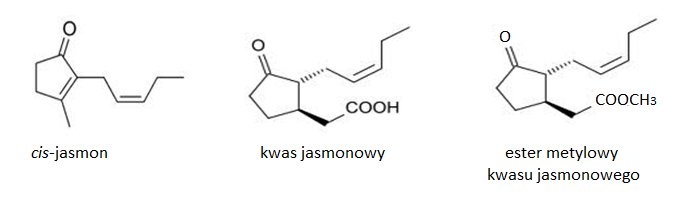
Rys.1. Wzory strukturalne naturalnie występujących jasmonianów.
Kwas iasmonowy jest syntezowany w szlaku lipoksygenazowym (Rys.2). Prekursorem syntezy kwasu jasmonowego jest kwas linolenowy (LA). Enzymy biorące udział w syntezie jasmonianów (lipoksygenaza – LOX, syntaza tlenku allenu – AOS, cyklaza tlenku allenu – AOC) zlokalizowane są w chloroplastach. Lipoksygenazy (LOX) należą do grupy enzymów zwanych dioksygenazami lub transferazami tlenowymi, które katalizują reakcje utleniania wielonienasyconych kwasów tłuszczowych zawierających układ wiązań pentadienowych. Enzymom tym przypisuje się kluczową role w regulacji syntezy związków jasmonowych. 13-LOX jest zasocjowana z wewnętrzną błoną chloroplastów. Wykorzystuje ona występujący w błonach tylakoidowych kwas linolenowy (18:3) do produkcji wodoronadtlenków lipidowych – 13-HPOT. Związki te są następnie przekształcane przez występującą w chloroplastach 13-AOS do niestabilnych tlenków allenu. Syntaza tlenku allenu (AOS) należy do rodziny enzymów CYP74A, które są niezależne od tlenu i NADPH. Enzymy te wykorzystują tlen z grupy wodoronadtlenkowej (-OOH) w reakcjach utleniania [3]. W trakcie dalszych przemian cyklaza tlenku allenu (AOC), wykorzystuje niestabilny tlenek allenu i katalizuje powstanie kwasu cis(+)-12-oksofitodienowego (OPDA). Związek ten posiada pierścień cyklopentenonu, który jest charakterystyczny dla wszystkich jasmonianów. OPDA jest produktem końcowym przebiegającej w plastydach części szlaku biosyntezy kwasu jasmonowego. W kolejnym etapie zachodzi redukcja pierścienia cyklopentenonu, która jest katalizowana przez peroksysomową reduktazę kwasu oksofitodienowego (OPR). U rzodkiewnika i pomidora występuje kilka izoform OPR, ale tylko OPR3 wykazuje specyficzność względem kwasu cis(+)-oksofitodienowego. OPR3 zawiera sekwencję sygnałową kierującą OPDA do peroksysomów. Prawdopodobnie transport OPDA z chloroplastów do peroksysomów zachodzi poprzez ABC-transporter COMATOSE (CTS; AtABCD1) [4]. Kolejne etapy syntezy kwasu jasmonowego zachodzą w peroksysomach i obejmują trzy następujące po sobie reakcje β-oksydacji. U pomidora i rzodkiewnika wykazano, że za ten proces są odpowiedzialne trzy enzymy β-oksydacyjne: acyl-CoA oksydaza (ACX1), białko wielofunkcyjne (MFP) oraz L-3-ketoacyl: CoA tiolaza (KAT). Etap β-oksydacji zachodzi z udziałem odpowiedniego estru acylo-CoA. U Arabidopsis thaliana ODPA-CoA powstaje w wyniku reakcji katalizowanej przez enzym 4-Cl-like o aktywności ligazy. W wyniku tych przemian boczny łańcuch zostaje skrócony i przyjmuje formę pentenylu. Powstaje dwunastowęglowy kwas (+)-7-iso-jasmonowy, który łatwo przekształca się do (-) kwasu jasmonowego [5].
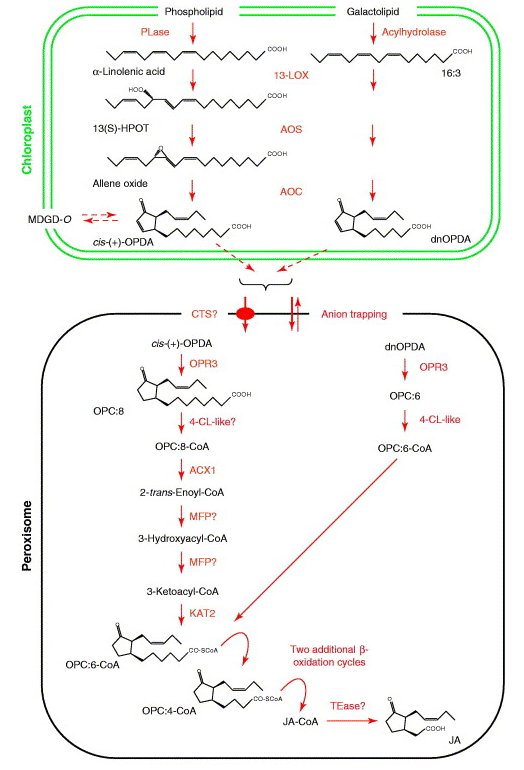
Rys.2. Szlak syntezy kwasu jasmonowego u roślin [23].
Jasmoniany są szeroko rozpowszechnione w roślinach wyższych, występują w niewielkich ilościach w różnych tkankach roślinnych. Związki jasmonowe uczestniczą w regulacji wielu procesów fizjologicznych roślin. Kwas jasmonowy (JA) i jego ester metylowy (MeJA) są obecnie zaliczane do endogennych regulatorów wzrostu i rozwoju roślin. Przeprowadzone dotychczas badania wykazały, że związki te hamują procesy związane ze wzrostem roślin, natomiast stymulują dojrzewanie owoców, starzenie i opadanie liści [6]. Dodatkowo kwas jasmonowy i jego pochodne są czynnikami sygnałowymi regulującymi ekspresję genów związanych z reakcjami obronnymi. Związki te są odpowiedzialne za powstawanie odpowiedzi obronnej na infekcję patogennymi grzybami u rzodkiewnika. Zwiększona synteza jasmonianów powoduje również wzrost odporności rośliny na atak roślinożercy [7]. Związki jasmonowe są istotnymi elementami jednego ze szlaków przekazywania sygnału w tkankach roślinnych podczas stresu środowiskowego wywołanego wysoką temperaturą, promieniowaniem UV, szokiem osmotycznym oraz metalami ciężkimi. Kwas jasmonowy i jego pochodne odgrywają znaczącą rolę w szlaku przekazywania sygnału w odpowiedzi na zranienie. U Solanaceae w wyniku lokalnego uszkodzenia tkanek dochodzi do cięcia protosysteminy, co prowadzi do powstania systeminy. Białko to aktywuje biosyntezę enzymów uczestniczących w syntezie kwasu jasmonowego. Na skutek wzrostu poziomu JA w miejscu zranienia następuje ekspresja genów kodujących inhibitory proteinaz, a także inne związki obronne pochodzenia liściowego [8].
Działanie pochodnych kwasu jasmonowego na komórki nowotworowe
Dotychczas poznano trzy sposoby działania kwasu jasmonowego i jego pochodnych na komórki nowotworowe (Rys.3). Pierwszy z nich, oddziaływanie bioenergetyczne, polega na wpływie jasmonianów na funkcjonowanie mitochondriów. W wyniku tego działania dochodzi do obniżenia poziomu ATP, heksokinazy, a także uwalniania cytochromu c z mitochondriów komórek nowotworowych. W drugim przypadku działanie pochodnych kwasu jasmonowego polega na indukcji apoptozy komórek nowotworu płuc poprzez udział w generacji nadtlenku wodoru oraz proapoptotycznych białek z rodziny Bcl-2. Trzeci rodzaj działania związany jest z indukcją różnicowania komórek ludzkiej białaczki szpikowej poprzez modulację działania aktywowanych miogenem kinaz białkowych (MAPK) [9].
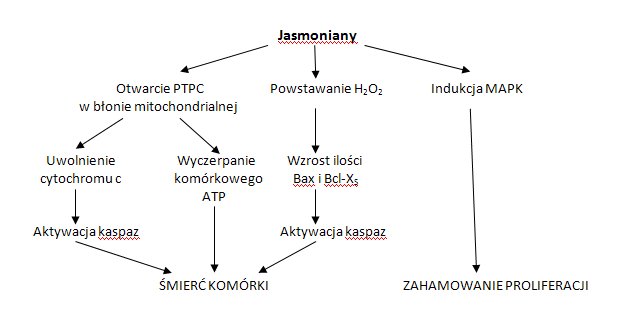
Rys.3. Możliwości oddziaływania jasmonianów na komórki nowotworowe.
Mitochondria są dla komórek eukariotycznych niezwykle ważne. Najważniejszymi rolami tych organelli są wytwarzanie ATP poprzez oddychanie komórkowe oraz regulacja metabolizmu komórki. Oprócz tego mitochondria odgrywają istotną rolę w przebiegu apoptozy w wielu typach komórek, także komórek nowotworowych. Aktywacja szlaku prowadzącego do apoptozy następuje w wyniku podwyższenia poziomu reaktywnych form tlenu, wzrostu stężenia jonów wapnia w cytoplazmie, zaburzeń transportu elektrolitów oraz uszkodzeń DNA [10]. W odpowiedzi komórki na warunki stresowe zaangażowane jest białko p53. Białko to pełni funkcje czynnika transkrypcyjnego w ekspresji genów podczas apoptozy. Efekt przeciwnowotworowy białka p53 związany jest z jego proapoptotyczną aktywnością. Polega on na aktywacji mechanizmów naprawy DNA lub indukcji apoptozy i zahamowaniu cyklu komórkowego w odpowiedzi na uszkodzenia DNA. Mutacje w genie kodującym białko p53 występują w ponad połowie przypadków nowotworów u ludzi i wiążą się z ciężkimi rokowaniami [11].
Istotną role w inicjowaniu procesu apoptozy odgrywają megakanały mitochondrialne (PTP), które są zlokalizowane w miejscu zetknięcia się obu błon mitochondrialnych. Do głównych elementów tworzących megakanały mitochondrialne należą: translokaza nukleotydów adeninowych (ANT), zlokalizowana w błonie wewnętrznej oraz poryna VDAC i obwodowy receptor benzodiazepiny (BRP), umiejscowione w błonie zewnętrznej mitochondriom. Oprócz tego w skład kompleksu mogą wchodzić enzymy o funkcjach regulatorowych. Zaliczamy do nich kinazy kreatynowe (CK), heksokinazy (HK) oraz kinazy glicerolowe (GK). Enzymy te oddziałują z poryną VDAC. Natomiast z kanałem mogą wiązać się cząsteczki regulatorowe jak znajdująca się w macierzy mitochondrialnej cyklofilina D lub cytoplazmatyczne białka z rodziny Bcl-2 [9,12]. Mitochondria komórek nowotworowych różnią się od tych występujących w komórkach prawidłowych. Wykazują one wyższy potencjał błonowy oraz zmienioną ekspresję białek tworzących mega kanały mitochondrialne. Ponadto mitochondria komórek nowotworowych charakteryzują się zmniejszoną ekspresją podjednostki katalitycznej P mitochondrialnej syntazy ATP. W takich komórkach synteza ATP nie odbywa się na skutek fosforylacji oksydatywnej, lecz na drodze mniej efektywnej glikolizy. Dlatego komórki nowotworowe są bardziej wrażliwe na ubytek komórkowego ATP [9,13].
Wyniki przeprowadzonych badań wykazują, że jasmoniany indukują wyczerpanie zapasów ATP w komórkach nowotworowych. W komórkach neuroblastomy SH-SY5Y największą aktywność przeciwnowotworową wykazuje ester metylowy kwasu jasmonowego (MeJA), a najmniejszą kwas jasmonowy (JA). W mitochondriach komórek nowotworowych cząsteczką docelową dla MeJA jest heksokinaza. Katalizuje ona pierwszą reakcję glikolizy, polegającą na fosforylacji glukozy do glukozo-6-fosforanu. Izoformy heksokinazy I i II mogą przyłączać się do poryny VDAC, w wyniku oddziaływań hydrofobowych. Wówczas w komórkach nowotworowych dochodzi do nadprodukcji poryny VDAC, jak i wiążącej się z błoną mitochondrialną heksokinazy. Proces ten zapewnia efektywny przebieg glikolizy i ma istotne znaczenie we wzroście przetrwania komórek nowotworowych [9,14].
Ester metylowy kwasu jasmonowego jest zdolny do specyficznego wiązania się z heksakinazą występującą u ssaków. Proces ten niekorzystnie wpływa na zdolność oddziaływania enzymu z poryną VDAC i powoduje jego odłączenie od błony mitochondrialnej. W wyniku czego następuje spadek wydajności glikolizy i obniżenie poziomu komórkowego ATP oraz uwolnienie cytochromu c z mitochondriów. Wysoki poziom glikolizy chroni komórki nowotworowe przed obniżeniem poziomu komórkowego ATP i śmiercią. W badaniach przeprowadzonych na komórkach chłoniaka B wykazano, że oligomycyna, inhibitor mitochondrialnej syntazy ATP, nie wpływa na poziom odpowiedzi idukowanej przez ester metylowy kwasu jasmonowego (MeJA). Natomiast obniżenie poziomu glikolizy w obecności 2-deoksyglukozy, powoduje gwałtowny spadek poziomu komórkowego ATP. Wyniki tych badań sugerują, że wysokie stężenie glukozy chroni komórki nowotworowe przed cytotoksycznym wpływem estru metylowego kwasu jasmonowego (MeJA), podczas gdy zwiększony poziom pirogronianu nie wywołuje takiego działania [9,15].
Przeciwnowotworowe działanie pochodnych kwasu jasmonowego badano także na komórkach Molt-4 ludzkiej białaczki limfoblastycznej T-komórkowej oraz Hep 3B, pochodzącej z ludzkiego nowotworu wątroby. Badania te wykazały, że związki jasmonowe, a zwłaszcza ester metylowy kwasu jasmonowego (MeJA), są odpowiedzialne za depolaryzację błony mitochondrialnej, niekontrolowany napływ wody do wnętrza mitochondrium oraz uwalnianie cytochromu c w obu liniach komórkowych. Zastosowanie cyklosporyny A i kwasu bongkrekowego, dwóch inhibitorów megakanału mitochondrialnego (PTP), zmniejszyło cytotoksyczne działanie MeJA na komórki Molt-4 oraz Hep 3B. Oprócz tego oba inhibitory zahamowały depolaryzację błony mitochondrialnej w komórkach Molt-4, indukowaną estrem metylowym kwasu jasmonowego. Wyniki tych badań potwierdzają istotną rolę megakanałów mitochondrialnych (PTP) w inicjowaniu procesu apoptozy. Kanały PTP są odpowiedzialne za proces uwalniania cytochromu c i innych proapoptotycznych białek z mitochondriów [9].
Różnicowanie komórek polega na stopniowym przekształcaniu się zespołu komórek niewyspecjalizowanych w wyspecjalizowane, pełniących określone funkcje w organizmie. W prawidłowej tkance istnieje stała równowaga pomiędzy namnażaniem się komórek, ich różnicowaniem i obumieraniem. Natomiast w komórkach nowotworowych występuje przewaga proliferacji nad obumieraniem komórek oraz zostaje zahamowane ich różnicowanie. Proces ten jest nieodwracalny i szkodliwy dla organizmu. W jego wyniku powstaje mało zróżnicowana tkanka, która jest zdolna do powiększania swojej objętości, kosztem innych tkanek ustroju [16].
Wykazano, że zastosowanie odpowiedniego induktora tego procesu może zmieniać komórki nowotworowe tak, aby utraciły zdolność do niekontrolowanej proliferacji, a uzyskały możliwość różnicowania. Zdolność do indukcji ponownego różnicowania posiadają pochodne kwasu jasmonowego. Ester metylowy kwasu jasmonowego (MeJA) wykazuje hamujący wpływ na wzrost i proliferację komórek nowotworowych różnych typów. Najbardziej wrażliwe na działanie MeJA są komórki białaczki szpikowej HL-60, najmniej nowotwory przyjmujące postać guzów litych. W badaniach komórek HL-60, wykazano, że MeJA indukuje morfologiczne różnicowanie komórek białaczkowych w kierunku granulocytów, posiadających cechy monocytów. Ponownie zróżnicowane komórki posiadały w cytoplazmie ziarna charakterystyczne dla monocytów, esteraze octanu α-naftylu - specyficznego markera monocytów oraz ekspresję antygenów powierzchniowych specyficznych zarówno dla granulocytów - CD-15, jak i monocytów - DC-14. Wykazano również, że ester metylowy kwasu jasmonowego (MeJA) może indukować transkrypcję białka δ wiążącego sekwencje wzmacniającą CCAAT - (C/EBP) δ. Białko to jest czynnikiem transkrypcyjnym i uczestniczy w różnicowaniu komórek białaczki szpikowej HL-60 do granulocytów. Oprócz tego MeJA prowadzi do wzmożonej syntezy mRNA dla białka wiążącego wapń – S100P, które jest zaangażowane w hamowanie wzrostu transformowanych komórek nowotworowych. Wyniki kolejnych badań wykazały, że ester metylowy kwasu jasmonowego (MeJA) wywołuje znaczny wzrost aktywności MAP kinaz. Proces ten jest wymagany na wstępnym etapie różnicowania komórek HL-60. Zastosowanie specyficznego inhibitora aktywacji MAP kinaz, PD98059, skutkuje utratą aktywności MAPK w komórkach białaczkowych i zablokowaniem różnicowania [9,16].
Reaktywne formy tlenu są to indywidua chemiczne, które zawierają w swoim składzie atomy tlenu z niesparowanym elektronem. Uczestniczą one w reakcjach chemicznych, które odgrywają istotną rolę w metabolizmie i starzeniu się organizmów. Ponadto wykazują one właściwości cytotoksyczne i mogą uczestniczyć w indukcji apoptozy. Do reaktywnych form tlenu należą aminorodnik ponadtlenkowy, rodnik wodoronadtlenkowy, rodnik hydroksylowy, nadtlenek wodoru, tlen singletowy oraz ozon [17].
W badaniach przeprowadzonych na komórkach glejaka linii C6 wykazano, że ester metylowy kwasu jasmonowego (MeJA) powoduje wzrost poziomu nadtlenku wodoru i aminorodnika ponadtlenkowego w cytoplazmie i mitochondriach. W wyniku tego działania dochodzi do indukcji ekspresii białka szoku cieplnego HSP72 [9,17]. Ponadto MeJA indukuje wzrost ekspresji genów białek proapoptotycznych Bax i Bcl-Xs z rodziny Bcl-2, przy niezmienionym poziomie białek antyapoptotycznych w komórkach gruczolaka płuc A549. W komórkach tych dochodzi do kondensacji i fragmentacji DNA oraz aktywacji kaspazy 3. Procesy te prowadzą do śmierci komórki w wyniku apoptozy. Również w komórkach niedrobnokomórkowego raka płuc H520, MeJA indukuje syntezę białek proapoptotycznych jak i antyapoptotycznych z rodziny Bcl-2. Powoduje to zahamowanie cyklu komórkowego w fazie G2-M i stymuluje apoptozę. Czynniki antyoksydacyjne, takie jak katalaza, hamują zmiany w poziomie białek z rodziny Bcl-2 wywołane przez MeJA [9,18].
Działanie jasmonianów w organizmach roślinnych i zwierzęcych
Kwas jasmonowy prowadzi do zahamowania cyklu komórkowego w fazie G2 w komórkach tytoniu. Proces ten jest następstwem zahamowania aktywności białek, które są niezbędne do inicjacji mitozy - CDK B oraz cykliny B1 [9,19]. Ester metylowy kwasu jasmonowego (MeJA) blokuje cykl komórkowy w fazie G0-G1 w komórkach Taxus cuspidate [9,20]. Natomiast w komórkach ryżu poddanych działaniu związków jasmonowych wykazano wysoką aktywność MAP kinaz. Białka te są odpowiedzialne za odpowiedź na stres i atak patogenu. Również w komórkach nowotworowych wykazano aktywację niektórych MAP kinaz w wyniku działania jasmonianów [9,16].
Ester metylowy kwasu jasmonowego (MeJA) powoduje wzrost poziomu reaktywnych form tlenu, prowadząc w ten sposób do śmierci niektórych typów komórek nowotworowych. Również w komórkach roślinnych, MeJA indukuje produkcję nadtlenku wodoru, w procesie zależnym od NAD(P)H. Natomiast kwas jasmonowy prowadzi do zależnej od tlenu singletowego śmierci komórek u Arabidopsis thaliana [9,21]. Indukowany związkami jasionowymi podwyższony poziom reaktywnych form tlenu odpowiada również za syntezę białek szoku cieplnego (HSP), zarówno w komórkach roślinnych, jak i zwierzęcych. Ester metylowy kwasu jasmonowego (MeJA) indukuje syntezę białka HSP72 w komórkach glejaka, jak również aktywuje syntezę niskocząsteczkowych HSP w nasionach daglezji zielonej właściwej [9,22].
W komórkach roślinnych nie zaobserwowano natomiast zmian w przepuszczalności błony mitochondrialnej, ubytku ATP oraz wzrostu poziomu białek proapoptotycznych z rodziny Bcl-2. Oznacza to, że związki jasmonowe mogą wykazywać specyficzne działanie na mitochondria komórek nowotworowych, wynikające ze zmienionego metabolizmu tych komórek [16].
Podsumowanie:
Kwas jasmonowy i jego pochodne wykazują cytotoksyczne działanie na różne komórki nowotworowe. Działanie związków jasmonowych na transformowane komórki jest wysoce selektywne, wobec tego istnieje prawdopodobieństwo że związki te będą wywoływać mniejsze efekty uboczne w porównaniu z obecnie stosowanymi lekami. Jasmoniany indukują podobne zmiany metaboliczne w komórkach nowotworowych jak w komórkach roślinnych. Badanie mechanizmu działania związków jasmonowych w komórkach roślinnych mogą przyczynić się do wyjaśnienia efektu przeciwnowotworowego obserwowanego u ssaków.
Autor: Katarzyna Czuba
Literatura:
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje