Słowa kluczowe: skrobia, skrobia oporna, rak jelita grubego, błonnik pokarmowy, amyloza, amylopektyna, kleik skrobiowy, reakcja z jodem, właściwości fizyczne i chemiczne skrobi, modyfikacja skrobi- dekstrynizacja. 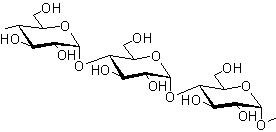
Zdjęcie: wzór skrobi, http://www.szkolnictwo.pl/szukaj,SkrobiaWielocukry są związkami organicznymi, które najobficiej występują w przyrodzie. Są to produkty polikondensacji jednocukrów, połączonych ze sobą wiązaniami glikozydowymi. Wzór sumaryczny wielocukrów jednoskładnikowych można przedstawić w postaci:
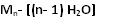
gdzie:
M- oznacza dowolny jednocukier
n- liczbę cząsteczek jednocukru
Masa cząsteczkowa wielocukrów zazwyczaj waha się w granicach od kilku tysięcy do kilku milionów.
Ze względu na budowę wielocukry podzielono na dwie główne grupy tj. homoglikany, do których zalicza się wielocukry jednoskładnikowe, oraz heteroglikany (tj. wielocukry wieloskładnikowe) [2].
 Skrobia jako wielocukier
Skrobia jako wielocukier Skrobia jest cukrem, w którego skład wchodzą dwa wielocukry tj. amyloza i amylopektyna.
Amyloza tworzy proste łańcuchy, zbudowane z cząsteczek glukozy sprzężonych ze sobą za pomocą wiązań α-1
α4.
Amylopektyna charakteryzuje się budowa rozgałęzioną. W jej składzie cząsteczki glukozy połączone są wiązaniem α-1
α 6, jednak co 25-30 reszt glukozylowych występują wiązania α-1
α6, które to tworzą charakterystyczne dla tej cząsteczki rozgałęzienia [2].
Obydwa wielocukry charakteryzują się odmiennymi właściwościami fizycznymi.
Wodne roztwory amylopektyny charakteryzują się opalizującą barwą, zaś w reakcji z jodem wykazują fioletowe zabarwienie. Z kolei, amyloza barwi się z jodem na kolor niebieski [2].
Skrobia zaliczana jest do błonnika pokarmowego. Jest ona polisacharydem rozkładanym przez układ pokarmowy do pojedynczych cząsteczek glukozy. Wyróżnia się także tzw. skrobię oporną, która jest frakcja polimeru nie ulegającą strawieniu w początkowych odcinkach przewodu pokarmowego (dzieje się tak dzięki dużej zawartości amylozy w cząsteczkach). Skrobia oporna wytrzymuje trawienie w jelicie cienkim, a zamiast tego przechodzi do jelita grubego, gdzie ma pozytywne działanie dla zdrowia jelit. Skrobia oporna nazywana jest często trzecim rodzajem błonnika (oprócz błonnika rozpuszczalnego i nierozpuszczalnego). Ten rodzaj skrobi znajdziemy w roślinach strączkowych, niektórych rodzajach chleba pełnoziarnistego, w zbożach, ryżu i makaronie [4], [5], [1].
Skrobia pełni bardzo ważną funkcję we właściwym działaniu jelita grubego, przez co zaliczana jest do błonnika pokarmowego. Ponadto, skrobia sprzyja rozwojowi pożytecznej flory bakteryjnej w jelicie grubym, a jej obecność ma bardzo pozytywny wpływ na prawidłowy przebieg metabolizmu w organizmie. Cecha ta przejawia się głównie w syntezie cholesterolu i trój glicerydów. Zalecana dzienna ilość spożywania skrobi opornej wynosi 20 gram- jest to ilość czterokrotnie większa od tego ile średnio dziennie zjada się skrobi. W związku z tym, naukowcom udało się stworzyć tradycyjnymi technikami odmianę jęczmienia , która zawiera zwiększona ilość skrobi odpornej, ponadto zaplanowano także stworzenie genetycznie zmodyfikowanej odmiany pszenicy, która charakteryzuje się podobnymi cechami [3].
W celu osiągnięcia tych zamierzeń, wykorzystano zjawisko wyciszania genów oraz inżynierię genetyczną. Tak więc, naukowcy wyłączyli (wyciszyli) w pszenicy ekspresję genu SBEI , który bierze udział w syntezie skrobi (tj. odpowiadają za powstawanie amylopektyny). W wyniku wyciszenia genu, frakcja skrobi opornej w pszenicy zwiększyła się z 25% do 70%. Pierwsze zmodyfikowane rośliny uzyskano już w 2005 roku. Z kolei, w 2009 roku, naukowcy otrzymali zgodę na pierwsze testy polowe genetycznie modyfikowanych odmian [3].
Według najnowszych badań zmniejszona ilość opornej skrobi w diecie jest przyczyną zachorowalności na raka jelita grubego. Według przeprowadzonych badań największy procent tego rodzaju raka ujawnia się w populacji australijskiej, gdzie każdego dnia odnotowuje się 30 nowych przypadków choroby. I to właśnie w Australii rak jelita grubego jest drugim pod względem częstotliwości występowania. Naukowcy doszukali się przyczyny tak częstego występowania tej choroby i wysunęli wniosek, że odpowiedzialna jest za to dieta uboga w oporną skrobię [4], [5].
Nowe badania sugerują, że zwiększenie ilości odpornej skrobi w diecie może być jednym z ważnych kroków na drodze do zmniejszenia zachorowalności na raka jelita grubego. Cały cykl rozwojowy choroby trwa około 15 lat- od czasu pierwszej inicjacji uszkodzenia DNA do rozwoju pełnoobjawowego raka jelita grubego, w związku z czym wcześniej należy poprawić nasze diety przez wprowadzenie większych ilości odpornej skrobi [4], [5]. Pod względem chemicznych skrobia nie należy do materiałów jednolitych, a to ze względu na fakt, że w jej budowie wyróżnia się cząsteczki amylozy i amylopektyny.
Amyloza należy do liniowych polimerów cząsteczek -D-glukozy powiązanych ze sobą wiązaniami -(l-4') glikozydowymi, które dodatkowo zwinięte są w spiralę (heliks)- czasami nawet w podwójny heliks. Skrobia nie natywna (poddana jakimś procesom) może mieć budowę niehelikalną. Zwijanie się i rozwijanie heliksu jest procesem odwracalnym- bardzo rzadko spotyka się amylozę w postaci rozgałęzionej. Masa cząsteczkowa amylozy wynosi od 30 000 do 60 000 Da, tj. amyloza składa się przeciętnie z 300 do 600 jednostek glukozowych. Amyloza i amylopektyna w ziarnie skrobiowym są zazwyczaj poprzerastane i ułożone koncentrycznie względem środka ziarna [6].
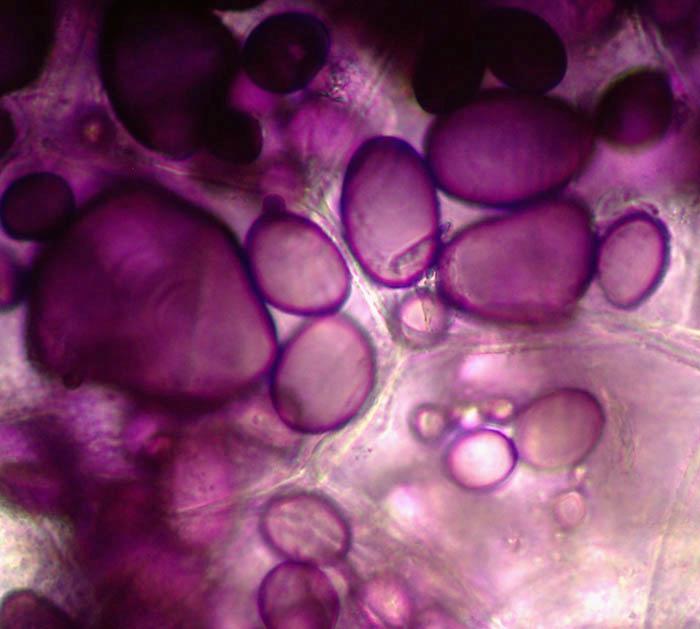 Zdjęcie: Ziarna skrobi wybarwione płynem Lugola w tkance bulwy ziemniaka, http://www.bio-forum.pl/messages/3280/87084.html
Zdjęcie: Ziarna skrobi wybarwione płynem Lugola w tkance bulwy ziemniaka, http://www.bio-forum.pl/messages/3280/87084.htmlZ kolei, amylopektyna należy do rozgałęzionych polimerów -D-glukozy (o średniej masie cząsteczkowej 400 000 Da)- składającym się przeciętnie z 2500 jednostek glukozowych. Cząsteczki glukozy powiązane są ze sobą wiązaniami -(1-4') (prosty łańcuch główny) oraz -(1-6') i -(1-3') (rozgałęzienia). Natywna amylopektyna ma rozgałęzienia zwinięte w krótkie 2-, 3-zwojowe heliksy.
Stosunek amylozy do amylopektyny w skrobi waha się od 1 : 3,5 do 1 : 5, jednakże spotyka się także skrobie zawierające do 98% amylopektyny (przykładem może być skrobia kukurydziana woskowa) [6].
Otrzymywanie skrobiW celu otrzymani a skrobi należy umyć, a następnie zetrzeć na miazgę ziemniaki. Do otrzymanej miazgi dodać równą objętość wody, całość dobrze zamieszać, po czym roztwór przesączyć przez kilka warstw gazy. Otrzymany przesącz rozcieńczyć 2-3 krotnie wodą i zostawić do dekantacji. Po odstaniu zlać ciecz znad osadu, a otrzymaną skrobię zawiesić w etanolu i przesączyć przez lejek Buchnera. Po przemyciu etanolem otrzymaną skrobię wysuszyć na powietrzu [2].
Sprawdzanie rozpuszczalności skrobia) Do 1 g skrobi dodać kilka ml wody, całość dobrze wymieszać a następnie przesączyć przez bibułę. Do otrzymanego przesączu wprowadzić 1 kroplę roztworu jodu w KI. Ciecz nie zmienia koloru-pozostaje bezbarwna, co świadczy o nierozpuszczalności skrobi w zimnej wodzie.
b) Otrzymywanie kleiku skrobiowego: należy zagotować ok. 75 ml wody, z kolei w drugim naczyniu sporządzić jednolitą zawiesinę przyrządzoną z 1 g skrobi w 15 ml zimnej wody, którą wlewa się do wrzącej wody ciągle mieszając. Naczynie po skrobi należy opłukać 10 ml wody i dodać do wrzącego roztworu. Całość gotować aż do rozpuszczenia. W ten sposób otrzymuje się jednolity, opalizujący roztwór skrob [2].
Reakcja skrobi z jodemW reakcji z jodem amyloza daje zabarwienie niebieski, z kolei amylopektyna przyjmuje barwę fioletową. Amyloza, która ma konfigurację liniowa nie jest zdolna do tworzenia kompleksu z jodem. Aby tak się stało musi istnieć konfiguracja heliksu, by cząsteczki jodu mogły się w niej regularnie ułożyć. Jedna cząsteczka jodu przypada na sześć reszt glukozylowych – tj. na jeden skręt heliksu. W wyniku ogrzewania dochodzi do rozkręcania się heliksu, co następnie jest przyczyną znikania zabarwienia z jodem.
1)
Do 2 ml kleiku skrobiowego dodać kroplę roztworu jodu w jodku w KI. Kleik skrobiowy nie może oddziaływać zasadowo. Pojawia się niebieskie zabarwienie roztworu.
Probówkę (z niebieskim zabarwieniem roztworu) ogrzewać, w wyniku czego dochodzi do znikania niebieskiego koloru. Z kolei po ochłodzeniu probówki pod bieżącą wodą, zabarwienie niebieski znów się pojawia [2].
2)
Do probówki wprowadzić 1 cm3 kleiku skrobiowego, a następnie dodać po 1-2 krople roztworu jodu (obserwować powstałe zabarwienie)
Probówkę ogrzać do wrzenia w łaźni wodnej, a następnie oziębić w strumieniu zimnej wody (obserwować zmiany zabarwienia).
Do probówki dodać kroplę 1 M roztworu NaOH, a następnie kroplę 1 M HCl (obserwować zmiany zabarwienia) [6].
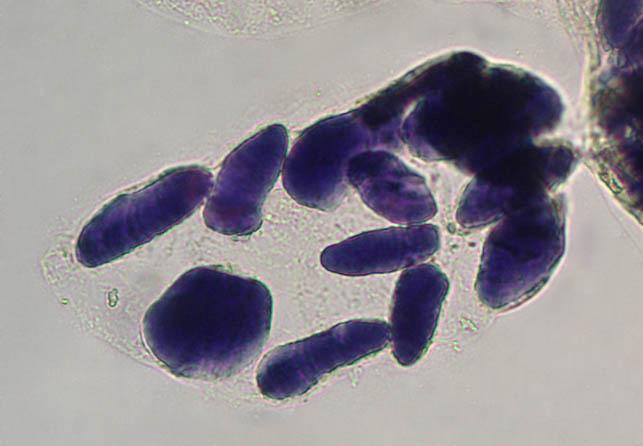 Zdjęcie: Ziarna skrobi wybarwione płynem Lugola w komórce banana, http://www.bio-forum.pl/messages/3280/87084.htmlWytrącanie skrobi
Zdjęcie: Ziarna skrobi wybarwione płynem Lugola w komórce banana, http://www.bio-forum.pl/messages/3280/87084.htmlWytrącanie skrobiWykonanie:
a) Do probówki wprowadzić po 1 cm3 roztworu skrobi. Dodać 1 cm3 nasyconego roztworu siarczanu amonu i obserwować efekt reakcji.
b) Do probówki wprowadzić 1 cm3 roztworu skrobi. Dodać 1 cm3 etanolu i obserwować efekt reakcji [6].
Właściwości chemiczne skrobiPod względem chemicznym, skrobia wykazuje właściwości aldehydów, alkoholi i eterów. Chemiczne przemiany skrobi prowadzą albo do otrzymania tzw. skrobi modyfikowanych, albo do dekstryn, a nawet cukrów prostych (glukoza, maltoza). Proces tzw. dekstrynizacji to chemiczne, termiczne lub enzymatyczne cięcie łańcuchów amylozy i/lub amylopektyny, w czasie których rozpadowi ulegają wiązania glikozydowe, które są niejako wiązaniami eterowymi [6].
Badanie wpływu zasad na zabarwienie roztworu z jodemW środowisku zasadowym zabarwienie roztworu skrobi nie zmienia się (nie powstaje żaden kolor). Po dodaniu do 2 ml kleiku skrobiowego kilku kropli 1 M roztworu zasady NaOH oraz 1 kropli roztworu jodu w KI- nie pojawia się zabarwienie roztworu, z kolei po zakwaszeniu roztworem kwasu solnego- pojawia się barwa [2].
Badanie właściwości skrobi - przed hydrolizą i po hydrolizieBy zbadać właściwości skrobi najpierw należy wykonać próbę Benedicta z roztworem skrobi. W tym celu do 5 ml odczynnika Benedicta należy dodać 0,5 ml roztworu skrobi , po czym próbkę wstawić do wrzącej łaźni wodnej na ok. 5 minut. Po inkubacji nie dochodzi do zmiany barwy roztworu- tak więc próba Benedicta ze skrobią wypada ujemnie [2].
Następnie roztwór skrobi gotować z kwasem solnym (HCl) lub kwasem siarkowym (H2SO4 ) przez kilka minut. Po gotowaniu roztwór należy ostudzić, zobojętnić za pomocą wodorotlenku sodu (NaOH) i ponownie wykonać próbę Benedicta (jak wyżej). Po gotowaniu próba ta wypada dodatnio [2].
Hydroliza skrobiPo d wpływem działania kwasów, skrobia ulega stopniowej hydrolizie (przez stadium dekstryn do maltozy i małej ilości glukozy). Bezpośrednimi produktami hydrolizy skrobi są:
- amylodekstryny (w wyniku reakcji z jodem powstaje fioletowe zabarwienie)
- erytrodekstryny (czerwone)
- achro- i maltodekstryny (brak reakcji z jodem- zabarwienie nie powstaje)
- maltoza (brak reakcji- zabarwienie nie powstaje).
W raz z postępem hydrolizy skrobi, stopniowo wzrastają właściwości `redukujące tego cukru [2].
Wykonanie:
Do ok. 10 ml roztworu skrobi należy dodać 1 ml stężonego roztworu kwasu solnego (HCl) lub kwasu siarkowego (H2SO4) – końcowe stężenie kwasu powinno być 1-2 M. Próbkę ogrzewać we wrzącej łaźni wodnej . Następnie, w statywie ustawić 2 szeregi probówek po 10 sztuk i co minutę przenosić po kilka kropli do probówek pierwszego i drugiego szeregu [2].
W pierwszym szeregu probówek, zawierającym po 1 ml bardzo rozcieńczonego roztworu jodu (ok. 0,002%) zabarwienie roztworów zmienia się kolejno z niebieskiego , przez fioletowe, czerwone, brunatne na bezbarwne [2].
Drugi szereg probówek zobojętnić za pomocą wodorotlenku sodu, po czym wykonać próbę Benedicta (jak wyżej). W wyniku zachodzących reakcji obserwuje się coraz wyraźniejszą redukcję w miarę trwania hydrolizy [2].
Właściwości fizyko-chemiczne skrobiNa pograniczu cech fizycznych i chemicznych skrobi stoi je zdolność do tzw. kleikowania. Kleikowanie jest procesem związanym z pęcznieniem ziarenek skrobi pod wpływem wody, a cały proces zachodzi w podwyższonej temperaturze. Wysoka temperatura powoduje pękanie między- i wewnątrzącząsteczkowych wiązań wodorowych składników wchodzących w skład skrobi. Z kolei, woda wymywa ze skrobi amylozę, która to tworzy z nią koloid. Jedynymi wiązaniami, które rozpadają się w skrobi są wiązania wodorowe. Zdolność skrobi do kleikowania, a także lepkość powstającego kleiku i jego stabilność, zależą od pochodzenia skrobi z materiału roślinnego [6].
Proces kleikowanie doprowadza do zmian krystaliczności skrobi. Rentgenograficznie jest to tzw. skrobia typu V. W początkowym etapie kleikowania skrobia staje się bardziej bezpostaciowa, następnie dochodzi do uporządkowania cząsteczek amylozy (poprzez agregację w podwójny heliks) dzięki międzycząsteczkowym wiązaniom wodorowym. Powstałe agregaty stają się nierozpuszczalne w wodzie i wydzielają się one z roztworów kleików w formie dendrytów- jest to tzw. retrogradacja (proces nieodwracalny) [6].
Amylopektyna nie ulega procesowi retrogradacji. Konsekwencją retrogradacji jest zmniejszenie przestrzeni międzycząsteczkowych, co następnie powoduje wypychanie wody z retrogradującej makrostruktury kleiku bądź żelu, co z kolei prowadzi do odwodnienia tego materiału. Zjawisko to określane jako synereza, objawia się wydzielaniem wody na powierzchni żelu, wysychaniem pieczywa itp. Należy też zaznaczyć, że w wąskim zakresie pH (ok. 11,2) kleiki mogą agregować bez tworzenia podwójnego heliksu, tworzą się wtedy jedynie koloidalne micele, które mają zdolność wypadania z roztworu [6].
Modyfikacje skrobi- dekstrynizacjaDekstrynizacja (częściowa depolimeryzacja) skrobi jest jedną z najczęściej stosowanych sposobów jej modyfikacji. Dekstrynizację prowadzi się w wodzie o temperaturze powyżej 100°C, a więc pod ciś-nieniem, kwasami (zazwyczaj rozcieńczonym kwasem solnym), ługami, solami hydrolizującymi z od-czynem kwaśnym, termicznie, mechano-chemicznie (wysokie ciśnienie, mielenie, ekstruzja) i enzymatycznie. Jednakże zazwyczaj dekstrynizacja polega jedynie na hydrolizie ( mogą zachodzić też reakcje uboczne).
Wszystkie reakcje uboczne notowane w trakcie zachodzenia procesu nie są bez znaczenia, gdyż niewielkie zmiany strukturalne w produkcie mogą bardzo wyraźnie zmienić lepkość ich roztworów- będącą jedną z technologicznie najważniejszych właściwości produktów [6].
Autor: Lidia KoperwasLiterartura:[1]. Gawęcki J,. Mossor-Pietraszewska T., praca zbiorowa, 2008. Kompendium wiedzy o żywności, żywieniu i zdrowie. Wydawnictwo Naukowe pWN, s. 221.
[2]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 280-282.
[3]. [http://gmo.blog.polityka.pl/2012/05/09/po-co-to-gieemo-pszenica-i-skrobia-odporna/]
[4]. Fitzgerald R.,2012. Resistant starch may offer potential to help protect against bowel cancer. http://csiro.au/en/Portals/Media/resistant-starch-may-offer-potential-to-help-protect-against-bowel-cancer.aspx
[5]. Morell M., 2007. New wheat with ahealthy future. http://www.csiro.au/Outcomes/Food-and-Agriculture/New-wheat-with-a-healthy-future.aspx
[6]. [http://www.cbimo.zut.edu.pl/download/dydaktyka/chemia_zywnosci_tz_iii/cwiczenia_laboratoryjne/%20%20%20%20%20Skrobia,%20%C4%87w.%209.pdf]
http://laboratoria.net/home/13826.html



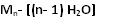
 Skrobia jako wielocukier
Skrobia jako wielocukier 
