

|
Zamknij X
|
Kwas salicylowy (KS) jest pochodną kwasu benzoesowego. Jego naturalnym źródłem jest wierzba biała (Salix alba), głównie jej korzeń. Obecna w nim salicyna przekształca się w reakcji hydrolizy chemicznej lub enzymatycznej w saligeninę. Ta z kolei utleniona zostaje do kwasu salicylowego. Syntetycznie KS jest otrzymywany w dwuetapowej reakcji Hermanna Kolbego. Najpierw fenolan sodu, pod wpływem CO2 przekształca się do salicylanu sodu, który po zakwaszeniu daje kwas salicylowy. Znane są dwa szlaki biosyntezy tego związku: z kwasu (E)-cynamonowego i z kwasu izochoryzmowego.
Kwas salicylowy (Acidum salicylicum) posiada pochodne nieacetylowane i acetylowane. Do grupy tych ostatnich należy kwas acetylosalicylowy (KAS), czyli aspiryna. Głównym jej źródłem jest wiązówka błotna (Spirea ulmaria). Syntetycznie kwas acetylosalicylowy otrzymuje się w reakcji kwasu salicylowego z bezwodnikiem octowym, gdzie katalizatorem jest kwas siarkowy.
Kwas salicylowy pełni w roślinach funkcję substancji wzrostowej. Wspomaga zakorzenianie sadzonek, opóźnia starzenie się liści, hamuje pobieranie jonów potasu i fosforu przez korzenie, indukuje kwitnienie, zakłóca działanie kwasu abscysynowego oraz syntezę jasmonianów. Ponadto, zwiększa powierzchnię liści oraz produkcję suchej masy roślin, jak i pozytywnie wpływa na fotosyntezę. Wpływa też na wczesne etapy powstawania symbiozy roślin strączkowych z bakteriami Rizobium. Ważna jest rola KS jako mediatora odpowiedzi roślinny na czynniki stresowe: biotyczne (pochodzące z przyrody ożywionej, np. szkodniki, patogeny) oraz abiotyczne (metale ciężkie, nadmierne zasolenie gleby, promieniowanie UV, chłód, długotrwała susza, niedobór składników odżywczych). KS pełni również rolę tzw. kalorygenu biorącego udział w produkcji ciepła przez rośliny obrazkowe.
KS i KAS należą do grupy niesteroidowych leków przeciwzapalnych (NLPZ). Wykorzystywane są w ziołolecznictwie i farmakologii. Kwasu salicylowego używa się jako środka keratolitycznego i dezynfekującego. Maści na bazie KS są wykorzystywane do leczenia chorób skóry. Aspiryna jest stosowana głównie jako lek przeciwbólowy i przeciwgorączkowy.
Celem napisania niniejszego artykułu było zintegrowanie informacji na temat jednej z roślinnych substancji bioaktywnych, jaką jest kwas salicylowy (KS). Tematyka jest interdyscyplinarna, zawiera się w różnych dziedzinach nauk przyrodniczych: fizjologii, biochemii i biotechnologii roślin, jak również nauk medycznych – weterynarii i farmakognozji. Farmakognozja jest działem farmacji zajmującym się surowcami pochodzenia roślinnego oraz składnikami czynnymi zawartymi w nich. Bada również budowę chemiczną i anatomiczną tych związków oraz sposób ich działania na organizm ludzki. Fitobiochemia i fizjologia roślin dostarczają natomiast wiedzy o kierunkach i mechanizmach procesów biologiczno-chemicznych zachodzących w różnych częściach roślin. Dzięki nim jest możliwe także zbadanie praktycznego wpływu substancji czynnych znajdujących się w roślinach na ich funkcjonowanie: rozwój, zachodzenie procesów życiowych, mechanizmy obronne i inne.
Związek bioaktywny pochodzenia roślinnego, jakim jest kwas salicylowy, daje ogromne możliwości wykorzystania go przez człowieka w wielu obszarach nauki i przemysłu, zarówno tych już odkrytych, jak i potencjalnie możliwych, ale jeszcze nieznanych.
Kwas salicylowy (inaczej: SA, KS, kwas o-hydroksybenzoesowy, kwas o-oksybenzoesowy; łac. Acidum salicylicum, Acidum o-hydroxybenzoicum, Acidum o-oxybenzoicum, Acidum spiricum) to chemiczny związek organiczny. Należy do grupy aromatycznych hydroksykwasów karboksylowych (Kączkowski, 1982), jest pochodną kwasu benzoesowego (Lamer-Zarawska i współaut., 2007). Do owej grupy kwasów hydroksybenzoesowych należą także m.in.: kwas 4-hydroksybenzoesowy, waniliowy, protokatechowy, syryngowy i galusowy, które spełniają różnorakie i ważne funkcje fizjologiczne w roślinach.
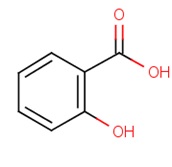
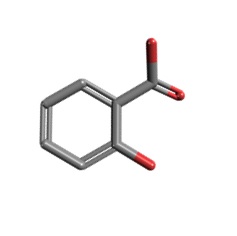
a) b)
Ryc.1. Struktura chemiczna kwasu salicylowego: a) dwuwymiarowa, b) trójwymiarowa
(źródło:http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=338&loc=ec_rcs).
Sumaryczny wzór kwasu salicylowego to C7H6O3, tak więc KS jest złożony z siedmiu atomów węgla w podstawowym szkielecie. Zdarza się też czasami, że w jego strukturze występuje większa liczba atomów węgla, co jest związane z wystąpieniem częściowej lub całkowitej metylacji grup hydroksylowych w polifenolowych pochodnych kwasu benzoesowego. Ze wzoru strukturalnego (Ryc. 1) wynika, iż do pierścienia benzenowego przyłączona jest jedna grupa hydroksylowa i jedna karboksylowa znajdujące się względem siebie w pozycji orto.
Masa cząsteczkowa związku to 138,12 g/mol. Substancja ma postać drobnych igieł, białych kryształków albo puszystego krystalicznego proszku barwy białej, o ostrym słodko-kwaśnym smaku. Syntetycznie otrzymany kwas salicylowy jest bezwonny. Ogrzewane powoli ciało stałe sublimuje bez rozkładu w 76˚C, natomiast szybkie ogrzewanie powoduje jego rozkład z ulotnieniem się zapachu fenolu, dymu i drażniących oparów. Zdolność kwasu do tworzenia wewnątrzcząsteczkowych wiązań wodorowych zwiększa jego lotność z parą wodną i możliwość sublimacji. Odczyn związku jest kwaśny (pH 2,4), dlatego nieodpowiednio podany jako lek może podrażniać przewód pokarmowy człowieka i zwierząt. Kwas salicylowy rozpuszcza się bardzo łatwo w etanolu 95%, spirytusie oraz eterze. We wrzącej wodzie jego rozpuszczalność jest znacznie lepsza niż w wodzie o niższej temperaturze (rozpuszcza się w 15 cząsteczkach wrzątku, a w 500 cząsteczkach zwykłej wody). Substancja jest trudno rozpuszczalna w chloroformie, glicerolu 86%, olejach tłustych i tłuszczach (Szwabowicz, 1957). Ciepło jej spalania wynosi 3,026 mJ/mol. Związek wrze w 211˚C, a topnieje w 159˚C. Kwas ten ponadto nie jest żrący (Morrison, Boyd, 2011).
KS posiada różne pochodne, które można podzielić na nieacetylowane i acetylowane. Do nieacetylowanych można zaliczyć: salicylan sodu, salicylan metylu, diflunisal, salicylan fenylu (salol), salicylan choliny, salicylan glikolu etylenowego, salicylamid, salsalat, benorylat, salicylan dietyloaminy (Międzybrodzki, 2004; Zejc, Gorczyca, 2004).
Salicylan sodu (Natrium spiricum) to inaczej sól sodowa kwasu salicylowego. Związek dobrze rozpuszcza się w wodzie. Jest stosowany w pirotechnice, jako odczynnik analityczny, a także w farmacji. Pełni rolę solubilizatora dla innych substancji leczniczych, czyli przyczynia się do zwiększenia ich rozpuszczalności. Lek ten podawany jest doustnie, wchłania się w przewodzie pokarmowym a wydalany jest z moczem. Ma działanie przeciwbólowe, przeciwgorączkowe i przeciwzapalne. Ponadto, hamuje agregację płytek krwi, działa silnie przeciwgośćcowo, słabo uspokajająco, żółciopędnie i moczopędnie. Zewnętrznie stosowany w niskich stężeniach (do 0,5%) nawilża skórę, natomiast w wysokich stężeniach (do 10%) ją złuszcza. Jest stosowany do zabiegów jonoforezy, w kosmetyce, dermatologii i okulistyce (Morrison, Boyd, 2011; http://pubchem.ncbi.nlm.nih.gov/su mma ry/summary.cgi?cid=16760658&loc=ec_rcs; http://www.drugbank.ca/drugs/DB01 398).
Z kolei salicylan metylu (Methylium salicylicum) to inaczej ester metylowy kwasu salicylowego. Występuje naturalnie w olejku przęślowym rośliny Gauterii, a także w Pomocniku baldaszkowatym. Jest rozpuszczalny w olejach mineralnych i tłustych, olejkach eterycznych, wazelinie, lanolinie i innych tłuszczach. Stosowany miejscowo na skórę (w stężeniu do 20%) wykazuje działanie przeciwzapalne, przeciwbólowe i rozgrzewające, a także słabe przeciwbakteryjne i złuszczające. Niedopuszczalne jest użycie doustne salicylanu metylu, gdyż jest to substancja trująca (Kubikowski, 1969, 1975; Chruściel, Gibiński, 1991; Woliński, 1985; http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=4133&loc=ec rcs).
Inna nieacetylowana pochodna kwasu salicylowego to diflunisal, czyli kwas 5-(2,4-difluorofenylo)salicylowy. Wykazuje, podobnie jak inne salicylany, działanie przeciwbólowe, przeciwgorączkowe oraz przeciwzapalne, jednak jest lekiem silniejszym niż kwas acetylosalicylowy. Metabolizm diflunisalu zachodzi w wątrobie, a wydalany jest razem z moczem (http://www.drugbank.ca/drugs/D B00861).
Salicylan fenylu (Phenylis salicylas) znany jako salol, jest estrem fenylowym kwasu salicylowego. Stosuje się go do leczenia zakażeń układu moczowego oraz odkażania przewodu pokarmowego (Kupryszewski i współaut., 1998; Woliński, 1985).
Salicylan choliny (Cholini salicylas), czyli sachol ma działanie przeciwbólowe i przeciwgorączkowe oraz stosowany miejscowo wykazuje słabe właściwości bakteriobójcze. Bardzo dobrze rozpuszcza się w wodzie i jest wchłaniany około 12 razy szybciej niż aspiryna. Po pół godziny osiąga maksymalne stężenie w surowicy krwi. Jego eliminacja z organizmu polega na czynnym wydzielaniu kanalikowym oraz biotransformacji sacholu do kwasu salicylurowego. Jako lek stosowany jest miejscowo w postaci żelu stomatologicznego, pastylek do ssania (np. Cholinex), a także kropli do uszu (np. Otinum, Ototalgin) (Janicki i współaut., 2008).
Salicylan glikolu etylenowego, z kolei, to inaczej ester 2-hydroksyetylowy kwasu salicylowego. Jest on nieacetylowaną pochodną KS, która ma swoje zastosowanie jako lek rozgrzewający w postaci plastrów (http://pubchem.n cbi.nlm.nih.gov/summary/summary.cgi?cid=6880&loc=ec_rcs).
Natomiast salicylamid (Salicylamidum) jest amidem kwasu salicylowego. Podobnie jak inne pochodne KS jest analgetykiem (lekiem przeciwbólowym), antypiretykiem (przeciwgorączkowym) oraz wykazuje działanie przeciwzapalne (Boss, Jackle, 1996; http://www.drugb ank.ca/drugs/DB08797).
Inny salicylan, salsalat, jest stosowany głównie jako lek przeciwbólowy. Zmniejsza też obrzęk i sztywność stawów. Jego przeznaczeniem jest leczenie reumatoidalnego zapalenia stawów i choroby zwyrodnieniowej, jak również bólu i stanów zapalnych tkanek miękkich. Należy mieć na uwadze, iż salsalat, podobnie jak inne salicylany wykazuje niepożądane skutki w postaci podrażnień żołądkowych (http://www.drug bank.ca/drugs/DB01399).
Benorylat, natomiast, to ester paracetamolu i kwasu acetylosalicylowego. Jest lekiem na ból i gorączkę. Istnieją przeciwwskazania do stosowania go przy laktacji, hemofilii oraz zmianach chorobowych błon śluzowych żołądka i dwunastnicy (Kostowski, Herman, 2007; http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=134223251&loc =es _rss).
Ostatnia nieacetylowana pochodna kwasu salicylowego to salicylan dietyloaminy. Jest to lek do stosowania miejscowego o działaniu przeciwzapalnym, przeciwbólowym i rozgrzewającym, np. w przypadku bólu mięśni, kości i stawów. Może występować w postaci żelu lub kremu (np. Saldiam) (Korzeniewska-Rybicka i współaut., 1996).
Acetylowaną pochodną KS jest natomiast kwas acetylosalicylowy (KAS, kwas acetoksobenzoesowy, Acylpyrin, Ecotrin, Acetosal, Colfarit, Aspiryna, Polopiryna, Rhonal; łac. Acidum acetylsalicylicum, Aspirinum, Polopirinum). Nazwę aspiryny utworzono następująco:
a – od kwasu acetylosalicylowego,
spir – od występowania tego związku w wiązówce błotnej (Spirea ulmaria),
in – jako końcówka stosowana dawniej dla leków przeciwbólowych.
Aspiryna jest jednym z pierwszych leków wytwarzanych na skalę przemysłową. Jej produkcję rozpoczęto w roku 1899. Jednak wcześniej w niemieckich fabrykach produkowano już leki, takie jak np.: kairyna, salol, antypiryna (Grynkiewicz, Hennig, 2010).
KAS jest nieodwracalnym inhibitorem cyklooksygenazy, czyli enzymu uczestniczącego w reakcji utleniania lipidów zachodzącej in vivo. Cyklooksygenaza przekształca kwas arachidonowy w mediatory stanu zapalnego, czyli tromboksany i prostaglandyny. Dzięki hamowaniu aktywności owego enzymu kwas acetylosalicylowy posiada właściwości przeciwzapalne.
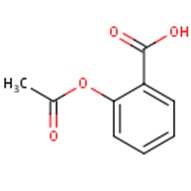
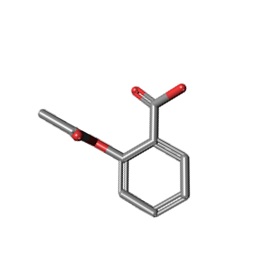
a) b)
Ryc. 2. Struktura chemiczna kwasu acetylosalicylowego: a) dwuwymiarowa, b) trójwymiarowa
(źródło: http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=2244&loc=ec_rcs).
Aspiryna ma wzór chemiczny C9H8O4. Przyjmuje postać białych, krystalicznych igieł o lekko kwaśnym smaku. Związek ten może mieć nieznaczny zapach kwasu octowego lub też być bezwonny. Słabo rozpuszcza się w wodzie (tylko 1,37 g KAS na 100 g wody w temperaturze 20˚C), ale jest dobrze rozpuszczalny w alkoholu etylowym (w wysokiej temperaturze) oraz w eterze dietylowym. Jego masa cząsteczkowa wynosi 180,16 g/mol i jest większa od masy kwasu salicylowego, gdyż ma bardziej złożoną strukturę (Ryc. 2). Jego gęstość wynosi 1,35 g/cm3. Kwas acetylosalicylowy topi się z rozkładem na kwas octowy i salicylowy, a jego temperatura topnienia wynosi 135˚C i jest niższa niż w przypadku KS (http://pubchem.ncbi.nlm.nih.gov/su mmary/summary.cgi?cid=2244#x27; http://www.drugbank.ca/drugs/DB009 45).
Głównym naturalnym źródłem kwasu salicylowego jest wierzba biała (Salix alba), inaczej srebrna lub pospolita, dlatego KS nazywa się też potocznie „kwasem wierzbowym” (innym jego źródłem jest wiązówka błotna, Spirea ulmaria). W korze wierzby (cortex salix) obecna jest substancja aktywna biologicznie zwana salicyną (Lutomski, Alkiewicz, 1993). Salicyna jest β-glukozydem saligeniny (Kohlmünzer, 1993) (pochodną cukru – glukozy), którego hydroliza chemiczna lub enzymatyczna prowadzi do rozpadu na glukozę i alkohol salicylowy. Utleniony alkohol salicylowy tworzy kwas salicylowy (Ryc. 3) (Woliński, 1985).
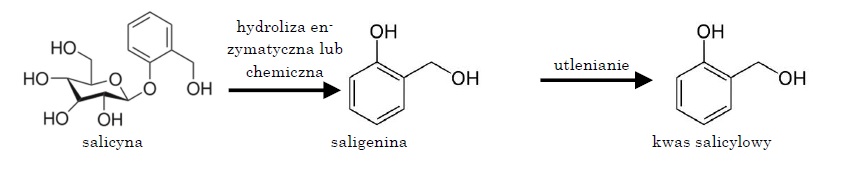
Ryc. 3. Reakcja powstawania kwasu salicylowego z salicyny (wg Woliński, 1985; zmodyfikowane).
Kwas salicylowy po raz pierwszy został wydzielony w 1838 roku przez Rafaela Piria, jednak już wcześniej, w 1828 roku Johann Andreas Buchner, wprowadził do lecznictwa frakcję związków salicylowych wyizolowanych z kory wierzby.
Wierzba biała to drzewo z rodziny wierzbowatych. Występuje głównie w Europie, Azji i Afryce Północnej, jednak została sprowadzona też do Skandynawii, Irlandii i Szkocji jako roślina ozdobna. Rośnie powszechnie na całym terytorium Polski. Można znaleźć ją głównie w lasach łęgowych, na brzegach rzek albo przy rowach, czyli w miejscach, gdzie występuje bardzo wysoka wilgotność podłoża, ponieważ roślina pobiera dużą ilość wody. Preferuje obszary, gdzie jest piaszczysta, czasowo zalewana gleba. W górach dochodzi do wysokości około 800 m n.p.m. Wierzba rośnie szybko i jest raczej krótkowieczna (Szafer i współaut. 1986; Mowszowicz, 1997).
Salix alba osiąga wysokość do 30 m. Korona drzewa jest rozłożysta a pień krótki i pochyły o ciemnoszarej i popękanej korze. Ma bardzo giętkie gałęzie i smukłe szare pędy delikatnie owłosione przez cały rok. Pąki wąskie i płaskie. Liście również wąskie, lancetowate, młode są obustronnie owłosione, natomiast starsze – tylko od spodu (Johnson, More, 2009).
Wraz z rozwojem liści – wczesną wiosną – drzewo zakwita. Wierzba jest rośliną dwupienną. Jej kwiatostany są zwane kotkami lub baziami. Żeńskie kotki w nasadzie są luźnokwiatowe i mają języczkowate, nietrwałe przysadki o jasnordzawej barwie, jeden gruczoł miodnikowy oraz nagi słupek z siedzącą zalążnią. Kwiatostany męskie, natomiast, mają przysadki o jednolitej barwie, dwa gruczoły miodnikowe oraz dwa pręciki o owłosionych u dołu nitkach. Kwiaty zapylane są przez owady. Owoce wierzby białej mają postać filcowato owłosionych torebek o szarej barwie, a nasiona są drobne, owłosione srebrnym meszkiem i roznoszone przez wiatr (Broda, 1986).
Salix alba może się krzyżować z wierzbą kruchą. Powstają wówczas odmiany: Basfordiana oraz Sanguinea. Basfordiana jest drzewem męskim, rozłożystym, posiadającym pędy o intensywnym pomarańczowym zabarwieniu. Sanguinea, natomiast, jest to drzewo żeńskie o długości liści około 8 cm. Wierzba biała może tworzyć mieszańce także z wierzbą pięciopręcikową, gdzie powstała odmiana odznacza się pojedynczymi włoskami z obu stron liścia. Ponadto, wyróżnić można też odmiany botaniczne, takie jak: sericea (dorastająca do 25 m wysokości, posiadająca liście miękko owłosione z wierzchu), caerulea (osiągająca wysokość 30 m, preferująca wilgotne podłoże, odznaczająca się fioletowo-czerwonymi pędami z szarym owłosieniem i błękitno-szarym zabarwieniem liści od spodu) oraz vitellina (o jaskrawożółtych pędach). Wśród odmian uprawnych wymienia się Britzensis i Chermesina. Rośliny rosną do 28 m wysokości, mają intensywnie pomarańczowe pędy, gałęzie uniesione w górę, a liście o błękitno-szarym zabarwieniu po spodniej stronie (WINK, WYK, 2008).
Wierzba biała posiada szeroki wachlarz zastosowań. Drewno wierzbowe powszechnie używa się jako opał. Poza tym, roślina często sadzona jest przy drogach, brzegach rzek czy wałach przeciwpowodziowych, aby je umocnić dzięki rozbudowanemu systemowi korzeniowemu. Cecha ta, w połączeniu ze zdolnością do szybkiego wzrostu, wpływa na przydatność drzewa do rekultywacji terenów oraz wysypisk śmieci. Co więcej, wierzbę sadzi się na terenach podmokłych, aby je osuszyć, ale też często bywa sadzona na działkach jako roślina ozdobna. Salix alba znana jest także jako roślina wykazująca oddziaływanie lecznicze na organizmy. Surowiec zielarski rośliny, którym jest kora wierzby, – jak już zostało wspomniane – zbiera się z gałęzi dwu lub trzyletnich wczesną wiosną i suszy się w ciemnym albo jasnym pomieszczeniu. Obecnie jednak do celów leczniczych nie pozyskuje się KS z kory wierzby, ale stosuje się metody laboratoryjne.
Metoda syntetycznego otrzymywania kwasu salicylowego została przypadkowo odkryta w 1859 roku przez Hermanna Kolbego, który tak naprawdę pracował nad skonstruowaniem metody pozwalającej tanio i szybko produkować barwnik – indygo. W tym celu użył fenolu otrzymanego ze smoły pogazowej i umieścił go razem z dwutlenkiem węgla w zamkniętym naczyniu. W wyniku ogrzewania mieszaniny substratów powstał kwas salicylowy.
Reakcja ta jest dwuetapowa (Ryc. 4). Najpierw fenolan sodu pod wpływem dwutlenku węgla, w wysokiej temperaturze (125˚C) i pod ciśnieniem kilku atmosfer przekształca się w salicylan sodu. Dzieje się tak z powodu elektrofilowego oddziaływania dwutlenku węgla na pierścień aromatyczny fenolanu sodu. Następnie salicylan sodu zakwasza się np. kwasem siarkowym i tak powstaje wolny kwas salicylowy (Woliński, 1985; Zejc, Gorczyca, 2004).
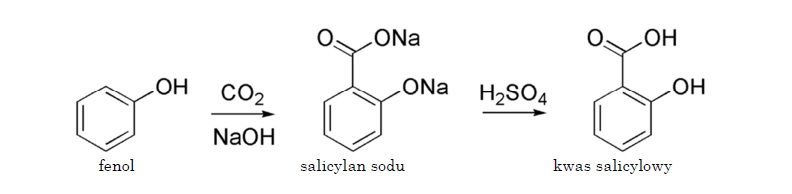
Ryc. 4. Otrzymywanie kwasu salicylowego – reakcja Hermanna Kolbego
(źródło: http://upload.wikimedia.org/wikipedia/commons/a/ac/Kolbe-Schmitt.png
potwierdzone na podstawie: Morrison, Boyd, 2011; Mastalerz, 2000).
Reakcja syntetycznego otrzymywania kwasu salicylowego jest nazywana od nazwiska odkrywcy metody – reakcją Kolbego, ale bywa też zwana reakcją Kolbego-Schmitta. Rudolf Schmitt w 1885 roku za swoim poprzednikiem również opisał ową metodę (Lindsay, Jeskey, 1957). Kwas salicylowy, z kolei, jest dalej substratem w syntezie kwasu acetylosalicylowego, czyli popularnej aspiryny.
W latach 60-tych uważano, iż kwas salicylowy powstaje na dwa możliwe sposoby z kwasu cynamonowego. Jedna ze ścieżek, obecna w roślinach tytoniu i ryżu, miała polegać na dekarboksylacji łańcucha bocznego kwasu cynamonowego tworząc kwas benzoesowy a następnie KS. W dębie szypułkowym (Quercus pedunculata) zaobserwowano obecność enzymu katalizującego przemianą kwasu cynamonowego do benzoesowego. Drugi szlak miał polegać na hydroksylacji kwasu cynamonowego do kwasu o-kumarowego a następnie na jego dekarboksylacji do kwasu salicylowego. W procesie tym miał uczestniczyć enzym hydroksylaza trans-cynamonowa, którą zidentyfikowano w sadzonkach grochu. Jednak przeprowadzone badania genetyczne nad rzodkiewnikiem pospolitym (Arabidopsis thaliana) wykazały, iż kwas salicylowy syntetyzowany jest w chloroplastach z kwasu choryzmowego (Metraux, 2002).
Grynkiewicz i Hennig (2010) piszą o dwóch szlakach syntezy KS: z kwasu (E)-cynamonowego oraz z kwasu izochoryzmowego. W pierwszym ze szlaków prekursorem KS jest L-fenyloalanina, która zostaje – pod wpływem działania enzymu amoniako-liazy L-fenyloalaniny (PAL) – przekształcona do kwasu trans-cynamonowego. Ten ostatni pełni ważną rolę w biosyntezie fitoaleksyn oraz lignin, które biorą udział w odpowiedzi komórek roślinnych na czynniki stresowe. To od kwasu cynamonowego pochodzi bezpośredni prekursor kwasu salicylowego, czyli kwas benzoesowy. Ulega on reakcji hydroksylacji, która katalizowana jest przez enzym hydroksylazę kwasu benzoesowego.
W drugim szlaku biosyntezy prekursorem kwasu salicylowego jest kwas choryzmowy, który ulega przekształceniu do kwasu izochoryzmowego dzięki syntazie iso-choryzmatów (ICS). Kwas izochoryzmowy zostaje następnie przekształcony do kwasu salicylowego z udziałem enzymu pirogroniano-liazy isochoryzmatów (IPL).
Utworzony KS może być przekształcony do estru glukozowego kwasu salicylowego (SGE) w reakcji katalizowanej przez enzym glukozotransferazę kwasu salicylowego (KSGT). Może również enzymatycznie być przekształcony się do β-glukozydu kwasu salicylowego (SAG) na skutek działania również glukozylotransferazy. Poprzez tworzenie koniugatów z cukrem rośliny mogą magazynować znaczne ilości związków toksycznych lub wysoko reaktywnych. Z kolei reakcja odwrotna, a więc hydroliza wiązania β-glukozydowego, sprawia, że aktywny związek staje się dostępny.
Z kwasu salicylowego może być również syntetyzowany w roślinach ester metylowy kwasu salicylowego (MeSA), który jest cząsteczką sygnałową przekazującą informacje o konieczności obrony przed infekcjami w roślinie i między roślinami. MeSA jest tworzony z kwasu salicylowego dzięki działaniu białka-2 wiążącego KS (SABP2) lub metylesterazy kwasu salicylowego (MES). Z kolei reakcja odwrotna (przekształcanie estru metylowego w KS) katalizowana jest przez metyltransferazę kwasu salicylowego (KSMT). Na schemacie strzałki z liniami ciągłymi oznaczają kierunek reakcji indukowanych w odpowiedzi na infekcje, natomiast strzałki z liniami przerywanymi symbolizują możliwe drogi przekształcania się związków fenolowych (Hayat i współaut., 2010).
Naturalnie kwas acetylosalicylowy występuje, podobnie jak KS, w wierzbie białej (Salix alba), ale także w wiązówce błotnej (Spiraea ulmaria).
Roślina ta jest byliną należącą do rodziny różowatych (Rosaceae). Występuje w Azji oraz w Europie Północnej i Środkowej. Jest gatunkiem rodzimym w Polsce. Rośnie głównie na brzegach zbiorników wodnych, zaroślach nadrzecznych, podmokłych łąkach, w górach sięga do piętra kosówki. Jest hydrofitem rosnącym najlepiej w półcieniu, ale może także żyć w słońcu. Wiązówka rośnie tylko na wilgotnej glebie, również błotnistej. Jest odporna na mrozy (Broda, 1986; Szafer i współaut., 1986; Mowszowicz, 1997).
Jej kwiaty delikatnie pachną, wabiąc w ten sposób zapylające ją owady. Kwitnie od czerwca do sierpnia. Łodyga rośliny osiąga 1,5 m. Jest łatwo łamliwa, jednak sztywna i prosta. Rozgałęzia się ku górze. Jej liście są nieparzysto-pierzaste, pofałdowane, o ząbkowanych przylistkach. Listki na górnej stronie są ciemnozielone i nagie, natomiast u dołu jaśniejsze, filcowane. Kwiaty mają żółtobiałe zabarwienie, są drobne i tworzą wierzchotkę dwuramienną na wierzchołku łodygi. Na jeden kwiat składa się 5-6 płatków korony, wiele pręcików o długich nitkach oraz słupków śrubowato skręconych. Owocem wiązówki jest jednonasienna niełupka, skręcona spiralnie, o brunatnej barwie. Kłącze rośliny ma liczne włókniste korzenie, jest grube i zdrewniałe (Wink, Wyk, 2008).
Wiązówka jest rośliną ozdobną, jednak posiada też inne zastosowania. Jej liście były kiedyś wykorzystywane do otrzymywania żółtozielonego barwnika do tkanin oraz do aromatyzowania piwa i wódki. Jednakże do najbardziej istotnych zastosowań owej byliny należą jej właściwości lecznicze, które są zasługą obecności w niej szeregu składników aktywnych. Oprócz KAS są nimi: flawonoidy, glikozydy fenolowe i olejek eteryczny (uwalniające aldehyd salicylowy i salicylan metylu), garbniki, enzym gaulteraza (rozkładający monotropitinę i spiraeinę), wanilina, a także w bardzo małej ilości heliotropina. Kiedyś kwas acetylosalicylowy otrzymywano właśnie z wiązówki błotnej. Dziś, jednak, na skalę przemysłową produkuje się go syntetycznie.
Historia chemicznej syntezy KAS sięga już 1853 roku, kiedy to pierwszy raz otrzymał ją syntetycznie we Francji Charles Federic Gerhardt. Jakiś czas później doświadczenie przeprowadził także Carl Johann Kraut w Niemczech. Kolejne wydarzenie miało niebagatelny wpływ na uruchomienie masowej produkcji aspiryny. W niemieckiej firmie Bayer, chemik Artur Eichengrun prowadzący badania nad estryfikacją fenoli, polecił Felixowi Hoffmannowi wytworzyć porcję kwasu acetylosalicylowego do badań biologicznych. Farmakolog firmy Bayer nie wyraził jednak zgody na wykorzystywanie KAS jako leku. Jednakże Eichengrun dołożył swoich starań o to, ażeby ponownie przeanalizować otrzymane wyniki oraz przeprowadzić niezależne badania. Chemik dowiódł tym samym, że kwas acetylosalicylowy ma niezaprzeczalną wyższość nad innymi salicylanami i warto uruchomić jego produkcję przemysłową. Firma Bayer zastrzegła nazwę leku jako Aspirin®.
Aspirynę otrzymuje się w reakcji kwasu salicylowego z bezwodnikiem octowym, gdzie katalizatorem jest kwas siarkowy (Ryc. 5) (Kupryszewski i współaut., 1998; Mastalerz, 2000). Proces ten jest bardzo wydajny (ok. 90%).
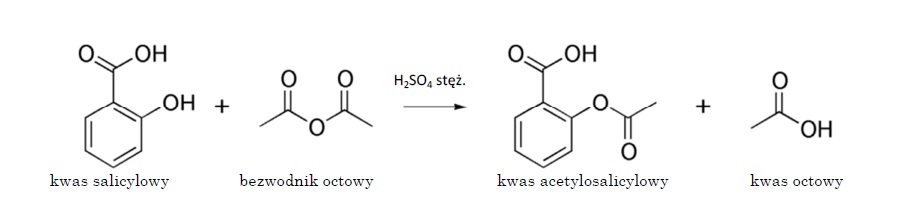
Ryc. 5. Reakcja syntezy kwasu acetylosalicylowego
(źródło: http://upload.wikimedia.org/wikipedia/commons/e/ef/Aspirin_synthesis.png uzupełnione o informacje na podstawie: Kupryszewski i współaut., 1998; Mastalerz, 2000).
Zapis półstrukturalny tej reakcji przedstawia się następująco:
C6H4(OH)COOH + (CH3CO)2O → C6H4(OCOCH3)COOH + CH3COOH
Mechanizm reakcji można opisać w kilku etapach. Na początku następuje wytworzenie protonu w reakcji dysocjacji kwasu siarkowego (VI), a potem protonowanie eterowego atomu tlenu w bezwodniku octowym. Następnie wiązanie między węglem a tlenem zostaje zerwane, w wyniku czego powstaje kwas octowy i kation acetyliowy. Kolejnym etapem jest atak niewiążącej pary elektronowej atomu tlenu grupy hydroksylowej na karbonylowy atom węgla kationu acetyliowego. Na koniec kation wodorowy odłącza się i zostaje utworzona cząsteczka KAS.
Podana reakcja posiada szereg zalet. Jest ona nieodwracalna i prowadzi do wytworzenia estrów (estryfikacja) o wysokich wydajnościach. Co więcej, bezwodnik jest silnie aktywowanym kwasem karboksylowym, który wykazuje wyższą reaktywność w stosunku do alkoholi. Umożliwia on także otrzymywanie estrów fenoli, których nie można otrzymać w zwykłej reakcji estryfikacji, czyli łącząc fenol z kwasem karboksylowym. Inną zaletą tego typu reakcji jest możliwość prowadzenia procesu bez konieczności ogrzewania. Takie łagodne warunki pozwalają otrzymać estry z substratów wrażliwych albo nietrwałych w wysokiej temperaturze (Kupryszewski i współaut., 1998; Mastalerz, 2000).
Monika Armuła
Katolicki Uniwersytet Lubelski Jana Pawła II
Wydział Biotechnologii i Nauk o Środowisku
Katedra Fizjologii i Biotechnologii Roślin
Ul. Konstantynów 1i, 20-708 Lublin
E-mail: monika.armula@gmail.com
LITERATURA
BINKMANN, H., GEHRMANN, B., WIBMEY-ER, K. 2007. Fitoterapia. Racjonalne porady i zalecenia. MedPharm: Wrocław.
BEDNARCZYK, R. 2009. Pharmindex. Kompendium leków. CMPMedica: War-szawa.
BEDNARSKA, D. 1975. Wiązówka błotna. Zielarski Biuletyn Informacyjny 1, 7-8.
BORKOWSKI, B. 1994. Rośliny lecznicze w fitoterapii. Kompendium roślin leczniczych. IRiPZ: Poznań.
BOSS, N., JACKLE, R. 1996. Hexal. Pod-ręczny leksykon medycyny. Wydawnic-two Medyczne Urban & Partner: Wro-cław.
BRODA, B. 1986. Zarys botaniki farma-ceutycznej. Podręcznik dla studentów farmacji. PZWL: Warszawa.
BYLKA, W. 1997. Farmakognozja: leki roślinne. WUAM: Poznań.
CHRUBASIK, S., EISENBERG, E., BALAN, E., WEINBERGER, T., LUZZATI, R., CON-RADT, C. 2000. Treatment of low back pain exacerbations with willow bark extract: a randomized double-blind study. American Journal of Medicine 109, 9-14.
CHRUBASIK, S., KUNZEL, O., MODEL, A., CONRADT, C., BLACK, A. 2001. Treatment of low back pain with herbal or synthetic anti-rheumatic: a randomized controlled study. Willow bark extract for low back pain. Rheumatology 40, 1388-1393.
CHRUŚCIEL, T. L., GIBIŃSKI, K. 1991. Leksykon leków. PZWL: Warszawa.
CHWALIBOGOWSKA-PODLEWSKA, A., PODLEWSKI, J. 2009. Leki współczesnej terapii – Encyklopedia dla Lekarzy i Farmaceutów. T. 2. Medical Tribune Group: Warszawa.
CZERWIŃSKI, W. 1997. Fizjologia Roślin. PWN: Warszawa.
DURNER, J., SHAH, J., KLESSIG, D. F. 1997. Salicylic acid and disease re-sistance in plants. Trends in Plant Science 7, 266-274.
DYMOWSKI, W. 2000. Ostatnie doniesie-nia na temat występowania działań nie-pożądanych i interakcji podczas stoso-wania roślinnych produktów leczniczych. Biuletyn Leków T. 9, nr 3-4.
GRYNKIEWICZ, G., HENNIG, J. 2010. Związki naturalne w farmacji i medycy-nie. Kwas salicylowy i fenolokwasy. Standardy medyczne. Pediatria. T. 2, 10-16.
HAYAT, Q., HAYAT, S., IRFAN, M., AHMAD, A. 2010. Effect of exogenous salicylic acid under changing environment: A review. Environmental and Experi-mental Botany 68, 14–25.
JANICKI, S., SZNITOWSKA, M., FIEBIG, A. (RED.) 2008. Farmacja stosowana: pod-ręcznik dla studentów farmacji. PZWL: Warszawa.
JANKIEWICZ, N. S. (RED.) 1997. Regulato-ry wzrostu i rozwoju roślin. T. 1. Wła-ściwości i działanie. PWN: Warszawa.
JOHNSON, O., MORE, D. 2009. Drzewa. Miltico: Warszawa.
JÓZEFOWSKI, SZ. 2000. Detekcja i transdukcja sygnału w reakcjach odpor-nościowych roślin. I. Rozpoznanie i wczesne etapy transdukcji sygnału. Po-stępy Biologii Komórki 4, 609-621.
KĄCZKOWSKI, J. 1982. Biochemia roślin. T. 1. PWN: Warszawa.
KOHLMÜNZER, S. 1993. Farmakognozja. PZWL: Warszawa.
KOMISJA E. 2000. Salicis cortex (kora wierzby) Bundesanzeiger nr 228 z 05.12.1984, sprostowanie BAnz nr 164 z 01.09.1990. Rośliny lecznicze w fitotera-pii. Kompendium roślin leczniczych uszeregowanych według zakresów sto-sowania na podstawie monografii opra-cowanych przez Komisję E Federalnego Urzędu Zdrowia RFN. IRiPZ: Poznań.
KOPCEWICZ, J., LEWAK, S. (RED.) 2002. Fizjologia roślin. PWN: Warszawa.
KORZENIEWSKA-RYBICKA, I., KURKOW-SKA-JASTRZĘBSKA, I., MASEŁBAS, W., GUMUŁKA, W. S. (RED.) 1996. Podręczny leksykon leków. PZWL: Warszawa.
KOSTOWSKI, W., HERMAN, Z. S. 2007. Farmakologia. Podstawy farmakoterapii. PZWL: Warszawa.
KRAUZE-BARANOWSKA, M., SZUTOWICZ, E. 2004. Wierzba – źródło surowców leczniczych o działaniu przeciwzapalnym i przeciwbólowym. Postępy Fitoterapii 12, 77-86.
KUBIKOWSKI, P. (RED.) 1969. Poradnik terapeutyczny. PZWL: Warszawa.
KUBIKOWSKI, P. (RED.) 1975. Poradnik terapeutyczny. PZWL: Warszawa.
KUPRYSZEWSKI, G., SOBOCIŃSKA, M., WALCZYNA, R. 1998. Podstawy prepara-tyki organicznej. Wydawnictwo Gdań-skie: Gdańsk.
LAMER-ZARAWSKA, E., KOWAL-GIERCZAK, B., NIEDWORAK, J. 2007. Fito-terapia i leki roślinne. PZWL: Warsza-wa.
LINDSEY, A. S., JESKEY, H. 1957. The Kolbe-Schmitt Reaction. Chemical Re-views 57, 583-620.
LUTOMSKI, J., ALKIEWICZ, J. 1993. Leki roślinne w profilaktyce i terapii. PZWL: Warszawa.
MASTALERZ, P. 2000. Chemia organicz-na. Wydawnictwo Chemiczne: Wrocław.
MATYSIAK, K., ADAMCZEWSKI, K. 2009. Regulatory wzrostu i rozwoju roślin – kierunki badań w Polsce i na świecie. Postępy w Ochronie Roślin 49, 1810-1816.
METRAUX, J. P. 2002. Recent break-throughs in the study of salicylic acid biosynthesis. Trends in Plant Science 2, 1360-1385.
MIĘDZYBRODZKI, R. 2004. Kierunki po-szukiwań i zastosowanie niesteroido-wych leków przeciwzapalnych. Postępy Higieny i Medycyny Doświadczalnej 58, 438-448.
MORRISON, R. T., BOYD, R. N. 2011. Chemia organiczna. T. 1. PWN: War-szawa.
MOWSZOWICZ, J. 1997. Pospolite rośliny naczyniowe Polski. PWN: Warszawa.
NOWIŃSKI, M. 1980. Dzieje roślin i upraw leczniczych. PWRiL: Warszawa.
OŻAROWSKI, A., RUMIŃSKA, A. (RED.) 1990. Leksykon roślin leczniczych. Pań-stwowe Wydawnictwo Rolnicze i Leśne: Warszawa.
PASTOK, P. 2000. Kompendium leków naturalnych. Medyk: Warszawa.
SAMOCHOWIEC, L. 1995. Kompendium fitoterapii dla lekarzy i farmaceutów oraz studentów medycyny. VOLUMED: Wrocław.
SCHMID, B., LUDTKE, R., SELBMANN, H. K., KOTTER, I., TSCHIRDEWAHN, B., SCHAFFNER, W., HEIDE, L. 2001. Efficacy and tolerability of a standardized willow bark extract in patients with osteoarthritis: randomized placebo-controlled, double blind clinical trial. Phytotherapy Research 15, 344-350.
SMOLARZ, H. D., SOKOŁOWSKA-WOŹNIAK, A. 2001. Aktywność farmakologiczna wyciągów z Filipendula ulmaria i Fili-pendula hexapetala. Postępy Fitoterapii 4, 12-15.
STRZELECKA, H., KOWALSKI, J. (RED.) 2000. Encyklopedia zielarstwa i zioło-lecznictwa. PWN: Warszawa.
SZAFER, W., KULCZYŃSKI, S., PAWŁOW-SKI, B. 1986. Rośliny polskie. cz. 1. PWN: Warszawa.
SZWABOWICZ, A. 1957. Receptura wete-rynaryjna. T. 1. PWN: Wrocław.
SZWEYKOWSKA, A. 1997. Fizjologia Ro-ślin. WUAM: Poznań.
WINK, M., WYK, B. 2008. Rośliny leczni-cze świata: Ilustrowany przewodnik. MedPharm: Wrocław.
WOLIŃSKI, J. 1985. Chemia organiczna: podręcznik dla studentów farmacji. PZWL: Warszawa.
ZEJC, A., GORCZYCA, M. (RED.) 2004. Chemia leków. PZWL: Warszawa.
ZIELONKA, A., ŁONIEWSKI, I., SAMOCHO-WIEC, L., JUŹWIAK, S. 2000. Właściwości farmakologiczne standaryzowanego wyciągu z kory wierzby (Cortex salicis). Postępy Fitoterapii 2, 23-30.
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=338&loc=ec_rcs
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=16760658&loc=ec_rcs
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=4133&loc=ec_rcs
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=3059&loc=ec_rcs
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=8361&loc=ec_rcs
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=54686350&loc=ec_rcs
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=6880&loc=ec_rcs
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=5147&loc=ec_rcs
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=220693&loc=es_rss
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=134223251&loc=es_rss
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=56367245&loc=es_rss
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=16760658&loc=ec_rcs
http://www.drugbank.ca/drugs/DB01398
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=4133&loc=ec rcs
http://www.drugbank.ca/drugs/DB00861
http://pubchem.ncbi.nlm.nih.gov/summary/ summary.cgi?cid=6880&loc=ec_rcs
http://www.drugbank.ca/drugs/DB08797
http://www.drugbank.ca/drugs/DB01399
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=134223251&loc =es_rss
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=2244&loc=ec_rcs
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=2244#x27
http://www.drugbank.ca/drugs/DB00945
http://upload.wikimedia.org/wikipedia/commons/a/ac/Kolbe-Schmitt.png
http://upload.wikimedia.org/wikipedia/commons/e/ef/Aspirin_synthesis.png
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje