Stale wydłużające się listy pacjentów oczekujących na transplantacje, zainicjowały poszukiwanie alternatywnych źródeł organów i tkanek nadających się do przeszczepu [1], [2]. Świnia wydaje się być najbardziej optymalnym dawcą komórek, tkanek i organów dla ludzi [1], [3]. Niestety, terapeutyczne wykorzystanie komórek czy tkanek pochodzących od świń nie jest do końca bezpieczne. Zabieg ksenotransplantacji organów pochodzących od świni niesie ze sobą ryzyko odzwierzęcych infekcji wirusowych [1]. 
Człowiek jako biorca z jednej strony musi się zmierzyć z powikłaniami związanymi z samym zabiegiem i leczeniem immunosupresyjnym, a z drugiej z negatywnymi skutkami infekcji endogennymi retrowirusami - PERV (ang. porcine endogenous retrovirus). Obecność PERV stwarza poważny problem w perspektywie wykorzystania komórek, tkanek lub narządów świni do przeszczepów międzygatunkowych [4]. Na całym świecie prowadzone są stale liczne badania in vitro, mające na celu poznanie mechanizmów infekowania komórek ludzkich przez PERV oraz obserwację zmian jakie wywierają na komórki [5], [6].
Ze względu na specyfikę budowy i funkcjonowanie wirusów w środowisku, badacze definiują je na wiele różnych sposobów. Najpowszechniej określa się je jako cząsteczki nukleoproteidowe o charakterze infekcyjnym [7], niejednokrotnie nadając im miano pasożytów wewnątrzkomórkowych [8].
Zapewne dzieję się tak dlatego, że wirusy nie posiadają typowej budowy komórkowej, a do namnażania się potrzebują żywej komórki gospodarza. Najbardziej zewnętrzną część wirusa zbudowana jest z białkowego kapsydu, który pełni funkcje ochronne. Niektóre wirusy posiadają dodatkowo otoczkę lipidową, pochodzącą z błony komórkowej gospodarza. Część infekcyjną wirusów stanowi ich materiał genetyczny w postaci kwasu nukleinowego, który znajduje się we wnętrzu wirusa. W tym miejscu należy wspomnieć, że informacja genetyczna wirusów może być przenoszona za pomocą kwasu dysoksyrybonukleinowego – DNA (ang. deoxyribonucleic acid) lub kwasu rybonukleinowego - RNA (ang. ribonucleic acid), nigdy na obu jednocześnie [8].
Biorąc pod uwagę właśnie rodzaj kwasu nukleinowego oraz dodatkowo przebieg transkrypcji i replikacji dokonano podziału wirusów. Według klasyfikacji Baltimore wyróżnia się siedem klas wirusów. Według wskazanego klucza, w klasie VI znajdują się retrowirusy [9]. Cechę charakterystyczną stanowi diploidalny genom retrowirusów, który składa się z dwóch cząsteczek jednoniciowego kwasu rybonukleinowego – ssRNA (ang. single-stranded RNA) o dodatniej polarności. Z kolei, sama rodzina Retroviridae (retrowirusów) dzieli się na siedem rodzajów: Alpharetrovirus, Betaretrovirus, Gammaretrovirus, Deltaretrovirus, Epsilonretrovirus, Lentivirus i Spumavirus [8].
Budowa retrowirusów Najistotniejszą częścią retrowirusów jest nukleokapsyd. Dwie sensowne nici RNA, stanowią genom winionu i są ze sobą połączone przy końcach 5’ za pomocą wiązań wodorowych. Na końcu 5’ zlokalizowany jest starter dla odwrotnej transkryptzay. Stanowi go cząsteczka tRNA pochodząca z zainfekowanej komórki. Cząsteczka ta jest związana z nicią RNA wirusa na zasadzie komplementarności, na odcinku o długości około 18 pz. Końec 3’ każdej z nici, jest zakończony 9 nukleotydowym fragmentem poliadenylowym (poliA) [8], [10].
Genom retrowirusów zawiera sekwencje kodujące w postaci genów: gag, pol, env oraz niekodujące, czyli długie powtórzenia końcowe – LTR (ang. long terminal repeats) (ryc.1.). LTR znajdują się na obu końcach RNA. Zawsze zawiera trzy regiony: fragment R (ang. reduntant) i dwie sekwencje unikatowe U3 i U5 (ang. unique).
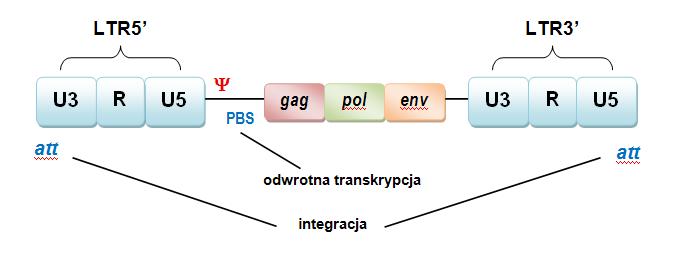 Ryc. 1. Organizacja sekwencji RNA genom wirionu retrowirusowego [21].
Ryc. 1. Organizacja sekwencji RNA genom wirionu retrowirusowego [21].W regionie U3 fragmentu LTR 5’ znajduje się promotor i wzmacniacz (ang. enhancer). Polimeraza RNA za pomocą promotora jest kierowana do specyficznego miejsca, w którym następuje inicjacja transkrypcji. Natomiast enhancera ułatwia przebieg transkrypcji, nie zależnie od tego czy znajduję się w pobliżu miejsca inicjacji, czy też nie. Region U5 jest odpowiedzialny za etapy konstruowania wirionów i integracji z DNA gospodarza. Cząsteczka starterowego tRNA znajduję się na końcu 5’ związana przez sekwencją - PBS (ang. primer binding site). Za obszarem LTR 5’, zlokalizowane są: sygnał pakujący , wymagany podczas zamykania genomu wirusa w kapsydzie oraz sygnał donorowy. Przed LTR3’, pomiędzy genami pol i env ulokowany jest sygnał akceptorowy. Fragmenty LTR rozpoczynają i kończą miejsca sygnały integracyjnego w postaci sekwencji att, pomiędzy którymi następuje integracja genomu [8], [10].
Geny gag, pol i env przechowują informacje dotyczące białek strukturalnych oraz enzymatycznych retrowirusów. Najbardziej zewnętrznym elementem wirionu jest osłonka lipidowa pochodząca z błony komórkowej gospodarza. W jej strukturę wyróżniamy białka powierzchniowe i transbłonowe, które są kodowane przez retrowirusowy gen env. Białko powierzchniowe umożliwia kontakt wirusa z właściwym receptorem, znajdującym się na powierzchni komórki gospodarza. Z kolei, białko transbłonowe jest odpowiedzialne za fuzję osłonki wirusa z błoną komórkową infekowanej komórki. W wyniku ekspresji genu gag są powstają białka matrycowe, białka kapsydu oraz nukleoproteina. Kapsyd otaczający materiał genetyczny retrowirusów posiada charakterystyczny kształt ikosaedru (dwudziestościanu równoległobocznego) utworzony przez białko kapsydu. Natomiast, samo białko wchodzące w skład nukleoproteiny stanowi element bezpośredniej ochrony materiału genetycznego. Za pomocą odpowiedniej domeny, wiąże RNA. Do białek enzymatycznych retrowirusów należą: integraza, polimeraza oraz odwrotna transkryptaza o właściwości RNA-zy H. Wszystkie wymienione enzymy są kodowane przez gen pol [8], [10].
Retrowirusy posiadają bardzo skomplikowaną i złożoną strukturę. Charakter ich genomu oraz poszczególne elementy budowy wirionu ukierunkowuje schemat przebiegu procesów replikacji oraz ekspresji genów. W wewnątrzkomórkowym cyklu rozwojowym wirusy te wykorzystują własną odwrotną transkryptazę. Po dostaniu się retrowirusów do komórki następuje przepisanie informacji genetycznej z RNA na DNA w procesie zwanym odwrotną transkrypcją. Genom retrowirusa, w postaci dwuniciowego DNA, zostaje włączony do chromosomu gospodarza. Na skutek integracji dochodzi do powstania pro wirusa. Etap ten jest konieczny do przebiegu dalszego rozwoju, gdyż jedynie w takiej postaci możliwa jest replikacja retrowirusa wraz z genomowym DNA gospodarza [8].
Retrowirusy egzogenne i endogenneIstotny aspekt przy omawianiu zagadnień związanych z retrowirusami stanowi ich dalszy podział na retrowirusy egzogenne oraz endogenne - ERV (ang. endogenous retrovirus). Wymienione grupy retrowirusów posiadają wspólny schemat budowy genomu, w którego skład wchodzą standardowo geny gag, pol i env oraz sekwencja LTR. Przekazywanie retrowirusów egzogennych odbywa się w sposób horyzontalny. Mają zdolność do zakażania komórek somatycznych i integracji z ich genomem. Istnieje teoria mówiąca o tym, że retrowirusy endogenne są pozostałością po retrowirusach egzogennych. Przypuszcza się, iż w przebiegu ewolucji retrowirusy egzogenne uległy wbudowaniu do chromosomów komórek rozrodczych kręgowców. Zgodnie z prawami Mendla, ERV są stale przekazywane wertykalnie organizmom potomnym [6], [11], a liczba ich kopii wzrasta w genomie z pokolenia na pokolenie [12]. Większość ERV to wirusy defektywne, które utraciły zdolność do ekspresji oraz formowania wirionów potomnych. Ich inaktywacja nastąpiła w skutek licznych mutacji takich jak insercje czy delecje, których nagromadzenie doprowadziło do zmiany ramek odczytu [6]. Nie zmienia to faktu, że część retrowirusów endogennych w dalszym ciągu ulega retrotranspozycji. W przypadku defektywnych ERV do namnażania może dochodzić w komórkach linii płciowej, z wykorzystaniem białek pochodzących od innych retrowirusów. W takim przypadku mówimy o retrotranspozycji trans. Z kplei retrotranspozycja cis dotyczy ERV, które zachowały prawidłowe sekwencje genów (nie uległy nieuszkodzeniu w wyniku mutacji) [6], [13].
W kategorii wirusów pochodzenia zwierzęcego, na szczególną uwagę zasługują endogenne retrowirusy świń. Stanowią istotne zagadnienie, zwłaszcza w perspektywie wykonywania zabiegów ksenotransplantacji. Obecnie świnia znajduje się na pierwszym miejscu w kategorii potencjalnego dawcy narządów, tkanek, czy komórek dla ludzi. Jednakże nadal nie ma jednoznacznej odpowiedzi na podstawowe pytanie, czy wirusy dawcy są w stanie zakażać komórki biorcy pokonując barierę międzygatunkową [5], [14].
Subtypy PERVEndogenne retrowirusy świń stanowią integralną część ich materiału genetycznego. Do tej pory zidentyfikowano 32 miejsca w genomie świni, do których włączają się PERV [5]. W zależności od źródła, endogenne retrowirusy świń klasyfikuje się jako rodzaj Alpharetrovirus [5] lub Gammaretrovirus [15], [5], [16], [17], [18]. Jak wszystkie retrowirusy posiadają typowy genom, składający się z genów niosących informację genetyczną: pol, gag i env, oflankowany sekwencjami niekodującymi LTR [16]. PERV również podlegają mutacjom, co przekłada się na upośledzenie syntezy prawidłowych białek wirusowych i zahamowanie tworzenia aktywnych cząstek potomnych [12]. To nie zmienia faktu, że istnieje realne ryzyko uwolnienia wirionów PERV z komórek świń. Co więcej, w niektórych przypadkach odnotowuje się niski poziom ekspresji i wiremię PERV [4], [6].
W obrębie endogennych retrowirusów świń wyróżnia się trzy subtypy, a mianowicie PERV-A, PERV-B i PERV-C. Podstawę do ich klasyfikacji stanowią różnice sekwencji nukleotydów w obrębie genu env, w wyniku ekspresji którego powstają glikoproteiny otoczki. W przypadku pozostałych wirusowych genów (gag i pol) obserwuje się wysoki poziom homologii [1], [5], [14], [16]. Podobieństwo sekwencji nukleotydowej genów gag i pol jest wyższe niż 95% [16].
W dotychczasowych badaniach, obecność PERV-A i PERV-B potwierdzono u różnych ras świń, we wszystkich przebadanych stadach [5]. Oba subtypy posiadają umiejętność infekowania różnych typów ludzkich komórek w warunkach in vitro, a także linii komórkowych należących do różnych gatunków zwierząt. Subtyp PERV-A w porównaniu do subtypu PERV-B wykazuje wyższy stopień wiremii [5], [14], [15], [16], [17], [18].
Wynik wielu badań przeprowadzonych na tkankach świń dowodzą, że nie wszystkie osobniki wykazują obecność PERV-C [15]. Przeprowadzono badania na wybranym stadzie świń, gdzie w analizowanej grupie u ok. 42% osobników nie wykryto DNA PERV-C (zwierząt nie poddano uprzednio żadnej modyfikacji genetycznej) [5]. Co więcej, subtyb ten jest całkowicie niezdolny do zakażania ludzkich komórek [17]. Procesy replikacyjne PERV-C zachodzą jedynie w komórkach należących do świni [14], [15], [18].
Subtypy endogennych retrowirusów: PERV-A oraz PERV-C odznaczają się wysoką zdolnością do przeprowadzania między sobą procesu rekombinacji. W efekcie czego, powstają rekombinanty PERV A/C. PERV-C może wniknąć do komórek należących do człowieka, tylko przez posiadanie fragmentu genu env wirusa typu A. Otrzymany rekombinant cechuje się zwiększonym stopniem infekcyjności w stosunku do komórek ludzkich [15]. Czas infekcji wrażliwych komórek ulega skróceniu, a sama produkcja nowych wirionów przybiera na sile [16], [17].
„Wróg”?Długie sekwencje powtórzone LTR umożliwiają integrowanie materiału genetycznego wirusa z genomem zainfekowanej komórki gospodarza. PERV mogą modyfikować stopień infekcyjności względem komórek człowieka na dwa sposoby. Po pierwsze przez utworzenie cząstek rekombinujących, po drugie poprzez zmiany w sekwencji DNA. Wykazano, że na wzrost stopnia replikacji PERV ma wpływ kilkukrotne powielenie fragmentu LTR o długości 39 nukleotydów [16]. Należy pamiętać, że region U3 w LTR na końcu 5’ zawiera sekwencje wzmacniające [10]. Przypadkowość miejsca wbudowywania się materiału genetycznego PERV w genom komórek ludzkich może prowadzić do poważnych konsekwencji. Możliwe jest wyciszenie lub aktywacja danych genów komórkowych. Ponadto istnieje ryzyko indukcji procesu transformacji nowotworowej zainfekowanej komórki [16].
W przypadku badań prowadzonych in vitro endogenne retrowirusy świń mają zdolność do zakażania komórek ludzkich w warunkach hodowli komórkowych [5]. Badania nad PERV prowadzi się z wykorzystaniem różnego typu komórek ludzkich i świńskich. Wśród komórek pochodzących od człowieka najczęściej wykorzystuje się fibroblasty, komórki śródbłonka, komórki monojądrzaste krwi, komórki krezki, komórki pnia oraz komórki szpiku kostnego [1], [12]. Do komórek wrażliwych na infekcje PERV należy linia, wywodząca sie z pierwotnych ludzkich embrionalnych komórek nerek - HEK 293 (ang. human embryonic kidney epithelial cell line 293) [12]. Wśród komórek znajdujących zastosowanie w hodowlach in vitro pochodzących od świń, dużą popularnością cieszy się linia komórkowa fibroblastów nerki PK-15 (ang. porcine kidney epithelial cell line). Komórki tej linii aktywnie produkują dwa subtypy endogennych retrowirusów świń: PERV-A oraz PERV-B zdolne do infekowania ludzkich komórek w sztucznych warunkach [14], [15], [19], [20].
W celu szerszego zobrazowania ryzyka infekcji ze strony PERV, należy zbadać możliwość transmisji endogennych retrowirusów świń do różnego typu komórek ludzkich. Li i wsp. [14] podjęli się zadania zmierzającego do oceny zdolność PERV do zakażania ludzkich komórek in vitro, wywodzących się z różnych tkanek. Eksperyment obejmował prowadzenie hodowli świńskiej linii komórkowej PK15, a następnie infekowanie supernatantem zawierającym PERV, komórek ludzkich. Od momentu infekcji, inkubacja ludzkich komórek z supernatantem trwała 7 dni. Po tym czasie wykryto obecność DNA oraz RNA PERV w linii komórkowej HEK-293, ludzkich embrionalnych mioblastach, ludzkich komórkach wątroby 7721 i ludzkich embrionalnych endotelialnych komórkach nerki. Jednocześnie, nie stwierdzono obecności PERV w ludzkich embrionalnych komórkach chrząstki oraz ludzkich komórkach wątroby Chung. Uzyskane wyniki wskazują na różną podatność komórek ludzkich na infekcję endogennymi retrowirusami świń.
Z kolei, Yu i wsp. [21] zbadali efekt długoterminowego wpływu PERV na komórki linii HEK-293. Podobnie jak Li i wsp. [14], do zainfekowania hodowli ludzkiej linii komórkowej HEK-293 użyto supernatantu, pochodzącego z uprzednio rozchodowanej hodowli świńskiej linii komórkowej PK-15. Komórki linii HEK-293 wraz z supernatantem były inkubowane przez 24 godziny. Po tym czasie komórki linii HEK-293 przeniesiono do nowych naczyń hodowlanych i kultywowano dalej przez 6 miesięcy. Po zakończeniu półrocznych badań stwierdzono, że poziom aktywności odwrotnej transkryptazy w zainfekowanych komórkach HEK-293 był prawie 200 razy niższy niż w komórkach linii PK-15. Zainfekowane komórki dały wynik pozytywny testów na obecność PERV-A oraz PERV-B. Poza tym, nie wykazano znaczących różnic we wzroście i morfologii zainfekowanych komórek HEK-293, w stosunku do niezainfekowanej kontroli.
Innym typem komórek, które z powodzeniem wykorzystuje się w badaniach nad PERV są jednojądrzaste komórki krwi obwodowej - PBMC (ang. peripheral blood mononuclear cell). W oparciu o dane literaturowe i wstępne analizy, w zależności od kryterium jakie zostanie przyjęte przy doborze świń, wyizolowane komórki mogą stanowić źródło PERV-A, PERV-B oraz PERV-C. Quinn i wsp. [22] do genotypowania PERV wykorzystywał PBMC pochodzące od miniaturowych świń. Martin i wsp. [23] użył PBMC uwalniające wszystkie 3 subtypy PERV, którymi następnie zainfekowano ludzkie komórki utrzymywane w hodowli in vitro. Należy zaznaczyć, że z zainfekowanych komórek ludzkiej linii 293, wyizolowano dwa różne rekombinanty PERV-A/C.
Niejednokrotnie, na dalszych etapach eksperymentu naukowego dochodzi konieczności włączenia do badań żywych organizmów. Zwłaszcza w przypadku badania infekcyjności endogennych retrowirusów świń, których wpływ na komórki daje się łatwiej ocenić w warunkach in vitro, niż in vivo.
Simeonovic i wsp. [20] w swoich badaniach postanowił ocenić rolę PERV, jako czynnik wywołujący reakcję odrzuceniową ksenograftu. Jednocześnie wykorzystał hodowle linii komórkowych oraz eksperymenty na zwierzętach. Biorcami ksenograftu były myszy, a przeszczepioną tkanką były fragmenty tarczycy królika. Przed zabiegiem ksenotransplantacji myszy poddawano immunizacji, między innymi przy użyciu komórek linii PK-15 oraz osobno za pomocą PERV wyprodukowanych przez komórki linii PK-15. Po przeszczepieniu myszom króliczej tarczycy, u myszy uprzednio poddanych immunizacji odrzut narządu nastąpił szybciej, w porównaniu z grupą kontrolną. Na podstawie uzyskanych wyników autorzy pracy wysnuli wnioski, iż endogenne retrowirusy świń stanowią znaczące źródło obcych antygenów, które dodatkowo przyczyniają się do wywołania reakcji odrzuceniowej świńskich ksenograftów.
Kolejne zagrożenia niesie ze sobą możliwość rekombinacji genetycznej nie tylko pomiędzy pojedynczymi zwierzęcymi wirusami. Taki proces może zajść również między sekwencjami genomowymi PERV i sekwencjami endogennych retrowirusów ludzi (HERV). Takie zjawisko może wpłynąć na ekspresję HERV lub doprowadzić do powstania hybryd wirusowych typu PERV/HERV [16].
A może jednak „brat”?W danych literaturowych nie odnotowano przypadków, w których opisano by transmisję PERV do organizmu człowieka. Na święcie żyją pacjenci, którzy po przeprowadzonej ksenotransplantacji tkanek pochodzących od świni, nie wykazują wiremii żadnego z subtypów PERV. Na podstawie licznych obserwacji nasuwa się wniosek, że endogenne retrowirusy świń nie mają zdolności do zakażania komórek człowieka w warunkach in vivo [5].
Rretrowirusy endogenne można rozpatrywać w dwóch kategoriach, w zależności od tego, czy występują w genomie ludzkim, czy zwierzęcym. ERV znajdujące się w strukturze genomu człowieka określa się mianem ludzkich endogennych retrowirusów - HERV (ang. human endogenous retrovirus). W zależności od cytowanych źródeł podaje się, że HERV stanowią od 1 do 8% całkowitego ludzkiego genomu [6]. Wyróżnia się trzy klasy HERV. Kluczem do podziału na klasy jest podobieństwo genu pol ludzkich endogennych retrowirusów do genów pol retrowirusów egzogennych. W obrębie klasy I znajdują się HERV ujawniające podobieństwo regionu pol (jak również gag i env) do gammaretrowirusów. Klasę II stanowią endogenne retrowirusy homologiczne do betaretrowirusów. Natomiast w skład klasy III wchodzą HERV, które charakteryzują się niewielkim stopniem pokrewieństwa do spumaretrowirusów [6], [24]. Na bazie genów gag, pol i env HERV, powstają typowe dla retrowirusów białka strukturalne i enzymatyczne.
Do tej pory jeszcze jednoznacznie nie wyjaśniono roli HERV w etiologii chorób człowieka. Próbuje się powiązać obecność tych sekwencji z występowaniem chorób autoimmunologicznych np. cukrzyca typu 1, czy stwardnienie rozsiane, a także niektórymi rodzajami nowotworów oraz chorób objawiających się zaburzeniami psychicznymi w np. schizofrenia. W kontekście retrowirusów egzogennych istnieje obawa przed rozszerzeniem tropizmu komórkowego lentiwirusów. Otóż, retrowirusy egzogenne mogą wykorzystać produkty ekspresji genomu HERV [6]. Poza negatywnym wpływem endogennych retrowirusów, wskazuję się także na ich pozytywną funkcję ochronną przed zakażeniem egzogennymi retrowirusami. Sam mechanizm opiera się na blokowaniu receptorów komórkowych przez produkty białkowe retrowirusów endogennych, co uniemożliwia przyłączenie się retrowirusów egzogennych i przeciwdziała infekowaniu komórek [5].
W świetle najnowszych doniesień naukowych, na temat infekcyjności PERV, możliwość przeprowadzania bezpiecznych zabiegów ksenotransplantacji z wykorzystanie świń jako dawców organów, nadal pozostaje pod znakiem zapytania. Jedynie nagłośnienie dyskusja na arenie międzynarodowej, wymiana poglądów, doświadczeń i własnych obserwacji badaczy, może w przyszłości doprowadzić do sytuacji, w której endogenne retrowirusy świń nie będą stanowiły zagrożenia odzwierzęcymi infekcjami wirusowymi. Dokładne poznanie wrażliwości komórek na infekcje ze strony PERV, z rozróżnieniem na poszczególne subtypy, przyczynia się do zobrazowania skali problemu. Stałe poszerzanie wiedzy w tym zakresie daje podstawę do dobierania właściwej strategii działań, mających na celu zwalczanie lub zapobieganie wiremii PERV.
Autor: mgr Agnieszka Gudek
Literatura1. Cyganek-Niemiec A., Strzalka-Mrozik B., Pawlus-Lachecka L., Wszolek J., Adamska J., Kudrjavtseva J.,Zhuravleva I., Kimsa M., Okla H., Kimsa M., Gudek A., Mazurek U. Degradation effect of diepoxide fixation on porcie endogenous retrowirus DNA In heart valves: molecular aspects. Int J Artif Organs 2012; 35 (1): 25-26.
2. Sung R.S., Galloway J., Tuttle-Newhall J. E., et al. Organ Donation and Utilization in the United States, 1997-2006. Am J Transplant 2008; 8:922-934.
3. Cozzi E., Bosio E., Seveso M., Rubello D., Ancona E. Xenotransplantation as a model of integrated, multidisciplinary research. Organogenesis 2009; 5 (1): 288-296.
4. Boneva R.S., Folks T.M. Xenotransplantation and risks of zoonotic infections. Annals of Medicine 2004; 36: 504–517.
5. Mazurek U., Janikowska G., Wydmuch Z., Wilczok T. Infekcje wirusowe w ksenotransplantacjach i strategie ich wykrywania. Biotechnologia 2006; 1 (72): 125-132.
6. Zwolińska K. Sekwencje pochodzenia retrowirusowego w genomie człowieka. Ludzkie endogenne retrowirusy (HERV). Postępy Higieny i Medycyny Doświadczalnej 2006; 60: 637-652.
7. Trząski L. Słownik biologiczny. Katowice: Videograf II; 2005: 421.
8. Piekarowicz A. Podstawy wirusologii molekularnej. Warszawa: PWN; 2004: 127-130, 340-349, 364-366.
9. Carter J., Saunders V. Virology: principles and applications. Chichester: Wiley; 2007: 119.
10. Szyda A., Rossowska J., Pajtasz-Piasecka E., Duś D. Czy komórki dendrytyczne modyfikowane wektorami retrowirusowymi z genami cytokin staną się narzędziem terapeutycznym? Postępy Higieny i Medycyny Doświadczalnej 2006; 60: 552-562.
11. Palmarini M., Mura M., Spencer T.E. Endogenous betaretroviruses of sheep: teaching new lessons in retroviral interference and adaptation. Journal of General Virology 2004; 85: 1–13.
12. Machnik G., Sypniewski D., Mazurek U., Rożek-Kostórkiewicz J., Wilczok T. Endogenne wirusy świni (PERV) jako zagrożenie w ksenotransplantacjach. Medycyna Weterynaryjna 2004; 60(4): 345-348.
13. Katzourakis A., Rambaut A., Pybus O.G.: The evolutionary dynamics of endogenous retroviruses. Trends in Microbiology 2005; 13: 463–468.
14. Li Z., Ping Y., Shengfu L., Yangzhi Z., Jingqiu C., Youping L., Hong B. Variation of Host Cell Tropism of Porcine Endogenous Retroviruses Expressed in Chinese Banna Minipig Inbred. Intervirology 2006; 49: 185-191.
15. Moalic Y., Blanchard Y., Félix H., Jestin A. Porcine Endogenous Retrovirus Integration Sites in the Human Genome: Features in Common with Those of Murine Leukemia Virus. Journal of Virology 2006; 80 (22): 10980-10988.
16. Smorąg Z., Słomski R., Modliński J.A. Od genomu tura po ksenotransplantacje. Poznań: Ośrodek Wydawnictw Naukowych 2008: 109-115.
17. Moalic Y., Félix H., Takeuchi Y., Jestin A., Blanchard Y. Genome Areas with High Gene Density and CpG Island Neighborhood Strongly Attract Porcine Endogenous Retrovirus for Integration and Favor the Formation of Hot Spots. Journal of Virology 2009; 83 (4): 1920-1929.
18. Sypniewski D., Machnik G., Mazurek U., Wilczok T., Smorąg Z., Jura J., Gajda B. Distribution of Porcine Endogenous Retroviruses (PERVs) DNA in Organs of a Domestic Pig. Annals of Transplantation 2005; 10 (2): 46-51.
19. Le Tissier P., Stoye J., Takeuchi Y. Two sets of human-tropic pig retrovirus. Nature 1997; 389: 681.
20. Simeonovic C.J., Ziolkowski A.F., Popp S.K., Milburn P.J., Lynch C.A., Hamilton P., Harris K., Brown D.J., Bain S.A.F., Wilson D., Gibbs A.J. Porcine Endogenous Retrovirus Encodes Xenoantigens Involved in Porcine Cellular Xenograft Rejection by Mice. Transplantation 2005; 79: 1674–1682.
21. Yu P., Zhang L., Li S.F., Li Y.P., Cheng J.Q., Lu Y.R., Bu H. Long-term effects on HEK-293 cell line after co-culture with porcine endogenous retrovirus. Transplantation Proceedings 2005; 37(1): 496-499.
22. Quinn G, Wood J., Suling K., Arn S., Sachs D.H., Schuurman H.J., Patience C. Genotyping of Porcine Endogenous Retroviruses from A Family of Miniature Swine. Journal of Virology 2004; 78 (1): 314-319.
23. Martin S.I., Wilkinson R., Fishman J.A. Genomic presence of recombinant porcine endogenous retrovirus in transmitting miniature swine. Virology Journal 2006; 3:91.
24. Nelson P.N., Carnegie P.R., Martin J., Davari Ejtehadi H., Hooley P., Roden D., Rowland-Jones S., Warren P., Astley J., Murray P.G. Human endogenous retroviruses. Journal of Clinical Pathology: Molecular Pathology 2003; 56: 11–18.


 Człowiek jako biorca z jednej strony musi się zmierzyć z powikłaniami związanymi z samym zabiegiem i leczeniem immunosupresyjnym, a z drugiej z negatywnymi skutkami infekcji endogennymi retrowirusami - PERV (ang. porcine endogenous retrovirus). Obecność PERV stwarza poważny problem w perspektywie wykorzystania komórek, tkanek lub narządów świni do przeszczepów międzygatunkowych [4]. Na całym świecie prowadzone są stale liczne badania in vitro, mające na celu poznanie mechanizmów infekowania komórek ludzkich przez PERV oraz obserwację zmian jakie wywierają na komórki [5], [6].
Człowiek jako biorca z jednej strony musi się zmierzyć z powikłaniami związanymi z samym zabiegiem i leczeniem immunosupresyjnym, a z drugiej z negatywnymi skutkami infekcji endogennymi retrowirusami - PERV (ang. porcine endogenous retrovirus). Obecność PERV stwarza poważny problem w perspektywie wykorzystania komórek, tkanek lub narządów świni do przeszczepów międzygatunkowych [4]. Na całym świecie prowadzone są stale liczne badania in vitro, mające na celu poznanie mechanizmów infekowania komórek ludzkich przez PERV oraz obserwację zmian jakie wywierają na komórki [5], [6].
Recenzje