

|
Zamknij X
|
Comet assay zaliczan jest do metod o dużym potencjale poznawczym. Pozwala ona na badanie pojedynczych jąder komórkowych w żelu agarozowym, dzięki czemu możliwe jest badanie uszkodzeń DNA spowodowanych działaniem czynników genotoksyczności. Jako pierwsi , którzy podjęli się ocenie uszkodzeń DNA w pojedynczych komórkach byli Rydberg i Johanson (1978). Właściwa metoda testu kometkowego wprowadzona została przez Ӧstlinga i Johansona w 1984 roku. Test ten opiera się na badaniu komórek o różnym pochodzeniu, tak więc mogą to być komórki wątroby, krwi czy nabłonka. Najważneijsze jednak jest by komórki te zawierały jądro zawierające DNA [9].
Ekspozycja komórek na działanie endogennych i egzogennych czynników genotoksycznych powoduje, że dochodzi do modyfikacji chemicznych DNA. Działania te uważane są za potencjalne źródła mutacji w komórkach. W wyniku ekspozycji na te fizyczne lub chemiczne czynniki może dochodzić do modyfikacji struktury DNA, a dalej do uszkodzeń typu:
Ze względu na fakt występowania różnorodnych uszkodzeń DNA, konieczne jest stosowanie różnych technik badawczych. I tak, do pomiaru poziomu jednoniciowych i dwuniciowych pęknięć DNA wykorzystuje się elektroforezę pojedynczych komórek, określaną mianem comet assay (ang. single cellgel electrophoresis, SCGE). Metoda ta służy również do identyfikacji wszelkich modyfikacji DNA możliwych do przekształcenia w pęknięcia na drodze chemicznej lub enzymatycznej [1].
Comet assay- zasada metody
Metoda polega na elektroforetycznym rozdziale jądrowego DNA, dzięki czemu możliwe jest obserwowanie fragmentacji DNA. W trakcie analizy badane komórki unieruchomiane są w żelu agarozowym. Jednak nie ma to nic wspólnego z tradycyjną elktroforezą, ponieważ w przypadku comet assay agaroza znajduje się na szkiełkach mikroskopowych. Tak przygotowane preparaty poddawane sa następnie lizie alkalicznej, co powoduje uwolnienie DNA z jądra komórkowego. Zastosowanie buforu lizującego o wysokiej sile jonowej wspomaga dysocjację białek od DNA. Po tym etapie przeprowadzana jest elektroforeza, która prowadzona jest w warunkach neutralnych, w standardowym buforze TBE, lub w warunkach alkalicznych. Po rozdziale, DNA poddaje się barwieniu fluorescencyjnemu lub solami srebra, a następnie analizuje się uzyskany obraz pod mikroskopem fluorescencyjnym [1], [3].
W trakcie analizy parametrem bezpośrednio mierzonym jest zmiana właściwości elektroforetycznych zmodyfikowanego kwasu nukleinowego (co obserwuje się w postaci wędrówki nici DNA w polu elektrycznym). Badane DNA w trakcie elektroforezy migruje w stronę anody z prędkością, która zależna jest od stopnia jego fragmentacji. Szybkość przemieszczania się badanych fragmentów w trakcie analizy jest proporcjonalna do stopnia fragmentacji. Ostatnim etapem comet assay jest analiza mikroskopowa, gdzie obraz mikroskopowy uszkodzonej komórki poddanej procedurze elektroforezy wyglądem przypomina kometę tj. „głowa” odpowiada miejscu, w którym unieruchomiono komórkę przed lizą, zaś „ogon” stanowią pętle i fragmenty nici DNA zrelaksowane i uwolnione ze struktur jądrowych w wyniku pęknięć- stąd też bierze się nazwa tej techniki [3].
Fluorochromy wykorzystywane w technice comet assay
Najczęściej wykorzystywanymi a zarazem najbardziej znanymi barwnikami używanymi w teście kometkowym są: bromek etydyny i SYBR Green. Stosowany jest także DAPI(4',6-Diamidino-2-phenylindole),jak również wszystkie inne barwniki, które wykazują powinowactwo do DNA [4].
Zdjęcie: Wzór DAPI (C16H15N5) [7].
Przygotowanie barwników
Bromek etydyny:
Najczęściej wykorzystywany jest roztwór bromku etydyny o stężeniu 2µg/ml. Wykonuje się go ze stężonegp 10x roztworu roboczego (20µg/ml), który bezpośrednio przed użyciem rozcieńczany jest odpowiednio wodą. Barwnik ten emituje wysokie tło w analizie comet assay.
SYBR Green:
Przygotowywany jest w stosunku 10µl barwnika 1:100 z 90 µl 10 mM Trisu (o pH=7.5). Przed zmieszaniem odczynników, jako pierwszy w kolejności przygotowywany jest roztwór Sybr Green w DMSO(dimetylosulfotlenek) w stosunku: 1 µl stężonego barwnika z 99 µl DMSO. Tak przygotowany roztwór jest stabilny przez kilka godzin. Inną odmianą tego barwnika jest SYBR Gold, który przygotowywany jest w analogiczny sposób jak SYBR Green [1].
Znane są rónież inne metody wizualizacji, w tym np. barwienie praparatów z wykorzystaniem azotanu srebra, który pozwala na ich obserwcję w białym świetle [8].
Barwienie preparatów solami srebra (wg kucharczyk.com.pl):
Wykorzystanie comet assay
Metoda kometowa znalazła bardzo szerokie zastosowanie m.in. do: badania mechanizmów uszkadzania i naprawy DNA, określania genotoksyczności,a także w analizie uszkodzeń DNA powstałych in vivo . Ponadto, metodę wykorzystuje się w diagnostyce schorzeń, których bezpośrednią przyczyną są zaburzenia naprawy DNA [1].Znalazła także zastosowanie w cytologii, biochemii kwasów nukleinowych oraz immunologii, z powodzeniem stosowane jest również w farmakologii, medycynie(głównie onkologia, diagnostyka DNA). Comet assay w ochronie środowiska wykorzystywana jest do monitorowania występowania czynników fizycznych i chemicznych, które uszkadzają DNA w środowisku człowieka, zaś wprzemyśle spożywczym znalazła zastosowanie w kontroli stopnia napromieniowania żywności (w procesie sterylizacji radiacyjnej) [2].
Przygotowanie szkiełek podstawowych do analizy- wykonanie:
Każde używane szkiełko na samym początku należy poddać odtłuszczeniu. W tym celu należy je zanurzyć w roztworze acetonu ( chloroformu, etanolu lub metanol), po czym wysuszyć lub opalić na płomieniem. Następnie, w zlewce przygotować 1% roztwór agarozy NMP (zlewkę umieścić we wrzącej łaźni wodnej). W agarzoie zanurzać szkiełko, a po wyciągnięciu za pomocą bibuły należy zetrzeć nadmiar agarozy z dolnej powierzchni szkiełka, a tak przygotowe szkiełko pozostawić do wyschnięcia. Bardzo ważne na tym etapie jest, by zaznaczyć na której stronie szkiełka znajduje się agaroza, ponieważ po całkowitym wyschnięciu warstwa ta może być niewidoczna [1]. W celu większej oszczędności roztworu agarozy, zamiast zanurzania szkiełek, można na nie nanieść pipetą automatyczną 100 µl gorącej agarozy [1].
Utrwalanie i barwienie komórek:
Szkiełka z komórkami, bezpośrednio po etapie neutralizacji wybarwia się np. roztworem bromku etydyny w stężeniu 2 µg/ml. Na szkiełko nanosi się kroplę barwnika, po czym całość przykrywa się szkiełkiem nakrywkowym. Tak przygotowany preparat należy oglądać w mikroskopie fluorescencyjnym (z zastosowaniem odpowiedniego filtra). Ze względów praktycznych bardiej zalecane jest utrwalanie szkiełka w 96% alkoholu etylowym lub metanolu. Dzięki zastosowaniu tej metody utrwalania możliwe jest dłuższe przechowywanie preparatów. Przed samą analizą pod mikroskopem, szkiełka utrwalone w alkoholu wybarwia się z wykorzystaniem bromku etydyny (jak wyżej) [1].
Metoda elektroforezy kometkowej cieszy się bardzo dużą popularnością, ponieważ stosunkowo prosta i tania. Wraz z rozwojem technik badawczych, również comet assay doczekała się szerokiego wykorzystania- nie tylko w biologii molekularnej lecz również w medycynie, farmacji czy ochronie środowiska [4], [5].
Analiza obrazu kometek
Analiza prowadzona jest przez zliczanie komórek z danego zakresu wielkości ogona komety. Jednakże, najczęściej do analizy obrazu wykorzystuje się specjalistyczne oprogramowanie. Do opisu zaobserwowanych uszkodzeń w badanych preparatach stosuje się %DNA w ogonie lub "intensywność" ogona. Wykorzystywany jest także tzw.współczynniki Tail Moment (=długość_ogona*%DNA_ w_ ogonie/100) bądź „Olive Moment”. Oba współczynniki stosowane są do opisywania wzrostu uszkodzeń DNA do pewnego zakresu. Przekroczenie tego zakresu powoduje, że zwiększenie uszkodzeń nie ma wpływu na wzrostu wartości badanych współczynników [1],[2].
CometAssay® Starter Kits – postępowanie (zdjęcie poniżej)
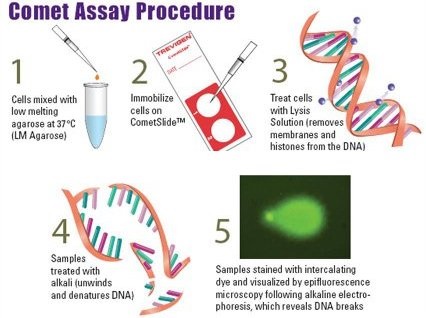
Zdjęcie: Comet assay, procedura wg AMS Biotechnology, CometAssay® Starter Kits, http://www.amsbio.com/Comet-Assays.aspx [6].
Promieniowanie jonizujące
Rozróżnia się dwa mechanizmy działania promieniowania jonizującego:
Promieniowanie jonizujące jest wszechobecnym fizycznym czynnikiem, którego działanie na organizmy żywe powoduje uszkodzenia w DNA – jest to zjawisko powszechnie znane. W trakcie fizyko-chemicznych interakcji z komórkowym DNA dochodzi do powstawania wielu pierwotnych zmian, gdzie zazwyczaj rozróżnia się kilka typów uszkodzeń DNA:
- SSBs (single strand-breaks) - pojedynczoniciowe,
- DSBs (double strand-breaks) - podwójnoniciowe,
- wiązania krzyżowe DNA-DNA, DNA-białko,
- uszkodzenia purynowe i pirymidynowe [4], [5].
Test kometkowy pozwala na wykrycie uszkodzeń DNA oraz na badanie kinetyki naprawy DNA na poziomie pojedynczej komórki. Różnorodność możliwych modyfikacji tego testu ułatwia wykrywanie zarówno uszkodzeń typu SSBs, jak i DSBs, a także wiązań niestandardowych i wielu innych. Test kometkowy może być stosowany zarówno do dzielących się, jak i nie dzielących się komórek i komórek tkanek, które miały bezpośredni kontakt z czynnikiem genotoksycznym (środkiem genotoksyczności) [4].
W swoich badaniach Garaj-Vrhovac V. i Kopjar N (2002), wykorzystały metodę comet assay jako biomarker narażenia do oceny wpływu napromieniowania pracowników medycznych (50 osób), zawodowo narażonych na promieniowanie jonizujące. Jako kontrolę w swoich badaniach wykorzystały dane zaberane od 50 innych pracowników – nienarażonych na promieniowanie. Rodzaj uszkodzeń DNA badano przez pomiar stopnia migracji DNA w leukocytach krwi obwodowej (krew pobrana od grupy badanej i kontrolnej). Próbki krwi obwodowej od osób narażanych na promieniowanie i grupy kontrolnej pobrano przez nakłucie żyły do probówek zawierających heparynę. Alkaliczny test kometkowy przeprowadzono na pobranych próbach bezpośrednio po transporcie krwi.
Comet assay (procedura wg Garaj-Vrhovac V. i Kopjar N (2002))[4].
Test w przeprowadzonym badaniu prowadzono w warunkach zasadowych, opierając się na metodologii opisanej przez Singh i wsp. (1988).
Wykonanie:
Matowe szkiełko pokryto 1% agarozą (Sigma) o normalnej temperaturze topnienia (NMP), a po zestaleniu żel usunięto ze szkiełka. Następnie, szkiełko pokryto 0,6% agarozą NMP. Gdy warstwa ta się utrwaliła (zastygła), drugą warstwę zawierającą próbkę krwi zmieszano z 0,5% agarozą o niskiej temperaturze topnienia (LMP), po czym umieszczono na szkiełku. Po upływie 10 minut (zastyganie na lodzie) szkiełka pokryto 0,5% agarozą LMP.
Następnie, szkiełko zanurzono na 1 godzinę w świeżo przygotowanym lodowatym roztworze do lizy (tj.: 2,5M NaCl, 100mM Na2EDTA; 10mM Tris-HCl; 1% Na-sarcosinate (Sigma), pH 10); 1% Triton X-100; 10% sulfotlenek dimetylu). Dodany świeży odczyynik do próbki spowoduował lizę komórek i rozkład DNA. Po etapie lizy, szkiełko umieszczono w aparacie do elektroforezy poziomej od strony anody, napełnionym świeżym buforem do elektroforezy (tj.: 300 mM NaOH; 1mM Na2EDTA pH=13), a płytki umieszczono na 20 minut w buforze zasadowym, aby umożliwić odwijanie DNA. Proces denaturacji i elektroforezy prowadzono w temperaturze 4°C przy słabym świetle. Rozdział elektroforetyczny prowadzono przez 20 minut przy 25V [[4].
Po elektroforezie szkiełka delikatnie przepłukano (3x) w buforze do zobojetniania (tj.: 0,4M Tris-HCl o pH=7,5) w celu usunięcia nadmiaru zasady i detergentów. Każdy preparat wybarwiono bromkiem etydyny (o stężeniu 20µg/ml), po czym przykrywano je szkiełkiem nakrywkowym. Szkiełka przechowywano w temperaturze 4°C w zamkniętych pojemnikach, aż do momentu analizy [4].
Wyniki badań Garaj-Vrhovac V. i Kopjar N (2002)
Po analizie z wykorzystaniem comet assay, na podstawie otrzymanych wyników stwierdzono, że w grupie osób narażonych zawodowo na działanie promieniowania jonizującego (działanie z różną częstotliwością), znacząco wzrasta poziom uszkodzeń DNA, w porównaniu do grupy kontrolnej [4].
Rozdział elektroforetyczny preparatów (procedura wg Brzuzan P. i wsp. (2007)):
Bufor elektroforetyczny (alkaliczny):
Ważne, by do zakończenia rozdziału elektroforetycznego wszystkie czynności prowadzone były przy przyciemnionym świetle , ponieważ intensywne światło powoduje uszkodzenia DNA [1].
Autor: Lidia Koperwas
Literatura:
[1]. http://www.kucharczyk.com.pl/instrukcje/poradykometa.pdf . Dr Marcin Schmidt, Uniwersytet Przyrodniczy w Poznaniu, http://www.up.poznan.pl/~mschmidt/
[2]. http://www.kucharczyk.com.pl/
[3]. Shaposhnikov S.A. , Salenko V.B., Brunborg G., Nygren J.,Collins A.R., 2008. Single-cell gel electrophoresis (the comet assay): Loops or fragments? ELECTROPHORESIS Volume 29, Issue 14, pages 3005–3012, No. 14 July 2008, (abstract). http://onlinelibrary.wiley.com/doi/10.1002/elps.200700921/abstract;jsessionid=3C8F2CE80444FC705895101756E003C6.f04t04
[4], Garaj-Vrhovac V., Kopjar N., 2002. The alkaline Comet assay as biomarker in assessment of DNA damage in medical personnel occupationally exposed to ionizing radiation. • Oxford Journals Life Sciences & Medicine Mutagenesis Volume 18, Issue 3 Pp. 265-271. http://mutage.oxfordjournals.org/content/18/3/265.full
[5]. Podstawy radioterapii nowotworów, sytuacje szczególne w leczeniu nowotworów. http://e-onkologia.am.wroc.pl/docs/PODSTAWY_RADIOTERAPII_SYTUACJE%20SZCZEGOLNE%20W%20LECZENIU%20NPL_WF.pdf
[6]. Standardised DNA Damage quantitation with the CometAssay® Electrophoresis System,AMS Biotechnology, http://www.amsbio.com/Comet-Assays.aspx
[7]. http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=2954
[8].Brzuzan P., Woźny M., Łuczyński M.K., 2007. Toksykologia molekularna, przewodnik do ćwiczeń, Olsztyn 2001. http://biotechnology.keyland.biz/pdf/tox_mol_updated.pdf
[9]. Jurczyk Ł., Lewandowska R., Brzuzan P., Woźnicki P., 2003. Zastosowanie metody kometowej w wykrywaniu genotoksyczności substancji chemicznych u ryb. Komunikaty Rybackie, 5/2003. http://pracownicy.uwm.edu.pl/brzuzan/files/poz_19_Other_papers_Zastosowanie_metody_kometowej.pdf
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje