

|
Zamknij X
|
Test Amesa określa poziom mutacji powrotnych z histydynowej auksotrofii do prototrofii w wielu specjalnie skonstruowanych mutantach szczepu Salmonella typhimurium LT2 (Ames, 1975). Mutanty te posiadają mutację rfa, powodującą przepuszczalność błony komórkowej w wyniku zmiany jej składników lipoproteinowych [2]. Mutacja rfa zwiększa przepuszczalność błony lipopolisacharydowej, co ułatwia genotoksynom penetrację do środka komórki bakteryjnej [7].
W toku badań skonstruowano wiele różnych szczepów testowych zawierających różne mutacje w operonie histydyny. Przeprowadzone badania nie tylko pogłębiły znajomość charakteru pierwotnych mutacji lecz także pozwoliły na poznanie dróg, które prowadzą do rewersji [2]. Na początku badań, auorzy testu zalecali stosowanie pięciu szczepów bakterii, tj.: TA 1535, TA 1537, TA 1538, TA 98 oraz szczep TA 100. W aktualnie prowadzonych badaniach zaleca się stosowanie zestawu czterech szczepów tj.: TA 97 (szczep wrażliwy na czynniki utleniające), szczep TA 98, TA 100 oraz TA 102, które to są wrażliwe na większą liczbę mutagenów niż szczep TA 1537.
Zestaw tych czterech szczepów pozwala na wykrycie szerokiego zakresu różnorodnych mutagenów, przy jednoczesnym zastosowaniu mniejszej liczby szczepów testowych. Jednakże, mimo zalet stosowania mniejszej liczby szczepów, wielu badaniach ze względów technicznych nadal wykorzytsuje się pierwotny zestw szczepów. Jednym z powodów tego „staromodnego” postępowania jest fakt, że szczep TA 102 wykazuje dużą zmienność liczby kolonii rewertantów spontanicznych (obesność niestabilnego plazmidu pAQ1), zaś powolny wzrost kolonii rewertantów szczepu TA 97 powoduje utrudnienie liczenia kolonii po standartowej 48-godzinnej inkubacji komórek [2].
Frakcja S-9
Szczepy bakterii używane w standardowym teście Amesa nie mają zdolności syntezowania histydyny, w związku z czym nie rosną na pożywce pozbawionej promutagenu (mutagenu aktywowanego frakcją S-9). Zazwyczaj bakterie, które wykorzystywane są w testach wykrywania mutagenności związków nie zawierają całego spektrum monooksygenaz, które występują u wyższych organizmów. Tak więc, niemożliwe jest wykazanie właściwości mutagennych związków, które wymagają aktywacji, aby nabyć właściwości mutagenne lub rakotwórcze. Aktywację tych związków przeprowadza się poprzez inkubację w tzw. postmitochondrialnym supernatancie komórek wątrób ssaków. Supernatant ten jest powszechnie znany jako frakcja S9. Frakcja S9 zawiera większość różnych monooksygenaz i innych enzymów, które są niezbędne do aktywacji potencjalnych mutagenów i kancerogenów. Najczęściej stosowana jest frakcja S9 uzyskiwana z wątrób szczurów rasy Sprague-Dawley [3].
Zastosowanie testu Amesa do oceny zanieczyszczenia powietrza atmosferycznego
Obserwowany ciągły wzrost zachorowalności na choroby nowotworowe w dużej mierze związany jest z zanieczyszczeniem powietrza atmosferycznego. Zjawisko to łączy się z pogarszaniem warunków środowiskowych, które z kolei wywierają niekorzystny wpływ na organizmy żywe. Wdychane zanieczyszone powietrze stanowi nośnik ksenobiotyków, na które narażany jest organizm człowieka drogą oddechową. Przeprowadzane badania ujawniły, że w zanieczyszczonym powietrzu atmosferycznym może występować ponad 2000 związków zaliczanych do różnych klas chemicznych, a związki te razem tworzą bardzo złożone mieszaniny o nieznanych właściwościach biologicznych. Wśród diagnozowanych zanieczyszczeń powietrza największą grupę stanowią zanieczyszczenia gazowe, a zaraz po nich plasują się zanieczyszczenia pyłowe, które stanowią z kolei bardzo złożoną mieszaninę substancji organicznych i nieorganicznych. Średnica wdychanych pyłów wpływa na ich szkodliwość dla organizmów żywych[4].
Wpływ zanieczyszczeń pyłowych na organizmy żywe
Przeprowadzone badania nad zanieczyszczeniami powietrza atmosferycznego ujawniły, że największą szkodliwośc dla organizmó żywych mają drobnocząsteczkowe zanieczyszczenia pyłowe o wielkości poniżej 5 μm. Wykazują one największą aktywność biologiczną,gdyż tak małę cząsteczki mają zdolność przenikania do pęcherzyków płucnych układu oddechowego zarówno ludzi, jak i zwierząt. Następnie, z zalegających w pęcherzykach płucnych pyłów uwalniane są stopniowo związki chemiczne, które wywierają bardzo niekorzystny wpływ na komórki nabłonkowe pęcherzyków płucnych. Zanieczyszczenia przedostają się przez pęcherzyki płucne do układu krwionośnego, a stąd już rozprzestrzeniają się po całym organizmie. Wśród znanych zanieczyszczeń bardzo niebezpieczne okazały się tzw. wielopierścieniowe węglowodory aromatyczne (określane skrótem WWA). Związki te wykazują działanie mutagenne i kancerogenne w organizmach żywych [4].
Wszystkie badania pyłowych zanieczyszczeń powietrza są niezwykle przydatne w analizie zagrożenia zdrowotnego związanego z obecnością związków chemicznych zaadsorbowanych na pyle zawieszonym. Dzięki tym badaniom, możliwe jest określenie genotoksyczności i cytotoksyczności zanieczyszczeń chemicznych zaadsorbowanych na cząstkach pyłu. Wśród najczęściej wykorzystywanych w tym celu testów znalazł się test Amesa (płytkowy test Salmonella). Test tencharakteryzuje się wysoką zdolnością prognozowania czynników mutagennych i potencjalnie kancerogennych. Test Amesa jest jednym z testów wchodzących w skład testów krótkoterminowch wykorzystywanych w toksykologii genetycznej. Ponadto, jest to najpowszechniej stosowany biotest w badaniach nad mutagennością pyłowych zanieczyszczeń powietrza atmosferycznego [4].
Piekarska K. i wsp. badali mutagenność pyłów z wykorzystaniem bakteryjnego testu Salmonella(test Amesa). Głównym założeniem testu jest sprawdzenie, czy badany materiał powoduje mutację powrotną (tzw. rewersję) specjalnych histydynozależnych (his-) szczepów bakterii Salmonella typhimurium LT2.
W badaniach (Piekarska K. i wsp.) stosowano dwa szczepy testowe:
- Salmonella typhimurium TA98
- oraz szczep YG1041,
gdzie szczep TA98 wykrywa mutageny typu zmiany fazy odczytu, zaś szczep YG1041 jest pochodną szczepu TA 98. Szczep YG1041 charakteryzuje się podwyższoną wrażliwością na nitrowe, aminowe i hydroksyloaminowe pochodne wielopierścieniowych węglowodorów aromatycznych. Badania przeprowadzono na wariantach bez i z aktywacją metaboliczną frakcji mikrosomalnej S9 (frakcja aktywowana Aroclorem 1254- pochodzącą z wątroby szczura rasy Wistar).
Frakcja S9 w powyższych badaniach stosowana była jako metaboliczny aktywator promutagenów. W badaniach określano zarówno liczbę rewertantów indukowanych spontanicznie, które stanowiły kontrolę negatywną, a także liczbę rewertantów indukowanych pod wpływem mutagenów diagnostycznych (była to kontrola pozytywna). Jako związki mutagenne dla badań prowadzonych bez aktywacji metabolicznej frakcją S9 wykorzystano 2,4,7-trinitro-9-fluorenon(TA98) oraz 2,6-dinitrotoluen (YG1041), z kolei dla badań prowadzonych w obecności frakcji S9: 2-aminofluoren (TA98, YG1041) [4].
Oryginalny test opracowany przez Amesa z czasem został zmodyfikowany, co miało na celu zwiększenie jego czułości i wiarygodności. W teście zaczęto stosować komórki posiadające liczne mutacje w DNA, co powoduje, że są one szczególnie wrażliwe na działanie różnorodnych mutagentów. Wynika to z faktu braku mechanizmów naprawy uszkodzeń DNA w komórkach z mutacjami, tak więc usunięcie powstających uszkodzeń jest w nich niemożliwe.
Test Amesa stosowany jest na całym świecie, ponieważ pozwala na ograniczenie eksperymentów z wykorzystaniem zwierząt. Przeprowadzone testy potwierdziły, że badanie jest wiarygodne, ponieważ na 100 przebadanych związków mutagennych, dla 84 potwierdzono pozytywny wynik w teście przeprowadzonym na bakteriach Salmonella typhimurium, zaś dla 91 w teście z Escherichia coli [1].
Wśród obecnie stosowanych testów, ocena związku pod kątem jego efektu mutagennego polega na wykryciu zmian w materiale genetycznym wywołanych przez badany związek chemiczny lub czynnik fizyczny. Wynik testu zależy od zastosowanego systemu, w którym badany był efekt mutagenny. W badaniach z wykorzystaniem systemów bakteryjnych wynikiem może być zwiększona liczba kolonii bakteryjnych, co powodowane jest rewersją mutacji w szczepach zmutowanych, które nie są zdolne do tworzenia kolonii bez zewnętrznego źródła niezbędnego skłądnika. Składnikiem takim może być np. histydyna lub tryptofan. Zmiana barwy danej kolonii może świadczyć o indukcji mutacji przez badany czynnik [5].
Standardowy test Amesa wykorzystuje zdolność do rewersji histydyno-zależnych auksotroficznych mutantów auksotroficznych Salmonella typhimurium do tzw. form prototroficznych. Formy prototroficzne wykazują zdolność do wzrostu na podłożu minimalnym tj. takiego, które pozbawione jest czynnnika wzrostowego czyli aminokwasu L-histydyny. W toku doświadczeń skonstruowano wiele szczepów testowych, które charakteryzują się posiadaniem mutacji w opieronie biosyntezy histydyny. W przypadku zadziałania danego czynnika mutagennego na taki szczep dochodzi do rewersji mutacji, w wyniku czego dochodzi do przywrócenia funkcjonalności genu, dzięki czemu komórki znów mogą rosnąć na podłożu nie zawierającym histydyny [5].
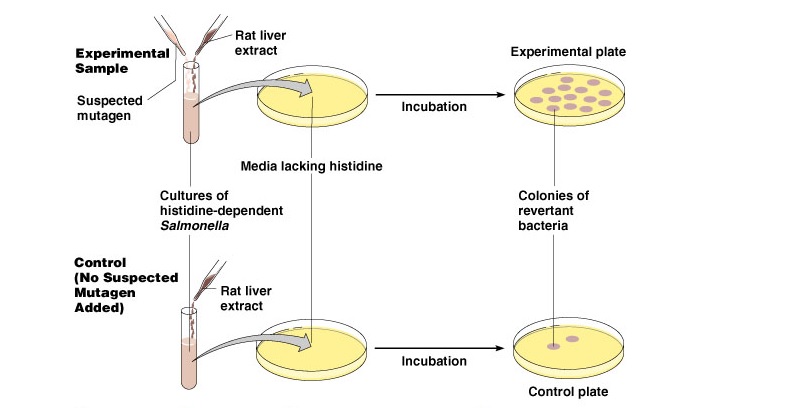
Zdjęcie: http://classes.midlandstech.edu/carterp/Courses/bio225/chap08/Microbial%20Genetics%205.htm
Test Amesa [wg procedury pochodzącej ze strony http://www.pg.gda.pl/chem/Katedry/Leki/Dydaktyka/MetodyBiotechWOS/ames.pdf)
- komórki szczepu testowego (odświeżone po całonocnej hodowli)
- badany związek (potencjalny mutagen)
- ewentualnie frakcja mikrosomalna z wątroby szczura (wariant z aktywacją dl amutagenów pośrednich)
Wykonanie doświadczenia [5]:
Test Amesa – badanie mutagennych właściwości danej substancji (Schlegel H.H, 2003).
W teście wykorzystuje się mutanta Salmonella typhimurium, który do prawidłowego wzrostu wymaga histydyny. Szczep ten odznacza się bardzo małą częstością rewersji. Do bakterii wskaźnikowych (Salmonella typhimurium) dodaje się ekstrakt z wątroby szczura, po czym komórki wysiewane są na stałą pożywkę mineralną (wykluczającą wzrost mutanta). Ekstrakt z wątroby szczura powoduje enzymatyczne przekształcenie badanej substancji, co w konsekwencji prowadzi do ujawnienia jej ewentualnych właściwości mutagennych. Na płytce z posianymi komórkami umieszcza się bibułę nasączoną badaną substancją. Jeżeli substancja ta wykazuje działanie mutagenne niektóre z powstałych mutantów mogą wykazywać zdolność do syntezy histydyny, czyli do wzrostu na minimalnym podłożu ( zwłaszcza w obszarze dyfuzji badanej substancji mutagennej) [1].
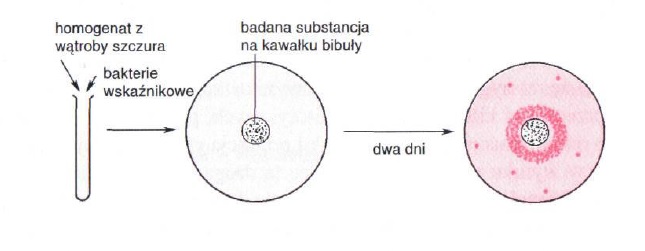
Zdjęcie: Test Amesa [1].
Jak już wspomniano, test Amesa jest krótkoterminowym testem odwrotnej mutacji bakterii, specjalnie zaprojektowany do wykrywania szerokiej gamy substancji chemicznych, które mogą powodować uszkodzenie genetyczne. Uszkodzenia te w następnej kolejności prowadzą do mutacji genowych. Test służy do oceny właściwości mutagennych, z wykorzystaniem bakterii nie syntetyzujących histydyny (Salmonella typhimurium oraz Escherichia coli). Powstające mutacje powodują uszkodzenia w DNA wywołane różnymi mechanizmami. W przypadku braku zewnętrznego źródła histydyny komó®ki bakterii ni emoga rozwijąc się, a co za tym idzie nie tworzą kolonii. Tylko te bakterie, u których zostanie przywrócona zdolnośc do syntezy histydyny są w stanie utworzyć kolonie [6]. Ilość rewertantów spontanicznie indukowanej kolonii na płytce jest względnie stała. Jednakże, gdy czynnik mutagenny jest dodawane do płytki, liczba kolonii rewertantów na płytce zwiększa się zazwyczaj w sposób zależny od dawki. Test Amesa jest stosowany na całym świecie w celu określenia potencjału mutagennego nowych chemikaliów i leków [6].
Szczepy Salmonella wykorzystywane w teście Amesa mają różne mutacji w różnych genach operonu histydyny. Każda z tych mutacji ma być dostosowana do mutagenów, które działają poprzez różne mechanizmy. Dodatkowe mutacje projektowane są tak, by szczepy były bardziej wrażliwe na szeroką gamę substancji [6].
Test Amesa w wersji mikropłytkowej
W teście Amesa w wersji mikropłytkowej zastosowano sześć szczepów bakteryjnych wykrywających różne rodzaje uszkodzeń materiału genetycznego:
Szczepy TA100, TA1535 oraz obydwa szczepy E.coli wykrywają mutację substytucji par zasad, natomiast TA98 i TA1537 wykrywają mutację zmiany ramki odczytu. Oznaczenia wykonano w dwóch wersjach tj.: z dodatkiem frakcji S-9, jak i bez niej.
Ponad dwukrotny wzrost liczby kolonii z mutacją powrotną (liczby dołków ze zmienioną barwą) po ekspozycji na badany związek chemiczny w porównaniu z tzw. wartością bazową - oznacza mutagenne działanie związku w teście Amesa [7].

Zdjęcie: http://biuletynfarmacji.wum.edu.pl/1205Jawecki/Jawecki.html
Inkubacja badanych próbek z bakteriami testowymi
Ocenę genotoksyczności i toksyczności prowadzono zgodnie z procedurą standardową tj. inkubując roztwory badanych próbek z bakteriami w ciemności.Ocenę fotogenotoksyczności i fototoksyczności przeprowadzono stosując zmodyfikowaną procedurę testów (Skrzypczak i in., 2010). Mikropłytki testowe zawierające badane próbki razem z bakteriami naświetlano lampami UVA (365 nm) i UVB (302 nm) 90 min (test Amesa)(Nałęćz-Jawecki G. i wsp.,2008) [7].
Autor: Lidia Koperwas
Literatura:
[1]. Schlegel H., G., PWN 2003. Wydanie drugie poprawione pod redakcja naukową Zdzisława Markiewicza. Mikrobiologia ogólna, s. 559-560
[2]. Brzuzan P., Woźny M., Łuczyński M.K., 2007. Przewodik do ćwiczeń, Toksykologia molekularna. Olsztyn 2007, s. 16-20. http://biotechnology.keyland.biz/pdf/tox_mol_updated.pdf
[3]. Demkowicz-Dobrzański K., Bonisławska A., Sawicki J., WPŁYW RODZAJU FRAKCJI S9 Z WĄTRÓB MYSZY I SZCZURÓW NA GENOTOKSYCZNOŚĆ ZWIĄZKÓW OCENIANĄ TESTEM SOS CHROMOTES. http://www.pzits.not.pl/docs/ksiazki/Ekotoks_2008/Komunikaty.pdf
[4]. Piekarska K., Zaciera M., Czarny A., Zaczyńska E. Zastosowanie testów krótkoterminowych do oceny stopnia skażenia powietrza atmosferycznego. http://www.pzits.not.pl/docs/ksiazki/Pol_2010/Piekarska%20293-306.pdf
[5]. Określanie mutagenności związków chemicznych- test Amesa. Test Amesa- instrukcja laboratoryjna MBOŚ. http://www.pg.gda.pl/chem/Katedry/Leki/Dydaktyka/MetodyBiotechWOS/ames.pdf
[6]. Tejs S., 2008. The Ames test: a methodological short review. ENVIRONMENTAL BIOTECHNOLOGY 4 (1) 2008, 7-14.
[7]. Nałęcz-Jawecki G., Zawadzki T., Skrzypczak A., 2012. Substancje promieniochronne a środowisko przyrodnicze. BIULETYN Wydziału Farmaceutycznego Warszawskiego Uniwersytetu Medycznego Biul. Wydz. Farm. WUM, 2012, 5, 32-39 http://biuletynfarmacji.wum.edu.pl/, http://biuletynfarmacji.wum.edu.pl/1205Jawecki/Jawecki.html
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje