StreszczenieBiałka
zawierające w swojej strukturze klastry żelazowo siarkowe są szeroko
rozpowszechnione. Ich struktura opiera się na skoordynowaniu przez
żelazo grup tiolanowych. Budowa ich bywa skomplikowana i zwielokrotniona stąd tez białka te mają różny stopień liczy
koordynacyjne, jak i atomów centralnych. Białka te biorą udział w wielu
procesach, ze względu na klaster żelazowo siarkowy, są one szczególnie
narażone na uszkodzenia oksydacyjne. Reakcje utlenienia powodują
inhibicję procesów komórkowych.
Skróty
BER - naprawa struktury DNA z wycięciem zasady (ang, base excision repair)
LIP – labilna pula żelaza (ang. the labile iron pool)
WprowadzenieProdukty
stresu oksydacyjnego uszkadzają makrocząsteczki (DNA, białka). Jednym z najczęściej pojawiającym się następstwem stresu oksydacyjnego na DNA
jest utlenienie jego zasad. Ten typ uszkodzenia powoduje zablokowanie
widełek replikacyjnych lub błędnego sparowania zasad, czego wynikiem są
mutacje a nawet śmierć komórki. Obecność reaktywnych form tlenu
powoduje również zmiany post-translacyjne w strukturze białek (Tab.1)

Tab. 1 Zmiany post-translacyjne wywołane nadmiarem tlenku azotu(II) [ 1]
Postuluje
się, ze najbardziej narażone na procesy post-translacyjne są białka
zawierające w swojej strukturze żelazo, w tym białka zawierające centra
żelazowo-siarkowe [2,3]. Głównym procesem niszczącym strukturę białek z klastrami żelazowo-siarkowego typu [4Fe-4S] jest dysocjacja
nitrozylowego kompleksu żelaza [4].
Białka zawierające klaster żelazowo siarkowy
Klastry
żelazowo-siarkowe Fe-S są szeroko omawiane w literaturze, ze względu na
postulowane znaczenie biologiczne [5]. Szeroko poznane i wykorzystywane
są te związki w chemii nieorganicznej jako analogi syntetyczne białek
komórkowych. Znanych jest wiele typów białek (Rys. 1).
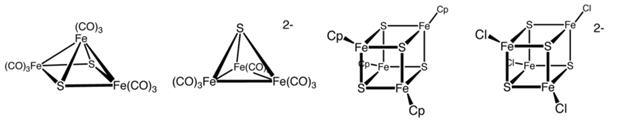
Rys.1 Syntetyczne klastry Fe-S, kolejno: Fe3S2(CO)9, [Fe3S(CO)9]2-, (C5H5)4Fe4S4, [Fe4S4Cl4]2- [6]
W
niektórych białkach, pełniących funkcję enzymów, klastry żelazowo
siarkowe występują, jako grupy prostetyczne np. enzymy mitochondrialnego
łańcucha oddechowego (reduktaza NADH-Q, reduktaza bursztynian-Q, białko
Rieske).
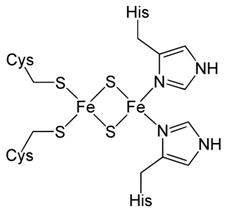
Rys. 2 Centrum żelazowo-siarkowe białka Rieske Centra te mogą również występować w białkach niehemowych, ale zawierających żelazo.
Oznaczenia białek zawierających klaster żelazowo-siarkowy [7]Znanych
jest kilka rodzajów centrów żelazo-siarkowych (Rys. 1). Oznaczenia tych
białek są zależne od ilości atomów żelaza i siarki. Najprostszym znanym
klastrem jest wiązanie jednego atomu żelaza z czterema resztami
cysteiny. Bardziej złożony jest typ drugi określany 2Fe-2S składa się z dwóch jonów żelaza połączonych dwoma atomami siarki nieorganicznej.
Jednocześnie każdy z jonów żelaza koordynowany jest zwykle dwoma
resztami cysteiny. Trzeci typ centrów 4Fe-4S składa się z czterech jonów
żelaza i czterech atomów siarki nieorganicznej połączonych, a struktura
przestrzenna tworzy sześcian. Typ 4Fe-4Fe występuje w białku Rieske
(Rys. 2).
Wiązanie w klastrach żelazowo- siarkowych [8]Typowym
przedstawicielem tlenowców siarka, posiadającą sześć elektronów
walencyjnych. W wyniku przyłączenia dwóch elektronów, tworzą się
naładowane, dwuwartościowe jony, które bardzo często reagują z metalami
przejściowymi. W wyniku tej reakcji tworzy się wiązanie koordynacyjne
pomiędzy atomami siarki a atomami żelaza.. Takie cząsteczki, wchodzą w dalsze reakcje z jonami żelaza tworząc jeszcze bardziej złożone związki
kompleksowe.
Anion tiolanowy (RS-) uważany jest powszechnie za jeden z podstawowych ligandów w chemii koordynacyjnej [9]. Jest to ligand o duże gęstości elektronowej stąd też jego powinowactwo do żelaza i innych
metali. Siarka tiolowana wykazuje silną tendencję do mostkowania, w rezultacie powstają układy siarczkowe, wielordzeniowe i polimeryczne.
Cysteina jest źródłem swoistego liganda tiolanowego w wielu metaloproteinach, a także w białkach żelazowo-siarkowych [10].
Białko żelazowo-siarkowych - MutYW
celu zapobiegania niekorzystnym wływom reakcji wtórnych stresu
oksydacyjnego na makrocząstki w tym DNA jest naprawa z wycięciem zasady
(ang, base excision repair, BER). Naprawa ta odbywa się poprzez
hydrolizę wiązania N-glikozylowego pomiędzy uszkodzoną zasadą a szkieletem DNA. Do enzymów BER uczestniczących w naprawie należą białka
żelazowo-siarkowe np. glikozylazy: MutY, endonukleaza III (EndoIII)
oraz uracylowa [11 ,12].
Białko MutY zawiera w swojej strukturze
cztery cząsteczki cysteiny z których każda jest źródłem swoistego
liganda tiolanowego (Cys-X6-Cys-X2-Cys-X5-Cys).
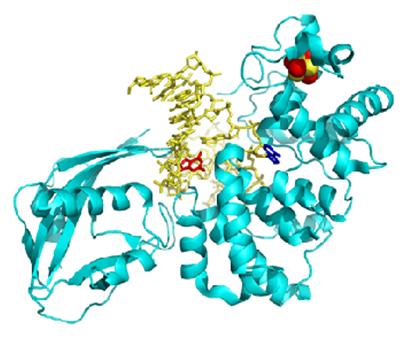
Rys. 2 Struktura białka MutY [13]
Białko
MutY ma strukturę drugorzędową. Klaster żelazowo siarkowy nie jest
umiejscowiony w części aktywnej enzymu lecz jest oddalony od tego
miejsca o około 16 Å.
Białko to może bezpośrednio reagować z reaktywnymi formami tlenu, reakcje te prowadzą do biosyntezy
dinitrozylowych kompleksów żelaza. Postuluje się że białko to ma wpływ
na LIP (ang. the labile iron pool). Aktywne enzymatycznie białko MutY
specyficznie rozpoznaje i przecina nić DNA zawierającą adeninę błędnie
sparowaną z 8-oksoguaniną. Przebieg reakcji można sprawdzić wieloma
metodami np. metodą elektroforezy na denaturującym żelu
poliakrylmidowym. Dzięki zastosowaniu tego białka jest możliwe
oznaczenie ilości DNA, które uległo przecięciu w stosunku do całkowitego
naniesionego DNA.
PodsumowanieBiałka
z klastrami żelazowo-siarkowymi są białkami o skomplikowanej strukturze
przestrzennej, mimo to pospolicie występują w komórkach żywych
organizmów.
Literatura:[1]
A.R.Butler, F.W.Flitney, D.L.Williams. NO, nitrosonium ions, nitroxide
ions, nitrosothiols and iron-nitrosyls in biology: a chemist's
perspective, Trends Pharmacol.Sci., 16, (1995) 18-22.
[2] Y.J.Geng,
A.S.Petersson, A.Wennmalm, G.K.Hansson. Cytokine-induced expression of
nitric oxide synthase results in nitrosylation of heme and nonheme iron
proteins in vascular smooth muscle cells, Exp.Cell Res., 214, (1994)
418-428.
[3] J.R.Lancaster, Jr., J.M.Langrehr, H.A.Bergonia,
N.Murase, R.L.Simmons, R.A.Hoffman. EPR detection of heme and nonheme
iron-containing protein nitrosylation by nitric oxide during rejection
of rat heart allograft, J Biol.Chem., 267, (1992) 10994-10998.
[4]
E.Soum, J.C.Drapier. Nitric oxide and peroxynitrite promote complete
disruption of the [4Fe- 4S] cluster of recombinant human iron regulatory
protein 1, J.Biol.Inorg.Chem., 8, (2003) 226-232.
[5] S. J. Lippard, J. M. Berg “Principles of Bioinorganic Chemistry” University Science Books: Mill Valley, CA; 1994
[6] http://www.enotes.com/topic/Iron-sulfur_cluster
[7]
Jeremy Mark Berg, John L Tymoczko, Lubert Stryer, Neil D Clarke, Zofia
Szweykowska-Kulińska, Artur Jarmołowski, Halina Augustyniak: Biochemia.
Warszawa: Wydawnictwo Naukowe PWN, 2007, s. 507-517
[8] The Cambridge Structural Database, CSD ver. 5.29
[9] Comprehensive Coordination Chemistry, tom 2, G. Willkinson (red.) Pergamon Press, Oxford, 1987
[10] S.J. Lippard, J.M. Berg, Podstawy Chemii Bionieorganicznej, PWN, Warszawa 1998
[11]
A.K.Boal, E.Yavin, O.A.Lukianova, V.L.O'Shea, S.S.David, J.K.Barton.
DNA-bound redox activity of DNA repair glycosylases containing [4Fe-4S]
clusters, BiochemistryOK, 44, (2005) 8397-8407.
[12] O.A.Lukianova, S.S.David. A role for iron-sulfur clusters in DNA repair, Curr.Opin.Chem.Biol., 9, (2005) 145-151.
[13] http://www.seongminleelab.com
opracowała: Katarzyna Wójciuk
Tagi:
białka,
klastry żelazowo-siarkowe,
BER,
MutY,
lab,
laboratorium,
laboratoria
wstecz
Podziel się ze znajomymi





