

|
Zamknij X
|
Wskazania
Tlenoterapię stosuje się w ostrej i przewlekłej niewydolności
oddechowej. Bezwzględnym wskazaniem w stanach ostrych jest wysycenie
tlenem hemoglobiny krwi tętniczej (SaO2) <94%; wyjątek stanowi rozpoznana lub podejrzewana hiperkapniczna niewydolność oddechowa – p. niżej.
Domowe leczenie tlenem (DLT) prowadzi się w zaawansowanej przewlekłej
niewydolności oddechowej (spowodowanej najczęściej przewlekłą
obturacyjną chorobą płuc [POChP]; rzadziej rozstrzeniami oskrzeli,
samoistnym włóknieniem płuc lub mukowiscydozą); niekiedy też u chorych
z przewlekłą niewydolnością serca lub zaawansowaną chorobą nowotworową.
W POChP przewlekła tlenoterapia jest zwykle konieczna u chorych w stadium IV z:
1) ciśnieniem parcjalnym tlenu we krwi tętniczej (PaO2) =<55 mm Hg lub SaO2 =<88% albo
2) PaO2 56–60 mm Hg, jeśli występują objawy
nadciśnienia płucnego, obrzęki obwodowe wskazujące na zastoinową
niewydolność serca lub hematokryt wynosi >55%.
Przeciwwskazania
Narastająca retencja CO2 u chorego z przewlekłą niewydolnością oddechową (najczęściej wskutek POChP) nie jest przeciwwskazaniem do tlenoterapii, jeśli występuje hipoksemia, ale wymaga zmniejszenia stężenia tlenu w mieszaninie oddechowej albo zastosowania wentylacji mechanicznej płuc.
Powikłania
1. Działania niepożądane tlenu (ryzyko tym większe, im większe stężenie tlenu w mieszaninie oddechowej i dłuższy czas stosowania tlenoterapii):
1) zapalenie tchawicy i oskrzeli – z suchością błony śluzowej i upośledzeniem oczyszczania śluzowo-rzęskowego
2) niedodma absorpcyjna – podczas oddychania 100% tlenem dochodzi
do wypłukiwania azotu, który zapobiega m.in. zapadaniu się pęcherzyków
płucnych, a tlen zastępujący azot ulega szybkiej absorpcji
3) ostre uszkodzenie płuc
2. Następstwa oddychania suchą i zimną mieszaniną gazów (zwłaszcza długotrwałego):
1) wysychanie i owrzodzenia błony śluzowej
2) upośledzenie transportu śluzowo-rzęskowego, zaleganie
wydzieliny i zwiększenie jej gęstości (prowadzące do powstania ognisk
niedodmy)
3) skurcz oskrzeli
4) zakażenia.
Sprzęt
1. Źródła tlenu
1) szpitalne (źródła czystego tlenu) – tlen ciekły lub
gazowy, sprężony w butlach o różnej pojemności, dostarczany do pacjenta
przez centralną instalację tlenową lub z przenośnej butli
2) pozaszpitalne
a) koncentratory – zagęszczają tlen pobierany z otaczającego
powietrza (do stężenia 85–95%) i dostarczają go w sposób ciągły choremu
b) inne, rzadziej stosowane w tlenoterapii domowej – tlen gazowy sprężony w butlach, tlen ciekły w butlach.
2. Przepływomierz z możliwością regulacji – podłączony do
gniazda centralnej instalacji tlenowej, butli lub koncentratora, pozwala
uzyskać pożądane stężenie tlenu w mieszaninie wdychanych gazów (ryc. 1)
3. Maski i cewniki tlenowe
1) cewnik umieszczony w obydwu nozdrzach przednich (tzw. wąsy tlenowe
– ryc. 2) – najczęściej używany; przepływ tlenu 1 l/min zapewnia
stężenie tlenu w mieszaninie oddechowej 24%, a zwiększenie przepływu
o każdy następny 1 l/min (w przedziale 2–8 l/min) zwiększa to stężenie
o kolejne 4%
2) cewnik wprowadzany do jednego nozdrza – rzadko używany (głównie podczas bronchoskopii)
3) maski proste (zwykłe; ryc. 3) – zapewniają stężenie
tlenu w mieszaninie oddechowej 40–60% przy przepływie 5–8 l/min (5–6
l/min – 40%, 6–7 l/min – 50%, 7–8 l/min – 60%); nie należy stosować
przepływu <5 l/min, ze względu na ryzyko powtórnego wdychania
wydychanego CO2 i narastającego oporu podczas wdechu
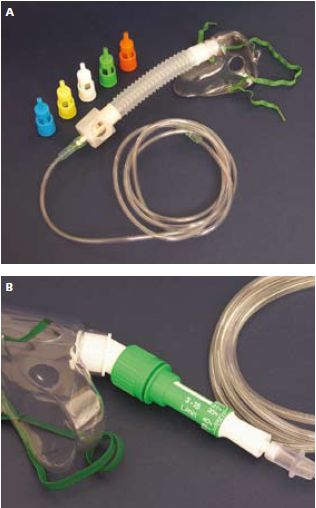
4) maski z zastawkami Venturiego (ryc. 4) – podawanie
czystego (100%) tlenu z odpowiednią prędkością przepływu (wg instrukcji
producentów) umożliwia uzyskanie dokładnie określonego stężenia tego
gazu (24%, 25%, 28%, 35%, 40%, 50% i 60%) w mieszaninie oddechowej –
zalecane u chorych na POChP i innych pacjentów zagrożonych
hiperkapniczną niewydolnością oddechową; jeżeli częstotliwość oddechów
wynosi >30/min, przepływ tlenu należy zwiększyć o 50% powyżej
ustalonego w instrukcji producenta
5) maski częściowo zwrotne (z workiem rezerwuarowym bez
zastawki uniemożliwiającej mieszanie się powietrza z czystym tlenem) –
pozwalają uzyskiwać duże stężenie tlenu (7 l/min – 70%, 8 l/min – 80%,
9–15 l/min – 90–95%)
6) maski bezzwrotne (ryc. 5) – z workiem rezerwuarowym
i zastawką uniemożliwiającą mieszanie się powietrza z czystym tlenem;
pozwalają uzyskiwać duże stężenie tlenu (jak maski częściowo zwrotne)
7) worki samorozprężalne z maską twarzową – służą zwykle do
ręcznego wspomagania wentylacji i wentylacji zastępczej, mogą być
wyposażone w zastawkę i worek rezerwuarowy, umożliwiają uzyskiwanie
dużego stężenia tlenu (jak maski częściowo zwrotne) przy dużym
przepływie tlenu (i wypełnieniu worka samorozprężalnego [oraz
rezerwuarowego, jeśli wchodzi w skład zestawu]).
4. Dreny łączące – w przypadku stacjonarnych koncentratorów w domu dopuszcza się długość do 12 m.
5. Urządzenia do nawilżania i ogrzewania gazów oddechowych –
są korzystne przy oddychaniu (zwłaszcza długotrwałym) przez maskę
mieszaniną o dużym stężeniu tlenu, natomiast niepotrzebne przy
tlenoterapii przez cewnik donosowy. Najwydajniejsze są aktywne układy
nawilżania. Brak należytej higieny podczas nawilżania bywa przyczyną
zakażeń układu oddechowego. Nie należy stosować urządzeń, w których tlen
jest nawilżany poprzez przejście przez warstwę płynu z kaniuli
umieszczonej na dnie zbiornika z cieczą, ponieważ nie ma dowodów na
korzyści z takiego postępowania, a jednocześnie zwiększone jest ryzyko
zakażenia.

Ryc. 1. Przepływomierz do tlenoterapii – przepływ tlenu ustawiono na 6 l/min
Ryc. 2. Wąsy tlenowe
Ryc. 3. Maska prosta (zwykła)
Ryc. 4. Maska z zastawką Venturiego – wymienną (A) i regulowaną (B)

Ryc. 5. Maska bezzwrotna
Ogólne zasady tlenoterapii
Ostra niewydolność oddechowa
1. Należy dążyć do uzyskania SaO2 94–98% u wszystkich
chorych, z wyjątkiem tych z rozpoznaną lub podejrzewaną hiperkapniczną
niewydolnością oddechową (najczęściej są to chorzy na POChP, rzadziej –
kifoskoliozę, choroby nerwowo-mięśniowe, rozstrzenie oskrzeli lub
mukowiscydozę, albo ze znaczną otyłością), u których
docelowe SaO2 wynosi 88–92%.
2. Konieczne jest monitorowanie efektów tlenoterapii za
pomocą pulsoksymetrii i/lub gazometrii krwi (p. niżej), a niekiedy
kapnometrii. Po każdej zmianie stężenia tlenu należy monitorować SaO2 w sposób ciągły przez co najmniej 5 minut.
3. Często konieczne jest podawanie tlenu w dużym stężeniu (>50%, czyli FiO2
>0,50). Ze względu na toksyczność tlenu w dużym stężeniu stosuje się
go zazwyczaj krótko (od kilku godzin do kilku dni), a niewystąpienie
poprawy stanu klinicznego często jest wskazaniem do mechanicznej
wentylacji płuc.
Zaostrzenie przewlekłej niewydolności oddechowej
1. Ze względu na możliwości hipoksemicznego napędu oddechowego
w następstwie hiperkapni (zwłaszcza u chorych na POChP, rozstrzenie
oskrzeli i [rzadziej] mukowiscydozę; inne rzadsze przyczyny – p. wyżej)
nie należy stosować tlenu w dużym stężeniu w mieszaninie oddechowej
u pacjenta z dusznością, zanim (szybko) uzyska się informację
o występującej u niego chorobie płuc.
2. Przed rozpoczęciem leczenia tlenem powinno się wykonać gazometrię krwi tętniczej (ew. arterializowanej
krwi włośniczkowej).
3. U chorych zagrożonych hiperkapnią na ogół należy dążyć do uzyskania SaO2
88–92%. W przypadku izolowanej hipoksemii przepływ tlenu przez cewnik
donosowy zazwyczaj wynosi 2 l/min (w razie znacznej hipoksemii należy
zwiększyć przepływ tlenu, a najlepiej użyć maski Venturiego). W razie
hiperkapni stosuje się mniejszy przepływ tlenu (0,5–1 l/min) przez
cewnik donosowy lub używa się maski Venturiego, zapewniającej
najmniejsze możliwe stężeniu tlenu (24% lub 25%) w mieszaninie
oddechowej. Jeśli w gazometrii nie stwierdza się retencji CO2, można zwiększyć docelowy zakres SaO2 do 94–98%. Jeśli stężenie CO2 narasta, można tolerować niewielką hipoksemię (PaO2 50–60 mm Hg), ale nie wolno dopuszczać do PaO2 <40 mm Hg. W razie utrzymywania się tak niskiego PaO2 lub nasilenia hiperkapni powinno się rozważyć nieinwazyjną lub inwazyjną wentylację mechaniczną.
4. Konieczne jest uważne monitorowanie efektów tlenoterapii (ryc. 6), uwzględniające nie tylko SaO2 (pulsoksymetria), lecz także PaCO2
i pH (gazometria krwi tętniczej). Gazometrię należy wykonać na początku
leczenia tlenem, 30–60 minut później oraz 30–60 minut po każdej zmianie
stężenia tlenu.
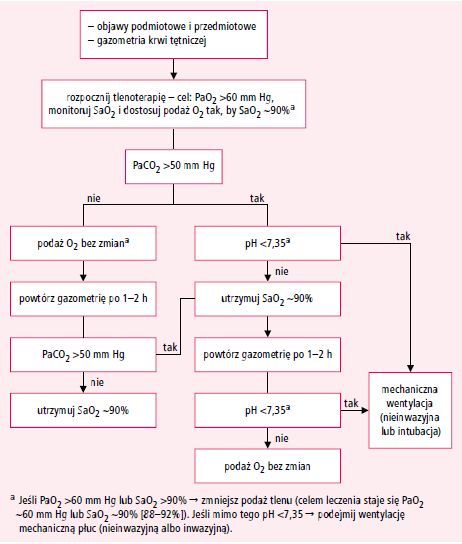
Ryc. 6. Tlenoterapia w zaostrzeniach POChP
Domowe leczenie tlenem
1. Należy dążyć do uzyskania PaO2 >60 mm Hg.
2. Zaleca się przyjmowanie tlenu przez co najmniej 15 godzin w ciągu doby, a najlepiej przez całą dobę.
3. Przepływ tlenu należy ustalić indywidualnie, na podstawie wyników badania gazometrycznego, zwykle na ~2 l/min (0,5–3 l/min).
4. W czasie snu i podczas wysiłku fizycznego zaleca się zwiększenie przepływ tlenu o 1 l/min.
5. Trzeba zawsze pamiętać, żeby nie stosować tlenu przy otwartym źródle ognia.
Monitorowanie tlenoterapii
Do monitorowania tlenoterapii wykorzystuje się pulsoksymetrię i gazometrię krwi.
Pulsoksymetria
Opis metody
Pulsoksymetria jest nieinwazyjną, przyłóżkową metodą przezskórnego monitorowania SaO2
i częstotliwości tętna. Do tego celu służą urządzenia (pulsoksymetry)
działające na zasadzie spektrofotometrii transmisyjnej, wykorzystującej
różne właściwości optyczne hemoglobiny utlenowanej i odtlenowanej. Są
one wyposażone w czujniki
zakładane na palec, małżowinę uszną, czoło lub skrzydełka nosa. SaO2
zmierzone metodą pulsoksymetrii oznacza się niekiedy symbolem SpO2.
Interpretacja wyniku
1. Prawidłowe SaO2 (SpO2) wynosi 95–98% (u osób >70. rż. – 94–98%), a podczas tlenoterapii
może sięgać 99–100%. Zdecydowanie nieprawidłowe SaO2 (SpO2) <90% odpowiada PaO2 <60 mm Hg.
2. Najważniejsze ograniczenia pomiaru:
1) artefakty ruchowe i upośledzenie obwodowego przepływu krwi (wynik SpO2
jest najczęściej niewiarygodny, jeśli częstotliwość tętna zmierzona
przez pulsoksymetr nie odpowiada ocenie palpacyjnej; niektóre modele
pulsoksymetrów wyświetlają falę pletyzmograficzną, która powinna
wyglądać jak krzywa tętna tętniczego)
2) zawyżenie wyniku przez hemoglobinę tlenkowęglową i methemoglobinę (mają podobne właściwości optyczne jak oksyhemoglobina)
3) zaniżenie wyniku przez zmiany na paznokciach (ciemny lakier [należy zmyć przed pomiarem], grzybica).
Gazometria
Opis metody
Gazometria krwi to badanie krwi tętniczej lub arterializowanej krwi włośniczkowej (mniejsza wiarygodność), rzadziej żylnej lub pobranej w trakcie cewnikowania serca, oceniające równowagę kwasowo-zasadową i wymianę gazową.
Pobieranie krwi tętniczej
1. Przeciwwskazania: nie ma przeciwwskazań bezwględnych. Należy zachować ostrożność w przypadku:
1) istotnego upośledzenia krzepnięcia krwi (np. podczas leczenia przeciwkrzepliwego)
2) małopłytkowości (<30 000/µl)
3) ciśnienia tętniczego rozkurczowego >120 mm Hg.
2. Powikłania:
1) nadmierne krwawienie lub krwiak
2) skurcz lub rozwarstwienie ściany tętnicy
3) zakrzepica
4) zatorowość tętnicza.
3. Przygotowanie pacjenta: należy uzyskać świadomą zgodę
chorego. W przypadku nakłucia tętnicy kończyny górnej pacjent może
siedzieć, natomiast tętnicę udową należy nakłuwać w pozycji leżącej.
4. Miejsce nakłucia:
1) tętnica promieniowa – nakłucie wykonuje się w pobliżu
zgięcia nadgarstkowego, między wyrostkiem rylcowatym kości ramiennej
i ścięgnem zginacza promieniowego dłoni (preferowana kończyna
niedominująca). Przed nakłuciem, a zwłaszcza cewnikowaniem tętnicy,
poleca się wykonanie testu Allena: należy poprosić pacjenta o ściśnięcie
ręki w pięść przez 30 s, po czym ucisnąć palcami obie tętnice
przedramienia pacjenta (tętnicę łokciową i promieniową, najlepiej po
uniesieniu kończyny górnej pacjenta), a następnie zwolnić ucisk tętnicy
łokciowej. Test powtarza się, zwalniając ucisk tętnicy promieniowej.
Nawrót kapilarny powinien nastąpić do 5 s; jeśli po upływie tego czasu
dłoń jest nadal blada, wynik testu jest dodatni (świadczy o upośledzeniu
ukrwienia) – w takim przypadku nie należy nakłuwać tętnicy na tej
kończynie.
2) tętnica udowa – nakłucie wykonuje się poniżej więzadła
pachwinowego, najczęściej w zgięciu pachwinowym (tętnica leży bocznie od
żyły, a przyśrodkowo od nerwu)
3) tętnica ramienna – nakłucie wykonuje się w zgięciu
łokciowym. Nie poleca się nakłuwania tej tętnicy ze względu na ryzyko
powstania krwiaka uciskającego nerw; jeśli wybierze się to miejsce,
preferuje się nakłucie tętnicy kończyny niedominującej.
5. Sprzęt:
1) igła Ø 0,5–0,6 mm (25–23 G) do nakłucia tętnicy promieniowej; Ø
0,6–0,7 mm (23–22 G) do nakłucia tętnicy udowej lub ramiennej
2) specjalna strzykawka heparynizowana albo strzykawka insulinowa,
do której nabrano heparyny, a następnie ją wystrzyknięto (najlepiej
przez igłę, która posłuży do nakłucia)
3) korek do zatkania strzykawki (lub igły) po pobraniu krwi
4) rękawiczki, gaziki, środek odkażający, pojemnik na zużyte igły
i strzykawki i ew. sprzęt do znieczulenia nasiękowego (igła jak do
nakłucia tętnicy, strzykawka, fiolka z 1% roztworem lidokainy, igła
o dużej średnicy do nabrania lidokainy).
6. Technika:
1) należy oczyścić i odkazić skórę, którą następnie można znieczulić 1% lidokainą
2) przytrzymując tętnicę między opuszkami palców, wkłuwa się igłę
pod kątem 90° (w przypadku tętnicy promieniowej może być 45°; ryc. 7)
3) po pojawieniu się w strzykawce pulsującego wypływu krwi,
pobiera się ~1 ml krwi, delikatnie i powoli podciągając tłok strzykawki.
Należy uważać, by nie wciągnąć powietrza do strzykawki. Po pobraniu
krwi powinno się zatkać strzykawkę (lub igłę) korkiem i wymieszać
zawartość strzykawki
4) tętnicę uciska się do ustania krwawienia – tętnicę promieniową przez >=5 min, a udową i ramienną przez >=10–15 min
5) oznaczenie należy wykonać w ciągu 15 min; jeśli to niemożliwe –
krew można przechować =<1 h w lodówce w temperaturze ~4°C
i transportować w naczyniu z lodem.
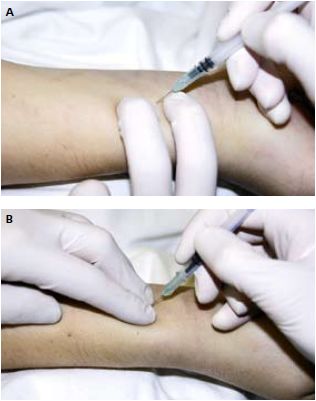
Ryc. 7. Nakłucie tętnicy promieniowej do badania gazometrycznego
Pobieranie arterializowanej krwi włośniczkowej
1. Miejsce nakłucia: opuszka palca lub płatek ucha.
2. Sprzęt:
1) gazik nasączony środkiem odkażającym
2) specjalne ostrze lub cienka igła do nakłucia skóry
3) specjalne 2 heparynizowane kapilary
4) 2 metalowe pręciki i 4 zatyczki do kapilar
5) magnes.
3. Technika:
1) należy ogrzać (pomasować) miejsce nakłucia
2) skórę nakłuwa się na głębokość zapewniającą swobodne wypłynięcie dużej kropli krwi
3) napełnia się krwią kapilary, unikając wprowadzenia pęcherzyków powietrza
4) do kapilar wprowadza się metalowe pręciki, szczelnie zamka końce plastikowymi zatyczkami i miesza krew za pomocą magnesu
5) oznaczenia należy wykonać natychmiast; jeśli to niemożliwe, próbki można przechować =<30 min w naczyniu z lodem.
Interpretacja wyniku
1. Wyniki prawidłowe:
1) we krwi tętniczej – tab. 1
2) we krwi żylnej
a) wysycenie tlenem hemoglobiny (SvO2) 70–75%
b) ciśnienie parcjalne tlenu (PvO2) 35–40 mm Hg
c) ciśnienie parcjalne dwutlenku węgla (PvCO2) 45–47 mm Hg.
2. Interpretacja nieprawidłowości:
1) rozpoznawanie zaburzeń równowagi kwasowo-zasadowej – tab. 2
2) rozpoznawanie niewydolności oddechowej na podstawie gazometrii krwi tętniczej w spoczynku lub po wysiłku podczas oddychania powietrzem atmosferycznym – tab. 3:
a) hipoksemicznej (częściowej; typ 1) – PaO2 <60 mm Hg (8,0 kPa) i PaCO2 =<45 mm Hg (6,0 kPa)
b) hipoksemiczno-hiperkapnicznej (całkowitej; typ 2) – PaO2 <60 mm Hg (8,0 kPa) i PaCO2 >45 mm Hg (6,0 kPa)
3) rozpoznawanie niedotlenienia tkanek na podstawie gazometrii krwi żylnej – SvO2
<70%; największą wiarygodność ma wynik uzyskany z krwi pobranej
z żyły głównej górnej lub mieszanej krwi żylnej (czyli z prawego
przedsionka serca).
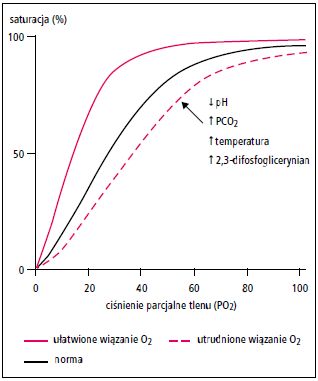
Ryc. 8. Krzywa dysocjacji oksyhemoglobiny i czynniki wpływające na powinowactwo hemoglobiny do tlenu
Tabela 1. Parametry gazometrii krwi tętniczeja
| Symbol | Nazwa (i wyjaśnienie) | Norma |
| pH | pH (czyli ujemny logarytm dziesiętny ze stężenia jonów wodorowych) | 7,35–7,45 |
| PaCO2 | ciśnienie parcjalne dwutlenku węgla we krwi tętniczej | 32–45 mm Hg (4,27–6,00 kPa) |
| HCO3– akt | aktualne stężenie wodorowęglanów w osoczu | 21–27 mmol/l |
| HCO3– std | standardowe stężenie wodorowęglanów (zawartość wodorowęglanów w osoczu krwi wysycanej w temperaturze 38°C mieszanką gazową o PaCO2 40 mm Hg, wzbogaconą w tlen do całkowitego wysycenia hemoglobiny) | 24 (21–25) mmol/l |
| BE | nadmiar zasad we krwi (różnica między należnym a aktualnym stężeniem zasad buforowych we krwi) | od –2,3 do +2,3 mEq/l |
| PaO2 | ciśnienie parcjalne tlenu we krwi tętniczej | 75–100 mm Hgb (10,00–13,33 kPa) |
| ctCO2 | całkowita zawartość dwutlenku węgla w osoczu | 22–28 mmol/l 47–60,5% obj. |
| SaO2c | wysycenie tlenem hemoglobiny krwi tętniczej | 95–98%b,d |
Tabela 2. Rozpoznawanie zaburzeń równowagi kwasowo-zasadowej na podstawie gazometrii krwi
| Rozpoznanie | pH | pCO2 | HCO3– |
| zaburzenia proste | |||
| kwasica oddechowa niewyrównanaa | ↓ | ↑ | N |
| częściowo wyrównanaa | ↓ | ↑ | ↑ |
| całkowicie wyrównana lub zasadowica nieoddechowa całkowicie wyrównanab | N | ↑ | ↑ |
| kwasica nieoddechowa (metaboliczna) niewyrównana | ↓ | N | ↓ |
| częściowo wyrównana | ↓ | ↓ | ↓ |
| całkowicie wyrównana lub zasadowica oddechowa całkowicie wyrównanab | N | ↓ | ↓ |
| zasadowica oddechowa niewyrównanaa | ↑ | ↓ | N |
| częściowo wyrównanaa | ↑ | ↓ | ↓ |
| zasadowica nieoddechowa (metaboliczna) niewyrównana | ↑ | N | ↑ |
| częściowo wyrównana | ↑ | ↑ | ↑ |
| zaburzenia mieszane (złożone)c | |||
| kwasica metaboliczna i oddechowa | ↓ | ↑ | ↓ |
| zasadowica metaboliczna i oddechowa | ↑ | ↓ | ↑ |
Tabela 3. Najważniejsze przyczyny i następstwa nieprawidłowego ciśnienia parcjalnego gazów krwi tętniczej
| Nieprawidłowość | Mechanizmy zaburzeń i najważniejsze przyczyny | Najważniejsze następstwa |
| ↓ PaO2, ↓ SaO2 (hipoksemia) | 1) niedostosowanie wentylacji do przepływu płucnego płuc (najczęstszy mechanizm) a) hipowentylacja pęcherzyków płucnych → przeciek krwi nieutlenowanej (np. niedodma) b) upośledzenie przepływu krwi przez płuca → daremna wentylacja → ↑ czynnościowej przestrzeni martwej (np.→ zatorowość płucna) 2) upośledzenie dyfuzji przez barierę pęcherzykowo-włośniczkową (rzadziej, np. zwłóknienie płuc) 3) pozapłucny przeciek krwi między krążeniem płucnym i systemowym (np. wada sinicza serca) |
1) niedotlenienie tkanek → metabolizm beztlenowy → kwasica mleczanowa 2) reakcje wyrównawcze (z czasem ulegają załamaniu) a) tachykardia b) ↑ ciśnienia tętniczego c) ↑ objętości wyrzutowej serca d) hiperwentylacja |
| ↑ PaO2, ↑ SaO2 | oddychanie mieszaniną gazów o zwiększonej zawartości tlenu | uszkodzenie płuc wskutek długotrwałego oddychania mieszaniną gazów o dużej (>50%) zawartości tlenu |
| ↓ PaCO2 (hipokapnia, hipokarbia) | hiperwentylacja (np. w odpowiedzi na ból, duszność, bodźce emocjonalne, kwasicę nieoddechową) | 1) zasadowica oddechowa → ↑ powinowactwa tlenu do hemoglobiny (↑ wiązania O2 w płucach i ↓ uwalniania O2 w tkankach) i hipokaliemia 2) zwężenie naczyń mózgowych → ↓ przepływu mózgowego |
| ↑ PaCO2 (hiperkapnia, hiperkarbia) | hipowentylacja pęcherzyków płucnycha | 1) kwasica oddechowa → ↓ powinowactwa tlenu do hemoglobiny (↓ wiązania O2 w płucach i ↑ uwalniania O2 w tkankach) i hiperkaliemia 2) rozszerzenie naczyń mózgowych → ↑ ciśnienia śródczaszkowego → zaburzenia świadomości (śpiączka) |
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje