 Zarówno paracetamol, teofilina jak i salicylany moga być w łatwy sposób ekstrahowane z osocza, dzięki czmu możliwe jest określenie ich stężenia w osoczu. Ekstrakcję tych leków prowadzi się przy zastosowaniu mieszaniny chlorek metylenu/propanol występujących w stosunku 9:1.
Zarówno paracetamol, teofilina jak i salicylany moga być w łatwy sposób ekstrahowane z osocza, dzięki czmu możliwe jest określenie ich stężenia w osoczu. Ekstrakcję tych leków prowadzi się przy zastosowaniu mieszaniny chlorek metylenu/propanol występujących w stosunku 9:1.Następnie, tak wyekstrahowany materiał rozdziela się metodą fazy odwróconej z zastosowanej kolumny C18 w izokratycznym systemie HPLC, który wyposażony jest w detektor UV oraz integrator [1]. Identyfikację np. salicylanów dokonuje się na podstawie wyznaczonego czasu retencji, z kolei określenie ilości wyekstrahowanego leku dokonuje się na podstawie zastosowania wewnętrznego standardu. W przypadku salicylanów standardem jest 8-C1-teofilina [2].
Analityczne metody oznaczania leków w płynach fizjologicznychWykonanie: Materiał do badań: Jako materiał należy wykorzystać osocze ludzkie wolne od leków, oraz osocze pochodzące od osoby chorej – musi to być osoba przyjmująca analizowane leki!
1) Przygotowanie próbek do chromatografii: ekstrakcja leków
Na początku należy przygotować mieszaninę ekstrakcyjną wg przepisu: chlorek metylenu/2-propanol w stosunku 9:1, z dodatkiem wewnętrznego standardu (8-C1-tefilina) o stężeniu 7µM. Z kontrolnego oscza, tj. wolnego od leków przygotować osocze wzorcowe w objętości 1 ml, zawierające: paracetamol (w stężeniu 0,4 mM) , teofilinę (75µM) oraz salicylan ( 1 mM). Równolegle należy prowadzić ekstrakcję trzech próbek , tj:
1) Osocza wolnego od leków
2) Osocza wzorcowego oraz
3) Osocza, które zawiera nieznaną ilośc leków.
Do 0,5 ml osocza dodać 0,5 ml 1M roztworu HCl, a także 5 ml mieszaniny ekstrakcyjnej . Całość mieszać przez 1 minutę, po czym odwirować przy 10 000xg w ciągu 10 minut. Po wirowaniu, zebrać 3 ml powstałego supernatantu, w której znajdować się będą rozpuszczalniki organiczne, supernatant przenieść do szklanej probówki, po czym odparować w łaźni wodnej w temp. 50C (w atmosferze azotu). Powstały osad rozpuścić w eluencie (13% metanol-75% CH3COOH -0,02M CH3COONa) w obj. 100µL i zastosować do rozdziału na kolumnie C18(ODS2, 5µm , 4x100 mm). Zastosowana ekstrakcja charakteryzuje się dużą wydajnością, która dla badanych leków przekracza 90% [1].
1) Analiza zawartości leków w próbkach Kolumnę C18 należy zrównoważyć eluentem (13% metanol-75% CH3COOH -0,02M CH3COONa) , prędkość przepływu ustalić na 1 ml/min, zaś w detektorze UV wybrać długość fali równą λ=280 nm. Do pętli nanieść 10 µl analizowanej próbki, a po ustaleniu się warunków nastrzyknąć próbkę na kolumnę. Cały rozdział chromatograficzny prowadzić w czasie 20 minut, po kolei analizując przygotowane próbki.
W próbce, która jest wolna od leków powinien pojawić się tylko wewnętrzny standard czyli 8-Cl-teofilina . Czas retencji dla tej próbki to ok. 19 min.
W próbce wzorcowej powinny pojawić się dokładnie 3 szczyty chromatograficzne, które odpowiadają:
- paracetamolowi (ok. 4 min)
- teofilinie (ok. 7 min)
- oraz salicylanowi (ok. 8 min).
Wewnętrzny standard powinien pojawić się dokładnie w tym samym miejscu co w osoczu, które było wolne od leków, z kolei w próbie badanej ( charakteryzującej się nie znaną zawartością leków), szczyty chromatograficzne odpowiadające poszczególnym lekom powinny pojawiać się przy tych samych czasach retencji co w osoczu wzorcowym. Należy mieć jednak na uwadze, że szczyty te moga być różnej wysokości w porównaniu do osocza wzorcowego. Wysokość każdego szczytu chromatogarficznego zależna jest od stężenia danego leku w osoczu. W zakresie badanych stężeń oraz mierzonych przez detektor zmian gęstości optycznej przepływającej cieczy, można przyjąć liniową zależność mierzonej gęstości optycznej od stężenia każdego z leków [1].
Zdjęcie: Analiza salicylanów w osoczu krwi ludzkiej, [2].
Pierwszy z chromatogramów przedstawia rozdział materiału zawierającego jedynie wewnętrzny standard (8-Cl-teofilina). Środkowy chromatogram reperezentuje rozdział osocza kontrolnego (wzorzec o znanej ilości salicylanu). Trzeci chromatogram prezentuje separację różnych substancji z osocza pacjenta [2].
Korzystając z poniższego wzoru możliwe jest policzenie stężenia (c) każdego z analizowanych leków w próbie badanej, gdzie uwzględnia się wartości absorbancji uzyskane dla wewnętrznego standardu:
Cleku = C wzorca leku x (A leku próby /A leku wzorca) x (A standardu wzorca /A standardu próby)
Gdzie:
C leku i
C wzorca leku – stężenia badanego leku, odpowiednio w osoczu badanym i wzorcowym;
A leku próby i
A leku wzorca – zmierzone wartości maksymalnej absorbancji w szczycie badanego leku, odpowiednio w próbie badanej i wzorcowej;
A standardu wzorca i A standardu próby – zmierzone wartości maksymalnej absorbancji w szczycie odpowiadającym standardowi wewnętrznemu, odpowiednio w próbie wzorcowej i badanej [1].
Po zakończeniu rozdziału chromatograficznego i oznaczeń, kolumnę należy przemyć 20% metanolem w objętości 30 ml i przechowywać kolumnę w temperaturze pokojowej. Kolumna musi być przechowywana szczelnie zamknięta ( z obu końców) lub podłączona do systemu HPLC [1], [2].
Zastosowanie chromatografii cieczowej w układzie faz odwróconych do rozdzielania i oznaczania naftochinonów.
Naftochinony to pochodne naftalenu. Zazwyczaj są to: 1,4-naftochinony albo 1,4-naftohydrochinony- często występujące z wbudowaną grupą fenolową. Związki te występują u bakterii, grzybów i roślin wyższych. Ich rozpowszechnienie w świecie roślinnym jest dość ograniczone, choć czasami stanowią składniki czynne niektórych surowców roślinnych [3], [15].
Do najważniejszych barwników naftochinonowych należą: juglon, plumbagina, droseron czy szikonina. Pochodne naftochinonu wykazują wielokierunkową aktywność farmakologiczną, zaś szczególnie dużo leczniczych właściwości posiada właśnie szikonina. Przeciwzapalne właściwości szikoniny, oraz przyspieszające gojenie ran znane są już od dawna i wykorzystywane do leczenia ciężkich owrzodzeń oraz oparzeń skóry, a także egzemy czy odleżyn [4]. Jak wykazały badania, przeciwzapalne działanie szikoniny (oraz jej pochodnych) związane jest wieloma mechanizmami,w tym m.in. z hamowaniem biosyntezy leukotrienu B4 i kwasu 5-hydroksyeikozatetraenowego, które zaliczane są do mediatorów stanu zapalnego [5]. Ponadto, zmniejszeniem produkcji TNF-α, interleukiny 1-b i tlenku azotu, a także inhibicją cyklooksygenazy-2 [6], [15].
Szikonina i jej pochodne wykazują również aktywność antybakteryjną. Działanie takie odnosi się zarówno do bakterii Gram-dodatnich (G+), np. Staphylococcus aureus [7], [8], jak również bakterii Gram-ujemnych(G-) w tym Escherichia coli i Pseudomonas aeruginosa (Karyagina et al., 2001). Inny barwnik: plumbagina- wykazuje działanie przeciwko Helicobacter pylori [9].
Jak udowodniono, działanie przeciwdrobnoustrojowe naftochinonów nie ogranicza się tylko do bakterii i grzybów. Związki te posiadają także aktywność przeciwwirusową, dzięki czemu mogą być one stosowane np. przeciwko wirusowi zapalenia wątroby HCV [10], z kolei wykazano, że szikonina posiada działanie supresyjne na wirusa HIV-1 [11]. Ponadto, w wielu doniesieniach udowodniono przeciwnowotworowe właściwości szikoniny oraz jej pochodnych. Działanie to wynika z kilku mechanizmów, w tym m.in. z hamowania proliferacji komórek nowotworowych [12], inhibicji DNA topoizomerazy-I [13] czy indukcji apoptozy [14], [15].
Najczęściej do rozdzielania związków należących do grupy naftochinonów z wykorzystaniem chromatografii cienkowarstwoej w układzie faz odwróconych (tzw. chromatografia RP-TLC), stosuje się płytki z fazą stacjonarną (C18). Jako eluent wykorzystuje się wodne rpztwory metanolu bądź kwasu mrówkowego. Detekcję pzreprowadza się w świetle UV.
W przypadku zastosowania wysokosprawnej chromatografii cieczowej w odwróconym układzie faz , jako fazę stacjonarną stosuje się żel krzemionkowy, który poddawany jest modyfikacji z wykorzystaniem grup oktadecylowych. W większości stosowanych metodyk rozdzielania związków wykorzystuje się elucję izoakratyczną , gdzie eluentem jest wodny roztwór acetonitrylu lub metanolu, z dodatkiem kwasu octowego bądź mrówkowego.
Do detekcji związków należących do grupy naftochinonów powszechnie wykorzystuje się detektory spektrofotometryczne UV-VIS ( z matrycą fotodiodową – DAD, lub z detektorem fluorescencyjnym).
Zastosowanie elucji izokratycznej pozwala na łatwiejsze odzyskanie składników eluentu, a ponadto wpływa na bardzo ważny aspekt całej metodyki: czyni zaprojektowany proces rozdzielczy bardziej ekonomicznym [16].
Autor: Lidia Koperwas
Literatura:
[1]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 172 – 176
[2]. http://www.biofizyka.p.lodz.pl/ch7.pdf
[3]. Kohlmünzer S. (2007). Farmakognozja. Podręcznik dla studentów farmacji. Wyd. V unowocześnione. PZWL, Warszawa: 150-198, 253-277, 377-379, 531
[4]. Papageorgiou V.P., Assimpoulou A.N., Couladouros E.A., Hepworth D., Nicolaiu K.C. (1999). The chemistry and biology of alkannin, shikonin and related naphthazarin natural products. Angewandte Chemie International Editio, 38: 270-300
[5]. Wang W.J., Bai J.Y., Liu D.P., Xue L.M., Zhu X.Y. (1994). The antiinflammatory activity of shikonin and its inhibitory effect on leukotriene B4 biosynthesis. Yaoxue Xuebao, 29: 161-165
[6]. Nam K.N., Son M.-S., Park J.-H., Lee E.H. (2008). Shikonins attenuate microglial inflammatory responses by inhibition of ERK, Akt, and NF-κB: neuroprotective implications. Neuropharmacology, 55 (5): 819825
[7]. Shen C.C., Syu W.J., Li S.Y., Lin C.H., Lee G.H., Sun C.M. (2002). Antimicrobial activities of naphthazarins from Arnebia euchroma. Journal of Natural Products, 65(12): 1857-1862
[8]. Pietrosiuk A., Kędzia B., Hołderna-Kędzia E., Wiedenfeld H., Malinowski M., Furmanowa M. (2003). Antimicrobial activity of naphthoquinones from Lithospermum canescens Lehm. Herba Polonica, 49(3/4): 209-215
[9]. Wang Y.-C., Huang T.-L. (2005). High-performance liquid chromatography for quantification of plumbagin, an anti-Helicobacter pylori compound of Plumbago zeylanica L. Journal of Chromatography A, 1094: 99–104
[10]. Ho T.Y., Wu S.L., Lai I.L., Cheng K.S., Kao S.T., Hsiang C.Y. (2003). An in vitro system combined with an in-house quantitation assay for screening hepatitis C virus inhibitors. Antiviral Research, 58: 199-208
[11]. Chen X., Yang L., Hang N., Turbin J.A., Buckheit R.W., Sterling C., Oppenheim J.J., Howard O.M.Z. (2003a). Shikonin, a component of Chinese herbat medicine, inhibits chemokine receptor function and suppresses Human Immunodeficiency Virus type 1. Antimicrobial Agents and Chemotherapy, 47(9): 2810-2816
[12]. Sankawa U., Otsuka H., Kataoka Y., Iitaka Y., Hoshi A., Kuretani K. (1981). Antitumor activity of shikonin, alkannin and their derivatives. II. X-Ray analysis of cycol-alkannin leucoacetate, tautomeriom of alkannin and cycol-alkannin and antitumor activity of alkannin derivatives. Chemical & Pharmaceutical Bulletin, 29(1): 116-122
[13]. Ahn B.Z., Baik K.U., Kreon G.R., Lim K., Hwang B.D. (1995). Acylshikonin analogues: synthesis and inhibition of DNA topoisomerase-I. Journal of Medicinal Chemistry, 38: 1044-1047
[14]. Gao D., Hiromura M., Yasui H., Samurai H. (2002). Direct reaction between shikonin and thiols induces apoptosis in HL60 cells. Biological and Pharmaceutical Bulletin, 25(7): 827-832
[15]. http://biuletynfarmacji.wum.edu.pl/1101Bolonkowska/Bolonkowska.html
[16]. Boczkaj G., Jaszczołt G., Leman A., Skrzypczak A., Królicka A., Kamińska M.,2011. Zastosowanie cgromatografii cieczowej w odwróconym układzie faz (RP-LC) w rozdzielaniu i oznaczaniu polifenoli i naftochinonów w materiałąch roślinnych. Camera Separatoria (previously Postępy Chromatografii), Volume 3, Numer 1/June 2011 , 87-99. http://dach.ich.uph.edu.pl/cs/download/cs_vol3_no1/_cs_2011_87-100.pdf
Tagi:
teofilina,
paracetamol,
salicylany,
ekstrakcja,
chromatografia fazy odwróconej,
naftochinony,
lab,
laboratorium
wstecz
Podziel się ze znajomymi


 Zarówno paracetamol, teofilina jak i salicylany moga być w łatwy sposób ekstrahowane z osocza, dzięki czmu możliwe jest określenie ich stężenia w osoczu. Ekstrakcję tych leków prowadzi się przy zastosowaniu mieszaniny chlorek metylenu/propanol występujących w stosunku 9:1.
Zarówno paracetamol, teofilina jak i salicylany moga być w łatwy sposób ekstrahowane z osocza, dzięki czmu możliwe jest określenie ich stężenia w osoczu. Ekstrakcję tych leków prowadzi się przy zastosowaniu mieszaniny chlorek metylenu/propanol występujących w stosunku 9:1.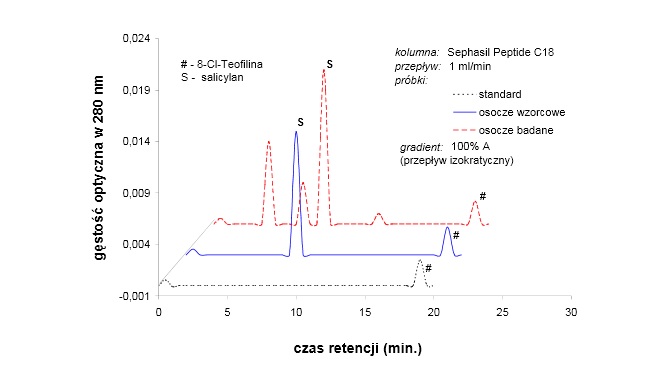
Recenzje