Hemoglobina jest barwnikiem krwi oraz podstawowym białkiem erytrocytów. Odpowiada za transport tlenu z pęcherzyków płucnych do tkanek. W 100 ml krwi ludzkien znajduje się od 13 do 16 gramów hemoglobiny- wartości te różnią się u kobiet i mężczyzn (13-15 g u kobiet oraz 14-16 g u mężczyzn). Hemoglobina produkowana jest w krwinkach czerwonych szpiku kostnego. Zaliczana jest do chromoprotein o masie cząsteczkowej 65 000, zawierając 0,34% żelaza. W budowie hemoglobiny wyróżnia się hem, który złożony jest z pierścienia protoporfiryny IX i żelaza, a także z globiny.
Cząteczka hemoglobiny składa się z 4 łańcuchów polipeptydowych białka tj.: dwóch łańcuchów α oraz dwóch β. Łańcuchy α i β różnią się między sobą ilością aminokwasów w cząsteczce. Każdy łańcuch peptydowy zawiera około 150 aminokwasów ułożonych w odpowiedniej genetycznie warunkowanej sekwencji. Między pętlami zwiniętego łańcucha aminokwasów- jakby w kieszonce tkwi jedna cząsteczka barwnika- hemu. Jedna cząsteczka globiny przyłącza zawsze 4 cząsteczki hemu [3]. Synteza pierścienia protoporfiryny zachodzi w erytroblastach z glicyny i bursztynylo-CoA. W dalszym etapie, pod wpływem syntezy hemu dochodzi do wbudowania żelaza, w wyniku czego powstaje hem. Hem łączy się następnie z globiną tworząc hemoglobinę [1], [2].
Do określania stężenia hemoglobiny najczęściej stosuje się jednostkę g/L lub g/dL. Wartość ta zależy od płci, wieku, a także warunków środowiskowych. Najpowszechniej stosowaną metodą służącą do określania stężenia hemoglobiny jest metoda cyjanomethemoglobinowa. W przypadku schorzeń związanych z zaburzeniami syntezy hemoglobiny (hemoglobinopatie, talasemie) wykonuje się elektroforezę hemoglobiny lub chromatografię o dużej rozdzielczości. W przypadku pomiaru stężenia hemoglobiny w surowicy lub w moczu, mamy do czynienia z tzw. „wolną hemoglobiną”. Podwyższone stężenie wolnej hemoglobiny w surowicy, a także pojawienie się jej w moczu występuje u osób z nasiloną hemolizą erytrocytów [1].
Każda cząsteczka hemu ma zdolność do nietrwałego, luźnego, przyłączenia jednej cząsteczki tlenu (02). W wyniku tego procesu, tlen umieszcza się i wchodzi w nietrwałe połączenia między żelazem zawartym w grupie hemowej, a jedną z reszt histydyny zawartej w peptydowej pętli. Tak więc, jedna cząsteczka hemoglobiny zawierająca 4 cząsteczki hemu, może jednocześnie przyłączyć cztery cząsteczki tlenu (proces ten zachodzi w płucach) [3]. Hemoglobina połączona z cząsteczką tlenu (Hb-O2) to tzw. oksyhemoglobina (w procesie utlenowania stopień utlenienia żela nie zmienia się). W procesie utleniania żelazo zmienia swój stopień utlenienia z Fe(II) do Fe(III) z jednoczesnym przyłaczeniem cząsteczki wody. W wyniku tej reakcji powstaje tzw. methemoglobina (Met-Hb) [2].
Funkcje fizjologiczne hemoglobiny
W warunkach fizjologicznych hemoglobina uczestniczy w transporcie dwutlenku węgla (CO2). Jej rola w tym procesie polega na odbieraniu całego dyfundującego z tkanek do naczyń włosowatych dwutlenku węgla. W wyniku złożonych reakcji zaraz po wyjściu krwinki z naczynia włosowatego uwalnia się do osocza znaczna większość chwilowo zatrzymanego w krwince CO2, który dalszą wędrówkę do płuc odbywa w osoczu w postaci wodorowęglanów (około 70% transportowanego CO2). Około 10% przenoszonego CO2, wiąże się na okres transportu do płuc z cząsteczką hemoglobiny przez grupy aminowe łańcuchów peptydowych, gdzie w formie związku karbohemoglobiny dociera do naczyń włosowatych pęcherzyków płucnych [3].
Struktury hemoglobiny
W funkcji hemoglobiny bardzo ważną rolę odgrywa budowa białka globiny. Najważniejsze znaczenie ma sekwencja aminokwasów w łańcuchach peptydowych, czyli tzw. struktura I-rzędowa białka. Poza pierwszorzędową strukturą białka , zachowana jest również struktura drugorzędowa, która wyrażona jest odpowiednią konfiguracją przestrzenną, gdyż każdy łańcuch polipeptydowy jest spiralnie zwinięty. Ponadto, oddziaływanie pomiędzy grupami bocznymi aminokwasów zawartych w łańcuchu peptydowym daje dalsze pofałdowanie łańcucha tj. strukturę III-rzędową. Trzeciorzędowość struktury globiny warunkowana jest sekwencją aminokwasów. Co ważne, zmiana tylko jednego aminokwasu w łańcuchu polipeptydowym powoduje widoczne zmiany i to zarówno w przestrzennej budowie cząsteczki, jak też w jej czynności fizjologicznej [3]. W IV-rzędowej strukturze hemoglobiny istotną rolę odgrywa przestrzenne ułożenie wobec siebie równoimiennych łańcuchów polipeptydowych. Połączenie czterech łańcuchów, a więc podjednostek (monomerów) białkowych, w jeden tetramer jest utrzymywane za pośrednictwem kilku typów słabych wiązań chemicznych (wśród nich wyróżnia się mostki wodorowe, mostki solne i wiązania Van der Waalsa). Struktura IV-rzędowa hemoglobiny ma bardzo duże znaczenie, poniewaz to właśnie ona zapewnia występowanie między cząsteczkami hemoglobiny właściwości kooperatywnych. Przyłączenie do hemoglobiny cząsteczki tlenu zwiększa dostępność pozostałych grup hemowych do tlenu, co w rezultacie powoduje, że każda następna cząsteczka łatwiej łączy się z hemoglobiną [3].
Hemoglobina płodowa
Znane są trzy typy prawidłowej hemoglobiny:
- hemoglobina A (Hgb A),
- hemoglobina A2,
- hemoglobina F (Hgb F)
- hemoglobina płodowa [4].
U osób dorosłych w największej ilości występuje hemoglobina Hgb A, stanowiąc >95%, zaś hemoglobina A2 w ilości 1,5% - 3,5%. Z kolei, hemoglobina F u osób dorosłych stanowi mniej niż 1%. W przypadku prawidłowo rozwijającego się płodu i noworodka stosunek hemoglobiny A i F jest odwrócony, gdzie w krwinkach czerwonych płodu znajduje się więcej hemoglobiny F. W celu określenia hemoglobiny płodowej wykonuje się barwienie rozmazu krwi metodą Kleihauer-Betke, gdzie z rozmazu krwi obwodowej matki pod wpływem kwaśnego buforu (pH 3.3), zostają usunięte wszystkie formy hemoglobin (z wyjątkiem HbF). Krwinki czerwone, zawierające hemoglobinę płodową zabarwiają się na kolor różowy [4]. Około 5 - 6 tygodnia życia płodowego, hemoglobina zbudowana jest z białek „e”-epsilon. Następnie, pojawia się hemoglobina HbF,która już zbudowana jest z 2 łańcuchów a i 2 łańcuchów g. Hemoglobina HbF stanowi ok. 90 - 95 % hemoglobiny u płodu w 4 - 5 miesiącu ciąży. Wraz z upływem każdego tygodnia jej zawartość obniża się o 3% do 4 % tygodniowo do 34 - 36 tygodnia ciąży. Proces ten powoduje, że wystąpienie przedwczesnego porodu sprzyja występowaniu niedokrwistości u dziecka.
Oznaczanie stężenia hemoglobiny (metoda Drabkina)
Hemoglobina i jej pochodne (z wyłączeniem sulfhemoglobiny) pod wpływem żelazicyjanku potasu ulegają utlenieniu do methemoglobiny. Maethemoglobina w reakcji z cyjankiem potasu daje trwały związek, zwany cyjanmethemoglobiną. Związek ten charakteryzuje się czerwono-brunatną barwą, a jego maksimum absorbancji mierzy się przy długości fali równej λ= 540 nm [5].
Wykonanie:
Do 5 cm3 odczynnika Drabkina (tj.: 0,03% K3[Fe(CN)6], 0,1% NaHCO, 0,005% KCN) należy dodać 0,02 ml krwi lub 0,5 ml surowicy lub 2 ml wzorca cyjanomethemoglobiny. Zawartość probówek dokładnie wymieszać, a po upływie 20 minut odczytać absorbancję wobec odczynnika Drabkina przy długości fali równej 540 nm. Na podstawie otrzymany wyników należy obliczyć stężenie hemoglobiny we krwi lub surowicy wg odpowiednich wzorów.
Stężenie hemoglobiny we krwi:
CHb we krwi = Abadana / Awzorca x Cwzorca (g/dl)
Stężenie hemoglobiny w surowicy:
CHb w surowicy = Abadana / Awzorca x Cwzorca (mg/dl) [5].
Kolorymetryczne oznaczanie hemoglobiny (Hemoglobin Colorimetric Assay Kit, Cayman Chemical, https://www.caymanchem.com/app/template/Product.vm/catalog/700540)
Hemoglobina (Hb lub Hgb) jest kulistym białkeim występującym głównie w erytrocytach, gdzie przenosi tlen z płuc do tkanek uwalniając tlen, a zabierając w powrotnej drodze dwutlenek węgla (z tkanek do płuc). Poza wiązaniem i transportem tlenu hemoglobina wiąże także CO2, tlenek węgla (CO) oraz tlenek azotu (NO).
Kit do kolorymetrycznego oznaczania hemoglobiny (Cayman Chemical) zapewnia szybki i niezawodny sposób określania stężenia całkowitej hemoglobiny w różnych próbkach biologicznych, w tym we krwi, homogenatach tkankowych oraz lizatach komórkowych. W przeciwieństwie do powszechnie przyjętego sposobu oznaczania hemoglobiny, wykorzystującego jako reagent cyjanek potasu, kit ten wykorzystuje zoptymalizowane odczynniki, które są nietoksyczne i dają dokładne wyniki pomiaru całkowitego stężenia hemoglobiny w zakresie absorbancji między 560 a 590 nm. Pojawiające się w wyniku reakcji intensywne zabarwienie jest wprost proporcjonalne do stężenia całkowitej hemoglobiny w próbce [6].
Odczynniki:
- 10x stężony bufor hemoglobinowy: fiolka zawiera 10 ml stężonego buforu do próbek (1 M fosforan potasu pH 7,4, zawierający 10 mM EDTA). Zawartość fiolki należy rozcieńczyć 90 ml wody do HPLC. Rozcieńczona próbka buforu (100 mM fosforan potasu, pH 7,4, zawierający 1 mM EDTA) jest używana do rozcieńczania próbek. Przy przechowywaniu w temperaturze 4 °C, roztwór jest trwały przez okres sześciu miesięcy.
- 4x stężony detektor hemoglobiny : każda fiolka zawiera 10 ml stężonego detektora hemoglobiny. Rozcieńczyć zawartość fiolki 30 ml wody do HPLC. Jedna fiolka wystarcza na oznaczenie jednej 96-dołkowej płytki. Przy przechowywaniu w temperaturze 4 °C, rozcieńczony detektor hemoglobiny jest trwały przez co najmniej jeden miesiąc.
- standard hemoglobiny: każda fiolka zawiera 1 ml 500 µM hemu. Odczynnik jest gotowy do przygotowania krzywej wzorcowej. Przy przechowywaniu w temperaturze 4 °C jest trwały przez okres sześciu miesięcy.
Przygotowanie próbek
Osocze: normalne stężenie hemoglobiny w osoczu ludzkim wynosi 0,03 g/dl.
- Pobrać krew stosując antykoagulant (heparyna lub cytrynian)
- Zwirować krew przy 700 – 1 000 x g przez 10 minut w temperaturze 4°C. Po wirowaniu pipetą zebrać górną żótą warstwę plazmy, uważając by nie naruszyć białej warstwy kożuszka. Przechowywać na lodzie lub w -80°C do momentu oznaczenia. Próbka osocza jest stabilna przez okres 1 miesiąca, jednakże należy unkać powtarzania cykli rozmrażania i zamrażania próbek. Przed oznaczeniem plazma nie musi być rozcieńczona.
Surowica:
- Pobrać krew do probówek bez koagulantu, po czym pozwolić krwi zakrzepnąć przez 30 minut w temperaturze 25°C.
- Zwirować przy 2000 x g przez 15 minut w temp. 4°C. Pipetą zebrać górną warstwę surowicy bez naruszania białej warstwy kożuszka. Surowicę przechowywać na lodzie, jeśli oznaczenie nie jest wykonywane tego samego dnia próbkę należy zamrozić w temp. -80°C (próbka będzie trwała przez 1 miesiąc). Przez oznaczeniem surowica nie musi być rozcieńczana.
Pełna krew: normalne stężenie hemoglobiny w ludzkiej krwi waha się w granicach 12 – 18 g/dl4.
- Pobrać próbkę krwi na antykoagulant
- Próbkę krwi przechowywać w 4°C (zamrażanie krwi często powoduje lizę krwinek czerwonych).
- Pełna krew przed oznaczeniem musi być rozcieńczona (zwykle wymagane jest rozcieńczenie próbek ³ 1:10).
Krwinki czerwone:
- Krew pobrać na antykoagulant (np. heparyna)
- Odwirować próbkę przy 700 – 1000 x g przez 10 minut w temp. 4°C. Zebrac górną żółtą warstwę plazmy, a następnie białą warstwę. Na samym dole próbki znajdują się czerwone krwinki krwi, które należy zebrać i przechowywać na lodzie, aż do momentu wykonania oznaczenia.
- Doprowadzić do lizy czerwonych krwinek poprzez rozcieńczenie próbki wodą w sosunku 1:1, po czym próbkę odwirować.
- Jeżeli oznaczenie nie jest wykonywane tego samego dnia, próbkę należy zamrozić w -80°C (będzie ona stabilna przez 1 miesiąc).
- Końcowe rozcieńczenie próbki przed oznaczeniem powinno być ³ 1:10 [6].
Homogenat tkanek
- Przepłukać tkankę w roztworze soli fizjologicznej (PBS) o pH=7,4 zawierającym 0,16 mg/ml heparyny, w celu usunięcia czerwonych krwinek oraz skrzepów.
- Tkankę homogenizować w bufrze PBS (5-10 ml) pH=7.4, zawierającym 0,16mg/ml heparyny na gram tkanki.
- Próbkę zwirować przy 10 000 xg przez 15 minut w 4°C.
- Po wirowaniu usunąć supernatant, a próbkę przechowywać na lodzie. Jeżeli oznczenie nie jest wykonywane tego samego dnia, należy ją zamrozić w -80°C (próbka będzie trwała przez co najmniej 1 miesiąc) [6].
Oznaczenie wykonuje się na 96-dołkowej płytce, przy czym nie istnieje określony wzór nakładania na płytkę standardu hemoglobiny i próbek. Ważne jest by każda próbka mierzona była w dwóch powtórzeniach (http://www.caymaneurope.com/pdfs/700540.pdf)
 Zdjęcie:
Zdjęcie: płytka 96-dołkowa (studzienki),
http://www.caymaneurope.com/pdfs/700540.pdfA-H – standard
S1 – S40 – przykładowe studzienki
Informacje ogólne dotyczące kitu (http://www.caymaneurope.com/pdfs/700540.pdf)
- Końcowa objętość próbki wynosi 200 ul (we wszystkich studzienkach).
- Przed przystąpieniem do oznaczenia wszystkie odczynniki należy doprowadzić do temperatury pokojowej.
- Zalecane jest wykonywanie oznaczenia próbek w co najmniej dwóch powtórzeniach.
- Oznaczenie należy wykonywać w temperaturze pokojowej.
- Wartość absorbancji mierzona jest w zakresie 560-590 nm [6].
Przygotowanie standardu
Standard należy przygotować zgodnie z tabelą zamieszczoną w instrukcji producenta. Przygotować 8 czystych, szklanych probówek opisanych kolejno od A-H, po czym odmierzyć do nich (zgodnie z instrukcją) standard hemoglobiny oraz detector hemoglobiny (zdjęcie poniżej):
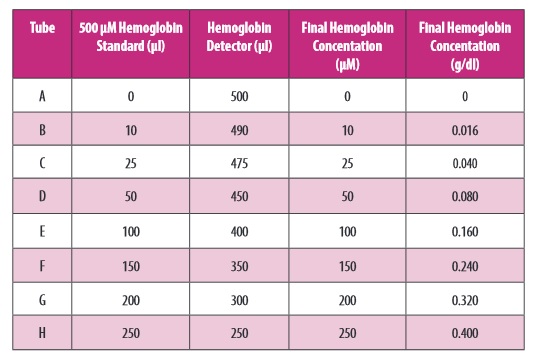
Zdjęcie: przygotowanie standardu, http://www.caymaneurope.com/pdfs/700540.pdf
Wykonanie oznaczenia:
- Do studzienek przeznaczonych na standard (opisanych A-H) odpipetować po 200 µl standardu hemoglobiny
- Do studzienek przeznaczonych na próbki odpipetować po 20 µl danej próbki (w dwóch powórzeniach)
- Do każdej studzienki z próbką należy odpipetować po 180 µl detectora hemoglobiny (nie dodawać do studzienek ze standardem)Płytkę nakryć folią i inkubować w temp. pokojowej przez 15 minut.
- Po upływie czasu inkubacji zmierzyć absorbancję w zakresie 560-590 nm. Co ważne, przed pomiarem absorbancji należy upewnić się, że w studzienkach nie ma pęcherzyków powietrza, które utrudniają pomiary [6].
Na podstawie uzyskanych wyników należy oznaczyć stężenie hemoglobiny w badanych próbkach korzystając z przygotowanej wcześniej krzywej wzorcowej, a dane podstawiając do odpowiedniego wzoru (podany w instrukcji producenta) [6].
Otrzymywanie oksyhemoglobiny (wg Kłyszejko-Stefanowicz L., 2003)
Materiał do badań: roztwór krwi w wodzie tj. 0,5 ml krwi w 10 ml H2O
Wykonanie:
Roztwór krwi w wodzie należy wytrząsać w probówce- w tym czasie hemoglobina nasyca się tlenem z powietrza i zmienia się w Hb-O2. Kolor roztworu zmienia się w jasnoczerwony. Roztwór oglądany w spektroskopie wykazuje 2 smugi : w żółtej i zielonej części widma, tj. przy 578 nm i 540 nm. W przypadku, gdy badany roztwór daje szerokie smugi absorpcyjne należy go odpowiednio rozcieńczyć (ma być widoczne wyraźne charakterystyczne widmo). Rozcieńczenie należy prowadzić uważnie, gdyż zbyt duże powoduje, że smugi absorpcyjne zanikają [2].
Otrzymywanie hemoglobiny (wg Kłyszejko-Stefanowicz L., 2003)
Wykonanie:
Do otrzymanego roztworu oksohemoglobiny należy dodac kilka kryształków środka redukującego (np. dwutionian sodu). Próbkę wymieszać (następuje zmiana barwy roztworu na czerwono-fioletową). W trakcie obserwacji w spektroskopie występuje tylko jedna smuga przy długości fali równej λ=565 nm. Świadczy to o przejściu oksyhemoglobiny w hemoglobinę. W przypadku, gdy do próbki nie dodano nadmiaru dwutionianu sodu, energiczne wytrząsanie próbki spowoduje ponowne przejście hemoglobiny w oksyhemoglobinę (pojawią się charakterystyczne dwie smugi w trakcie oglądania w spektroskopie) [2].
Autor: Lidia Koperwas
Literatura:
[1]. Szutowicz A., Raszei-Szpecht A., 2009. Diagnostyka laboratoryjna. Tom I.Gdański Uniwersytet Medyczny, Zlecenie KW/224/09.Recenzent prof. dr hab.Wiesława Łysiak-Szydłowska, s. 181-185.
[2]. Kłyszejko-Stefanowicz L., 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.582-587.
[3]. http://www.analiza-medyczna.pl/krew.html
[4]. http://www.labtestsonline.pl/Glossary/Glossary_Kleihauer_BetkeFetalHemoglobinStain.html
[5].http://biochemia.sum.edu.pl/0-CWICZENIA%20CALOSC/Cwiczenia%20-%20BIOCHEMIA%20MEDYCZNA/LAB7_Bm_BT_hemoglobina.pdf
Tagi:
hemoglobina,
hem,
oksyhemoglobina,
globina,
hemoglobina płodowa,
Hgb F,
metoda Drabkina,
stężenie całkowitej hemoglobiny,
kolorymetryczne oznaczanie hemoglobiny
wstecz
Podziel się ze znajomymi




Recenzje