

|
Zamknij X
|
Glukoza zaliczana jest do najważniejszych węglowodanów, ponieważ większość węglowodanów, które zawarte są w pokarmach wchłania się do krwiobiegu właśnie w postaci glukozy. Ponadto węglowodany przekształcane są w glukozę w wątrobie, a w organizmie z glukozy mogą powstać wszystkie inne cukry. Glukoza stanowi istotne źródło energii w tkankach ssaków , a także odgrywa bardzo ważną rolę w prawidłowym rozwoju płodu. Cukier ten przekształcany jest w inne cukry odgrywające swoiste rolę np. w rybozę, która występuje w kwasach nukleinowych czy galaktozę obecną w laktozie mleka [1].
Glukoza jest niezbędna do prawidłowego funkcjonowania metabolizmu komórkowego. Szczególnie wrażliwe na brak glukozy są komórki nerwowe. W organizmie związek ten wykorzystywany jest głównie jako źródło energii. Ponadto glukoza reguluje przemianę tłuszczową, zmniejsza stopień zatrucia jadami, a także przyspiesza gojenie się ran [7].
Oznaczanie glikemii (poziomu cukru we krwi) w monitorowaniu cukrzycy
Oznaczanie glikemii przeprowadzane w celu monitorowania leczenia i oceny wyrównania metabolicznego cukrzycy wykonywane jest w pełnej krwi włośniczkowej. Krew włośniczkowa pobierana jest zwykle z opuszki palca, a u noworodków i dzieci z pięty. Niestety przydatność tego typu materiału jest mocno ograniczona, co w głównej mierze wynika z faktu domieszki płynu tkankowego, słabą standaryzacją stosowanej do pobrania procedury, a także ilości możliwych do wykonania badań. Największe znaczenie w badaniach ma krew żylna, z kolei krew włośniczkowa pobierana jest wtedy, gdy pobranie krwi żylnej nie jest możliwe lub utrudnione [2], [3].
Glukoza bardzo szybko transportowana jest przez błonę komórkową do wnętrza erytrocytów. Transport odbywa się przez transportery glukozy określane jako GLUT. Transporter glukozy 1 (GLUT1) uważany jest za najlepiej poznaną i najbardziej rozpowszechnioną izoformę rodziny białek GLUT. W stanach fizjologicznych wysoki poziom ekspresji GLUT1 obserwuje się: w erytrocytach (3–5% wszystkich białek błonowych), nabłonku endotelialnym, nabłonku epitelialnym bariery krew–mózg, oku, łożysku oraz gruczole mlekowym ssaków [3],[4]. Przeprowadzone badania sugerują możliwość zastosowania GLUT1 jako prognostycznego wskaźnika złośliwości oraz stopnia zaawansowania nowotworów. Co więcej wskaźnik ten umożliwiłby wyodrębnienie pacjentów wymagających agresywniejszej terapii [4].
Stężenie glukozy w erytrocytach jest niższe niż w osoczu, co wynika z faktu jej przemiany do glukozo-6-fosforanu. Pomiar stężenia glukozy glukometrami daje zazwyczaj niższe wartości glikemii niż stosowane analizatory laboratoryjne, które mierzą ten metabolit w osoczu. Oznaczenia glukozy wykonywane w monitorowaniu cukrzycy przeprowadzane są w różnych porach dnia (zależnych od aktywności chorego i przyjmowanych posiłków), kiedy to oczekuje się skrajnych wartości glikemii w ciągu doby. Dobowy profil glikemii obejmuje pomiary glukozy wykonywane: rano na czczo, przed każdym głównym posiłkiem, 120 minut po każdym głównym posiłku, przed snem, o północy oraz o godzinie 3:30 w nocy [2].
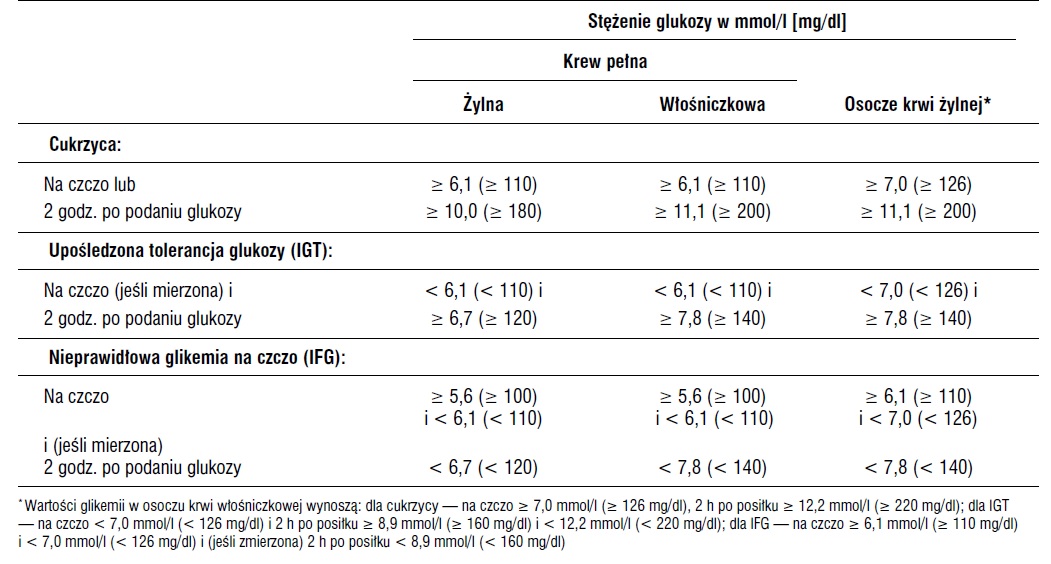
Zdjęcie: Wartości diagnostyczne cukrzycy i innych stanów hiperglikemii, wg Górczyńska-Kosiorz S., Grzeszczak W., Mazur B., 2005 [6].
Zasady pobierania i przechowywania próbek krwi do badań poziomu glukozy
Materiałem do oznaczania glukozy może być: pełna krew żylna, surowica na skrzep lub krew włośniczkowa. Krew włośniczkowa natychmiast po pobraniu musi być hemolizowana i odbiałczona bądź należy od razu po pobraniu wykonać pomiar. Jeśli oznaczenia wykonuje się w pełnej krwi, próbkę należy przechowywać w temperaturze 0–4°C albo niezwłocznie odwirować lub wykonać pomiar. We krwi włośniczkowej arterializowanej po posiłku stężenie glukozy jest do 20% większe niż we krwi żylnej. Pomiar wykonywany w surowicy i osoczu jest o 10% - 15% wyższy niż uzyskany z pełnej krwi, co ma związek z brakiem obecności w próbce krwinek. Glukoza nie powinna być oznaczana w surowicy,jeśli z próbki dobrze nie usunięto erytrocytów,ponieważ z powodu zachodzącej glikolizy może dojść do nieprzewidywalnego zaniżenia rzeczywistego stężenia glukozy [6].
Na jakość wykonywanych oznaczeń glukozy w bardzo dużej mierze decyduje prawidłowe postępowanie z materiałem przeznaczonym do badań w fazie przed-analitycznej. Należy mieć na uwadze, że w pobranej próbce krwi glukoza jest metabolizowana przez krwinki również in vitro, w związku z czym krwinki muszą zostać oddzielone od osocza do 60 minut od pobrania materiału. Tak więc wymóg ten określa najdłuższy czas w jakim pobrana próbka krwi musi być dostarczona do laboratorium, by nadawała się do badań. W temperaturze pokojowej zachodzący w krwinkach proces glikolizy powoduje zmniejszanie stężenia glukozy o 5-7% w ciągu godziny a we krwi, która zawiera dużą liczbę leukocytów spadek ten jest większy. Przechowywanie pełnej krwi w lodówce w temp. 4°C powoduje spadek stężenia glukozy o około 20% w ciągu 24 godzin. By temu przeciwdziałać zaleca się dodawanie do pobieranej krwi substancji spowalniających glikolizę, np. fluorku sodu czy jodooctanu sodu. Związki te zazwyczaj są stosowane razem z antykoagulantami, takimi jak szczawian lub EDTA [5].
Metabolizm glukozy w prawidłowych komórkach
W komórkach prawidłowych w procesie tzw. glikolizy, glukoza metabolizowana jest do dwóch cząsteczek pirogronianu. W wyniku tej reakcji dochodzi do wytworzenia dwóch cząsteczek ATP. Powstały pirogronian w mitochondriach jest następnie utleniany do acetylo-CoA , co zachodzi z udziałem kompleksu dehydrogenazy pirogronianowej. W kolejnym etapie acetylo-CoA wchodzi w cykl Krebsa, w którym ulega utlenieniu do dwutlenku węgla (CO2), a zmagazynowana energia (w postaci koenzymów: NADH i FADH2 ) podlega przemianie w cząsteczki ATP podczas transportu elektronów poprzez układy oksydoredukcyjne łańcucha oddechowego. W wyniku całkowitego utlenienia cząsteczki glukozy powstaje 30 cząsteczek ATP [4].
Glukoza stanowi podstawowe źródło energii dla dla ośrodkowego układu nerwowego. Wszelkie zaburzenia w dostarczaniu glukozy do mózgu wywołują: ostre, podostre i przewlekłe zaburzenia funkcji mózgu, które określane są mianem neuroglikopenii. Przewlekłe i nawracające stany hipoglikemiczne prowadzą do powstawania ogniskowych uszkodzeń mózgu, które następnie są przyczyną rozwoju zespołów psychoorganicznych (np. zmian osobowości, ubytków pamięci, demencji). Co więcej cukrzyca stanowi jeden z czynników zwiększonego ryzyka zachorowania na chorobę Alzheimera [2].
Metody enzymatyczne oznaczania glikemii
Oznaczenie glukozy we krwi (osoczu) można wykonać kilkoma różnymi metodami. Stosowane są 2 metody enzymatyczne, gdzie jedna bazuje na wykorzystaniu do reakcji oksydazy glukozowej, a druga układ heksokinaza/dehydrogenaza glukozo-6-fosforanu; metoda toluidynowa (swoista dla aldoloz) czy metoda Samogyi-Nelsona oraz jej modyfikacje oparte na redukcji miedzi.
Pomiar przebiegu zachodzących reakcji odbywa się przy użyciu technik spektrofotometrycznych i technik amperometrycznych. Metodą referencyjną (odniesienia) dla oznaczenia glukozy jest spektrometria masowa z rozcieńczeniem izotopu (ID-MS, isotope dilution mass spectometry).
W laboratoriach najczęściej stosowana jest metoda oksydazowa z wykorzystaniem różnych technik pomiaru. Za drugorzędną enzymatyczną metodę oznaczania glukozy uznawana jest metoda heksokinazowa, która charakteryzuje się stosunkowo lepszą czułością oraz swoistością w porównaniu do metody oksydazowej. Metoda heksokinazowa wykazuje również mniejszą podatność na czynniki interferujące [6].
Metoda Nelsona – wykorzystanie do oznaczania stężenia glukozy we krwi (wg Krajewski T., 1959).
Zasada metody: metoda polega na odbiałczeniu krwi za pomocą koloidalnej zawiesiny wodorotlenku cynku. Otrzymany przesącz gotuje się z roztworem zawierającym Cu(II) i Cu(I), w wyniku czego w próbce powstaje ceglasty osad Cu2O. Tlenek miedzi (I) rozpuszcza się w odczynniku arsenomolibdenowym, w wyniku czego w próbce pojawia się niebieskie zabarwienie [7], [8].
Przygotowanie odczynników:
1) Odczynnik miedziawy I: w 600 ml wrzącej wody rozpuścić 200 g bezwodnego Na2SO4 (lub 356 g Na2SO4). Następnie, w 100 ml wody rozpuścić 25 g soli Seignetta (winian sodowo-potasowy). Obydwa roztwory zmieszać w 1-litrowej kolbie miarowej, po czym dodać 20 g NaHCO3 oraz 25 g bezwodnego Na2CO3. Całość dokładnie rozpuścić i uzupełnić wodą do kreski. Otrzymany roztwór należy przesączyć w przypadku, gdy pojawi się zmętnienie. Tak przygotowany odczynnik przechowywać w temperaturze 37°C (gdy wytrącą się kryształy należy je rozpuścić przed użyciem przez lekkie ogrzanie roztworu w łaźni wodnej) [7], [8].
2) Odczynnik miedziowy II: 15% roztwór CuSO4∙5 H2O + 1-2 krople stężonego roztworu H2SO4.
3) Mieszanina odczynnika miedziowego I i II: bezpośrednio przed użyciem sporządzić roztwór z obydwu odczynników zmieszanych w stosunku 25:1.
Wykonanie:
W stosunku 5:1 należy zmieszać odpowiednią ilość mieszaniny roztworów: 0,45% (rozcieńczyć z roztworu 45%) ZnSO4 i 0,1 M NaOH (0,4%). Do 2,9 ml mieszaniny odczynników dodać 0,1 ml krwi pobranej z opuszka palca. Pipetę oczyścić z krwi z zewnątrz, wydmuchać krew do mieszaniny i następnie przepłukać pipetę tą samą mieszaniną. Otrzymaną w ten sposób próbkę umieścić we wrzącej łaźni wodnej (3-5 minutowa inkubacja). Po upływie czasu inkubacji próbkę należy ostudzić i przesączyć przez mały sączek.
Następnie do 1 ml przesączu dodać 1 ml mieszaniny odczynników miedziowych (odczynnik miedziowy I i II), próbkę gotować we wrzącej łaźni wodnej przez 20 minut. Ostudzić, po czym wprowadzić 1 ml odczynnika arseno-molibdenowego (tj.: 25 g molibdenianu(VI)amonu rozpuścić w 450 ml wody, dodać 31 ml stężonego roztworu H2SO4. W osobnym naczyniu rozpuścić 3 g arsenianu(V)sodowego w 25 ml wody. Obydwa roztwory zmieszać i inkubować w temp. 37°C przez 24-48h lub ogrzać do temp. 55°C i trzymać w tej temperaturze przez 25 minut). Próbkę wytrząsać do momentu przestania wydzielania pęcherzyków gazu (CO2), a cały tlenek miedzi(I) (miedziawy) rozpuści się. Do próbki dodać 7 ml wody, zmieszać i wykonać oznaczenie kolorymetryczny przy długości fali równej λ= 660 nm (wobec próbki kontrolnej).
W analogiczny sposób należy wykonać oznaczenie z roztworem wzorcowym, gdzie zamiast 0,1 ml krwi pobiera się 0,1 ml roztworu wzorcowego o odpowiednim stężeniu mieszczącym się w zakresie od 10 do 200 mg/100 ml – przyrządzonego przez rozcieńczenie roztworu wzorcowego glukozy.
Wykonanie obliczeń: zachodząca w trakcie oznaczenia reakcja barwna stosuje się do prawa Lamberta-Beera. Stężenie glukozy można obliczyć ze wzoru, z krzywej kalibracyjnej [7],[8].
Oznaczanie glukozy metodą kolorymetryczną z oksydazą glukozy w wykorzystaniem zestawu diagnostycznego (Lquick Cor-GLUCOSE ).
Do oznaczenia wykorzystuje się roztwór wzorcowy glukozy o stężeniu 100 mg/dl (5,5 mmol/l). Materiałem badanym jest próbka surowicy krwi ludzkiej [9].
Wykonanie:
a) Oznaczenie próby zerowej: odczynnik do oznaczeń pozostawić do osiągnięcia temperatury pokojowej. Następnie do kuwety polistyrenowej (d=10 mm) należy pobrać 800 ml odczynnika, po czym dokonać pomiaru absorbancji przy długości fali λ=500 nm.
b) Oznaczenie próby wzorcowej: do probówki typu eppendorf dodać 1 ml odczynnika do oznaczeń. Próbkę pozostawić do osiągnięcia temperatury pokojowej. Następnie dodać 10 μl roztworu wzorcowego, całośc dokładnie wymieszać i pozostawić na 10-minutową inkubację. 800 ml roztworu przenieść do kuwety pomiarowej. Zmierzyć absorbancję próbki przy długości fali równej λ= 500 nm (względem próby zerowej będącej próbą odniesienia). Pomiar powtórzyć trzykrotnie.
c) Oznaczenie próbki badanej: do probówki typu eppendorf dodać 1 ml odczynnika do oznaczeń, pozostawić do osiągnięcia temperatury pokojowej. Po ustaleniu temperatury dodać 10 μl roztworu badanego, próbkę wymieszać i pozostawić na 10 min inkubacji. Przenieść 800 ml roztworu do kuwety pomiarowej, po czym zmierzyć absorbancję przy długości fali λ=500 nm (względem próby zerowej jako próby odniesienia). Pomiar powtórzyć trzykrotnie [9].
Na podstawie otrzymanych wyników należy obliczyć stężenie glukozy w badanej próbie. W tym celu skorzystać ze wzoru:
Stężenie glukozy= A (PB) / A(PW) x stężenie wzorca
Gdzie:
A(PB)- wartość absorbancji dla próby badanej
A(PW)- wartość absorbancji dla próby wzorcowej [9].
Metoda o-toluidynowa do oznaczania stężenia glukozy (wg Krawczyński J., Osiński T., 1967)
W wyniku ogrzewania z o-toluidyna w środowisku bezwodnym (lodowaty kwas octowy) glukoza daje barwny produkt kondensacji. Poza glukozą reakcji tej ulega również galaktoza. Słabej reakcji w powyższych warunkach ulega z kolei fruktoza.
Wykonanie:
a) Wykreślenie krzywej kalibracyjnej: do probówek odmierzyć następujące ilości roztworu wzorcowego glukozy (roztwór wzorcowy glukozy o stężeniu 100 mg/100 ml sporządzony w 0,2% roztworze kwasu benzoesowego): 0,1; 0,2; 0,3; 0,4 oraz 0,6 ml.
Próbki uzupełnić kwasem trichlorooctowym do objętości 1,2 ml. Z każdej probówki pobrać po 0,5 ml do wywołania barwy. Poszczególne roztwory odpowiadają następującym stężeniom: 50, 100, 150, 200 oraz 300 mg/100 ml [7], [10].
b) Oznaczenie: do probówki wirówkowej dodać 1 ml 5% roztworu CCl3COOH oraz 0,2 ml krwi (mikropipetę z krwi przepłukać roztworem z probówki). Próbkę wymieszać i odwirować (po kilku minutach). Do 0,5 ml otrzymanego po wirowaniu supernatantu należy dodać 4,5 ml odczynnika o-toluidynowego (tj.: 1,5 g tiomocznika rozpuścić w 940 ml lodowatego kwasu octowego i dodać 60 ml o-toluidyny). Próbkę wstawić do wrzącej łaźni wodnej na dokładnie 8 minut!. Po inkubacji ochłodzić pod bieżącą wodą, a następnie zmierzyć wartość absorbancji przy długości fali równej λ=630 nm (wobec próby kontrolnej, gdzie zamiast 0,5 ml supernatantu bierze się 0,5 ml roztworu CCl3COOH). Wynik należy odczytać z przygotowanej krzywej kalibracyjnej [7], [10].
Autor: Lidia Koperwas
Literatura:
[1]. Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W.,1995. BIOCHEMIA HARPERA, Wydanie III, Redaktor naukowy tłumaczenia Franciszek Kokot. Wydawnictwo Lekarskie PZWL, s.161-162
[2]. Szutowicz A., Raszei-Szpecht A., 2009. Diagnostyka laboratoryjna. Tom I.Gdański Uniwersytet Medyczny, Zlecenie KW/224/09.Recenzent prof. dr hab.Wiesława Łysiak-Szydłowska, s.243-244; 251-252
[3]. http://www.invicta.pl/upload/PZPOZ/ODCINEK%2010%20INVICTA.pdf
[4]. Jóźwiak P., Lipińska A., 2012. Rola transportera glukozy 1 (GLUT1) w diagnostyce i terapii nowotworów. Postepy Hig Med Dosw (online), 2012; 66: 165-174
[5]. http://diabetologiaonline.pl/lekarz_diabeto_adoz,info,76,0.html
[6]. Górczyńska-Kosiorz S., Grzeszczak W., Mazur B., 2005. The classification of diabetes including genetic predisposition and laboratory tests useful to diagnose disorders of carbohydrate metabolism. Praca poglądowa. Diabetologia Doświadczalna i Kliniczna rok 2005, tom 5, nr 4
[7]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.603-605.
[8]. Krajewski T., 1959. Oznaczanie poziomu cukru we krwi uproszczoną metodą Nelsona. Pol.Tyg.Lek., 14: 922-924.
[9]. http://www.pchba.amu.edu.pl/cw%20CBA/cw2.pdf
[10]. Krawczyński J., Osiński T., 1976. Laboratoryjne metody diagnostyczne. PZWL., Warszawa, s.943.
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje