 Dehydrogenaza mleczanowa (określana w skrócie jako LDH) jest enzymem, który katalizuje konwersję mleczanu do pirogronianu (w obecności związku NAD+) i odwrotnie (pirogronian do mleczanu w obecności NADH). Jest to enzym występujący we wszystkich komórkach oraz płynach ustrojowych [1].
Dehydrogenaza mleczanowa (określana w skrócie jako LDH) jest enzymem, który katalizuje konwersję mleczanu do pirogronianu (w obecności związku NAD+) i odwrotnie (pirogronian do mleczanu w obecności NADH). Jest to enzym występujący we wszystkich komórkach oraz płynach ustrojowych [1]. Dehydrogenaza mleczanowa wraz z kilkoma innymi enzymami (tzw. enzymami śródkomórkowymi) , uczestniczy w przemianie aminokwasów i węglowodanów. Duże stężenie dehydrogenazy mleczanowej i pozostałych enzymów odnotowuje się w mięśniach szkieletowych, wątrobie, a także w mózgu, zaś wzrost ich aktywności w surowicy krwi może wskazywać na martwicę lub uszkodzenie tychże narządów [1].
Wzrost aktywności dehydrogenazy (LDH) obserwuje się we wszystkich stanach chorobowych, które przebiegają z martwicą tkanek. Aktywność enzymu wzrasta w ostrym uszkodzeniu mięśnia sercowego, krwinek czerwonych, nerek, a także mięśni szkieletowych, wątroby, płuc oraz w uszkodzeniach skóry. Ponadto, znaczny wzrosty aktywności obserwuje się także w niedokrwistościach hemolitycznych, w niedokrwistościach spowodowanych niedoborem witaminy B2 lub kwasu foliowego, oraz w schorzeniu określanym mianem policytemii prawdziwej.
W przypadku, gdy obserwuje sie wahające wzrosty oraz spadki aktywności enzymu LDH, można wnioskować o zawale mięśnia sercowego. W pierwszych 3—4 dniach wzrost enzymu z następczym spadkiem w kolejnych 5—7 dniach choroby, może być dowodem potwierdzającym zawał serca (po wcześniejszym wykluczeniu następujących chorób: zawału płuc, choroby nowotworowej i niedokrwistości megalobiastycznej) [1].
Budowa dehydrogenazy mleczanowej (LDH)Dehydrogenaza mleczanowa surowicy składa się z 5 izoenzymów. Izoenzymy te są tetramerami złożonymi z 2 rodzajów podjednostek tj. podjednostki H i podjednostki M. Izoenzymy różnią się między sobą kinetyką enzymatyczną, a także ruchliwością elektroforetyczną, oraz pod względem chromatograficznym i immunologicznym [1]. Każda z podjednostek kodowana jest przez inny gen i tak: gen, który koduje podjednostkę H dehydrogenazy zlokalizowany jest na chromosomie 12, z kolei gen dla podjednostki M leży na chromosomie nr 11. Połączenie obydwu podjednostki H i M do tetrameru prowadzi do utworzenia 5 izoenzymów dehydrogenazy mleczanowej. Wszystkie rodzaje izoenzymów występują w surowicy krwi zdrowych osób. Co więcej, znany jest także szósty rodzaj izoenzymu dehydrogenazy mleczanowej, który określany jest jako izoenzym C4 (LDH-X). Izoenzym ten zlokalizowany jest jedynie w jądrach i plemnikach, a do ekspresji genu kodującego ta podjednostkę dochodzi po osiągnięciu dojrzałości płciowej [2].
Stężenie dehydrogenazy mleczanowej jest kilkakrotnie wyższe w komórce niż w surowicy. Zauważalny i mierzalny wzrost poziomu LDH w komórce jest nawet w momencie uszkodzenia niewielkiej liczby komórek, w wyniku którego dochodzi do wypływu enzymu. Należy dodatkowo zaznaczyć, że poszczególny izoenzymy różnią się między sobą, dzięki czemu możliwe jest także oznaczanie poziomu poszczególnych izoenzymów w surowicy [2].
Znaczenie diagnostyczne określania poziomu dehydrogenazy mleczanowej
Oznaczanie poziomu LDH okazuej się bardzo pomocne w trakcie diagnostyki uszkodzeń tkankowych. Izoenzymy LDH1 oraz LDH2 ze względu na swój charakterystyczny profil w mięśniu sercowym, wykorzystywane były w diagnostyce zawału mięśnia sercowego, jednakże ze względu na fakt, że do zmian poziomu LD dochodzi w dość długim czasie zaprzestano jego oznaczania i test ten nie jest obecnie już używany.
Aktualnie, pewne znaczenie diagnostyczne ma LDH-C4, obecny w płynie nasiennym mężczyzn z oligospermią. W wyniku przeprowadzonych obserwacji zauważono, że pacjenci, którzy poddani zostali terapii testosteronowej i odpowiadających pozytywnie na tę terapię, wykazują wzrost aktywności LDH-C4 przed wzrostem plemników. Takie wyniki pozwalają na wyselekcjonowanie grupy osób, u których zastosowana terapia może przebiec pozytywnie i zakończyć się sukcesem terapeutycznym.
Wysoka aktywność enzymu u osób z azoospermią, może być przesłanką skłaniającą do wdrożenia terapii hormonalnej, która może również zakończyć sie pozytywnie [2]. W diagnostyce zapalenia wątroby obserwuje się wzrost w surowicy frakcji LDH5. Ponadto, wartości enzymu mierzy się także w takich chorobach jak: białaczki, nowotwory, anemie i inne, co wskazuje na duże znaczenie diagnostyczne [3].
Test optyczny Warburga
Metoda Wróblewskiego wykorzystywana jest do pomiaru zmniejszania się wartości absorbancji (przy λ=340 nm) w trakcie redukcji pirogronianu do mleczanu.
Zmiany absorbancji obserwowane w jednostce czasu będące miarą szybkości zachodzenia reakcji, która to jest proporcjonalna ( w określonych warunkach) do stężenia danego enzymu, określana jest mianem tzw. testu optycznego Warburga. Test ten często wykorzystywany jest do określania aktywności m.in. dehydrogenazy mleczanowej (LDH), oraz innych dehydrogenaz, których koenzymem jest albo NAD+ albo NADP+. Ponadto, można go także wykorzystać do oznaczania enzymów, które katalizują reakcje sprzężone z dehydrogenazami (takie, gdzie w końcowym etapie reakcji dochodzi do redukcji nukleotydów pirydynowych) [3].
Oznaczanie LDH w surowicy z wykorzystaniem metody Wróblewskiego i La DueWykonanie:Do 2,7 ml roztworu buforu fosforanowego (o pH=7,4) należy dodać 1 ml surowicy (nie zawierającej produktów hemolizy) oraz 0,1 ml roztworu NADH (tj. 2,5mg w 1 ml buforu fosforanowego). Tak przygotowany roztwór należy dokładnie wymieszać i inkubować przez 20 minut w temperaturze 25 st.C. Po upływie czasu inkubacji należy rozpocząć reakcję przez dodanie do mieszaniny 0,1 ml substratu (tj. 2,5 mg pirogronianu sodu w 1 ml buforu fosforanowego o pH=7.4). Po dodaniu substratu należy od razu rozpocząć pomiary absorbancji przy λ= 340 nm – odczyty wartości powtarzać co 1 minutę. W trakcie kilku minut pomiarów powinno sie zaobserwować spadek absorbancji, który powinien być proporcjonalny do czasu pomiarów. W przypadku, gdy zauważy się nieliniowy przebieg reakcji ( duża aktywność), wtedy należy zmniejszyć ilość użytej surowicy [3].
Otrzymane wyniki podaje się w tzw. jednostkach Wróblewskiego lub międzynarodowych jednostkach (U). Jednostka Wróblewskiego definiowana jest jako taka aktywnośc enzymu w 1 ml surowicy,która w temperaturze 25 st.C i w objętości 3 ml, a także przy długości fali równej λ==340 nm i grubości warstwy pomiarowej wynoszącej 1 cm, w czasie 1 minuty daje zmianę mierzonej absorbancji NADH o 0,001. Aktywność dehydrogenazy mleczanowej w jednostkach Wróblewskiego oblicza się z następującego wzoru:
A ∙ 1000/ a gdzie:
A - Średnia zmierzona wartośc absorbancji (∆A) w ciągu 1 minuty
a - Ilość (ml) surowicy użytej do wykonania oznaczeniaW przypadku podawania wyniku w jednostkach międzynarodowych należy zastosować inny przelicznik, ponieważ jednostka międzynarodowa U jest to taka ilośc enzymu, która przekształca 1 µmol substratu / minute/1000 ml. Dla NADH milimolowy współczynnik absorpcji (przy λ=340 nm) wynosi 6,22, co z kolei oznacza, że absorbancja roztworu zawierającego 1 µmol NADH w 1 ml wynosi 6,22 (przy zastosowaniu do pomiaru kuwet 1-cm). Dla objętości mieszaniny reakcyjnej równej 3 ml to A= 2,07, tak więc:
Aktywność LDH [U]= A ∙ (1000/0,1) / 2,07 = A ∙ 4830
gdzie:
A - Zmierzona średnia wartość ∆A w ciągu 1 minuty dla 0,1 ml surowicy [3].Ustalenie poziomu dehydrogenazy mleczanowej (LDH) w surowicy oraz połączenie wyników z wynikami innych klinicznie istotnych oznaczeń enzymatycznych (m.in. GOT, AspAT, CRK) stanowi doskonałe narzędzie dla lekarza do podejmowania decyzji w przypadkach towarzyszących uszkodzeniu tkanek, lub zmian w przepuszczalności błony. W zawale serca w ciągu 12 godzin poziom LDH w surowicy zaczyna rosnąć, osiągając maksymalną wartość po upływie 48-72 godzin. Podwyższony poziom enzymu jest proporcjonalny do uszkodzenia tkanki mięśniowej serca (w ciężkich przypadkach jego wysokość może być nawet trzykrotnie przekroczona). Podniesienie aktywności LDH w surowicy może wskazywać na wystąpienie także innych chorób (np. niedokrwistości, nowotworów czy choroby wątroby), tak więc ważne jest, by wiedzieć, z konkretnie jakiej tkanki została uwolniona dehydrogenaza mleczanowa do krwiobiegu.
Cząsteczka dehydrogenazy (LDH) jest tetramerem zbudowanym z dwóch typów podjednostek, kodowanych przez różne geny (jak wspomniano wyróżniamy podjednostkę H -serce i podjednostkę M-mięśni), z kolei z nich możliwe jest uzyskanie 5 różnych kombinacji enzymu, określanych mianem izoenzymów:
- H4(LDH-1)
- H3M1 (LDH-2)
- H2M2 (LDH-3)
- H3M3 (LDH-4)
- M4 (LDH-5)
Podczas gdy LDH-1 i LDH-2 znaleźć można przede wszystkim w mięśniu sercowym i erytrocytach, wątroba oraz tkanki mięśni gładkich zawierają głównie izoenzym LDH-5 [4].
Obszary największej koncentracji dla każdego typu izoenzymu są następujące:
- LDH-1: serce i czerwone krwinki
- LDH-2: białe krwinki
- LDH-3: płuca
- LDH-4: nerki, łożysko, trzustka
- LDH-5: wątroba, mięśnie szkieletowe [6].
Elektroforetyczny rozdział izoenzymów LDHZe względu na to, że poszczególne izoenzymy dehydrogenazy mleczanowej różnią się między sobą składem aminokwasowym, mogą być one rozdzielane ektroforetycznie. I tak, w polu elektrycznym o pH= 8,8 , forma LDH-1 migruje najszybciej w kierunku anody, podczas gdy LDH-5 jest najwolniejszym izoenzymem. Po elektroforezie izoenzymy LDH mogą być wizualizowane z wykorzystaniem odpowiedniego barwienia [4].
Dehydrogenaza mleczanowa (LDH) przekształca mleczan do pirogronianu w trakcie odwracalnej reakcji. Enzym ten powszechnie występuje w błonach komórkowych oraz w cytoplazmie, i uwalniany jest z komórek do supernatantu hodowli natychmiast po uszkodzeniu komórek [5]. LDH stosowana jest jako marker zwyrodnienia komórek w wielu dziedzinach, m.in. w toksykologii i immunologii nowotworów. Pomiaru aktywności enzymu dokonuje się przez wykrywanie poziomu dinukleotydu nikotynamidoadeninowego (NAD+) z wykorzystaniem światła ultrafioletowego[5].
Zdjęcie: Budowa NAD, [7].
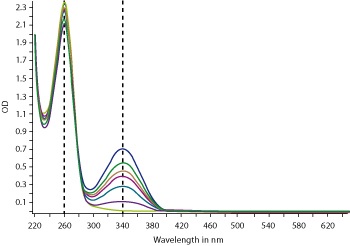
Redukcję pirogronianu do mleczanu przez dehydrogenazę w trakcie, której dochodzi do przekształcenia NADH do NAD+ można śledzić spektrofotometrycznie. Forma zredukowana NADH posiada dodatkowe pasmo absorpcji przy λ=340 nm, w związku z tym szybkość przebiegu reakcji tworzenia się NAD+ i mleczanu można śledzić, mierząc w tym celu zanik pasma absorpcji przy 340 nm (metoda Wróblewskiego) [8], [9].
Zdjęcie: Widmo absorpcyjne dla NAD+ i NADH. NAD+- linia niebieska, NADH- linia czerwona, [10].
Dinukleotyd nikotynoanidoadeninowy (NAD+), zredukowana forma NADH, NADP+ oraz zredukowana forma NADPH, odgrywają istotną rolę w metabolizmie energetycznym czy antyoksydacyjnym, co więcej w ostatnich latach związki te okazały się być zaangażowane również w inne funkcje fizjologiczne, jak również w starzenie czy stres oksydacyjny, wewnątrzkomórkową homeostazę wapnia, produkcję ROS, śmierć komórek i ekspresję genów [10]. Co więcej, przeprowadzone w ostatnim czasie badania sugerują pojawienie się nowych paradygmatów dotyczących metabolizmu NADP i NAD. Zaplanowane na przyszłość badania nad metabolizmem i biologiczną funkcją NAD i NADP mogą ujawnić fundamentalne właściwości tych związków, dzięki czemu sugerują one nowe strategie w leczeniu chorób oraz spowalniania procesów starzenia komórek [11].
Test LDHTest na obecność dehydrogenazy mleczanowej (test LDH) przeprowadzany jest w celu oceny stopnia toksyczności badanej substancji, w porównaniu do komórek, które przylegają do podłoża. Jak każdy tego typu test, również i ten oparty jest na specyficznych reakcjach enzymatycznych. W wyniku zajścia odpowiedniej reakcji dochodzi do powstania barwnego produktu, który następnie oznaczany jest spektrofotometrycznie przy użyciu czytnika ELSA.
LDH zaliczana jest do enzymów cytozolowym co znaczy, że w warunkach fizjologicznych enzym ten nie jest uwalniany do środowiska, dopiero uszkodzenie mechaniczne błony plazmatycznej komórki bądź śmierć komórki spowodowana zadziałaniem czynników szkodliwych (np. działanie substancji chemicznych, czynników fizycznych), powoduje, że enzym uwalniany jest z komórek do środowiska [12].
Oznaczenie aktywności dehydrogenazy mleczanowej w supernatancie jest miarą toksyczności badanej substancji względem komórek w hodowli, ponieważ enzym ten uwalniany jest z komórek w wyniku ich uszkodzeń. Reakcje enzymatyczne w trakcie oznaczenia zachodzi w 2 etapach:
Etap I: dochodzi do przekształcenia mleczanu do pirogronianu. Cała reakcja katalizowana jest przez LDH uwolnioną z komórek. Enzym przenosi atomo wodoru ( H+) z mleczanu na NAD+.
Etap II: diaforeza katalizuje przeniesienie atomu wodoru (H+) z NADH/H+ na tetrazolonę, która w reakcji ulega redukcji do formazanu.
Dzięki zastosowaniu testu LDH możliwe jest w prosty sposób określić czy dana substancja powoduje uszkodzenie błony plazmatycznej komórek [12].
Zazwyczaj test LDH przeprowadza się z krwi, aczkolwiek można w tym celu użyć także próbkę moczu lub płynu mózgowo-rdzeniowego. W przypadku dorosłych krew do testu pobierana jest z żyły wewnętrznej łokcia lub z grzbietu dłoni. Stosowanie niektórych leków lub zażywanie narkotyków mogą powodować nieprawidłowości w wynikach. Kwas askorbinowy (witamina C) może wpływać na obniżenie poziomu LDH, zaś alkohol, leki znieczulające czy aspiryna mogą podnosić aktywność LDH. Podwyższony poziom LDH może wskazywać na wystąpienie wielu różnych chorób, w tym m.in. : nowotworów, zapalenie trzustki, mononukleazy zakaźnej czy niedokrwistość hemolityczną.
Wysoki poziom LDH wskazuje na uszkodzenie tkanki. Wysokie poziomy więcej niż jednego izoenzymu LDH mogą wskazywać na więcej niż jedną przyczynę uszkodzenia tkanki, zaś gdy poziom wszystkich pięciu izoenzymów LDH jest wysoki, może to świadczyć o niewydolności wielonarządowej [13].
Występowanie wyższego poziomu LDH-2 niż LDH-1 uważa się za wynik prawidłowy (normalny). Po zawale serca poziom LDH-1 wzrasta i zazwyczaj jest wyższy niż poziom LDH-2. Całkowity poziom LDH wzrośnie w ciągu 24-72 godzin po ataku serca, ze szczytem w 2-4 dni. Stężenie enzymu wraca do normalnego poziomu w ciągu 10 do 14 dni. W diagnostyce zawału serca jednak bardziej wiarygodnym i dokładnym okazał się test troponiny (białka obecnego w komórkach mięśnia sercowego). Troponina jest obecnie najbardziej cenionym biomarkerem zawału serca.
Normalny stosunek LHD-1/LDH-2 jest powszechnie uważany za wiarygodny dowód na nie występowanie zawału serca . Niski poziom LDH zazwyczaj nie stanowi problemu, w większości diagnozuje się go u osób, które zażywają duże dawki witaminy C i diagnozowany jest bardzo rzadko Ponadto, znane są dwa rodzaje mutacji, które powodują obniżenie poziomu tego enzymu: pierwszy rodzaj mutacji powoduje, że osoby z daną mutacją odczuwają zmęczenie i ból mięśni, podczas gdy drugi rodzaj mutacji u ludzi jest bezobjawowy [13].
Szybkośc reakcji enzymatycznej Tempo przebiegu danej reakcji katalizowanej przez enzym określana jest mianem szybkości reakcji, zaś szybkość działania enzymu określana jest początkową szybkością reakcji (zapisywana jako V0) tj. wartością w czasie zerowym [14]. Początkowa szybkość reakcji wyznaczana jest eksperymentalnie zanim więcej niż 10% substratu zostanie przekształconych w produkt. By dokładnie zobrazować zachodzące zjawiska powstało równanie Michaelisa-Menten (nazwane od nazwisk naukowców). Równanie to opisuje krzywą hiperboliczną. Dzięki wprowadzeniu równania określono wartość Km – zwaną stałą Michaelisa, która jest miarą stabilności kompleksu enzym-substrat (stanowiąc iloraz sumy szybkości rozkładu ES i szybkości jego powstawania) [14].
Oznaczanie aktywności enzymu wymaga określenia w preparacie szybkości początkowej w warunkach pełnego wysycenia tzn. przy takim stężeniu substratu, które będzie znacznie przekraczać wartość stałej Michaelisa dla danego enzymu [15].
Oznaczanie aktywności LDHDehydrogenaza mleczanowa katalizuje reakcję przekształcania: pirogronian + NADH ↔mleczan + NAD+. W reakcji tej substraty tj. NADH oraz pirogronian dodawane są w stężeniach wysycających. Takie postępowanie pozwala wyznaczyć szybkość maksymalną dla danej ilości enzymu. W trakcie przeprowadzania oznaczenia należy mierzyć w czasie spadek absorbancji przy długości fali równej λ= 340 nanometrów. Ta długość fali odpowiada maksimum absorbancji dla NADH. Następnie, z prostoliniowego odcinka wykresu należy wyznaczyć wartość V0 w jednostkach absorbancji na minutę, wyrażoną jako zmiana ilości substratu w jednostce czasu. Wartość tę podaje się w µM NADH min -1(U). Zazwyczaj przy obliczeniach korzysta się ze wzoru Lamberta-Beera, który wiąże absorbancję ze stężeniem substancji absorbującej [15].
Wykonanie:
Do wykonania oznaczenia aktywności enzymu (LDH) należy użyć mieszaniny reakcyjnej w skład, której wchodzi: 40 mM bufor Tris-HCl o pH= 7.5, 25 mM KCl, 6mM EGTA zapobiega interakcji z jonami wapnia (25 ml roztworu) [15], [16].
Do 2 mililitrowych kuwet należy odmierzyć po 1 ml mieszaniny reakcyjnej oraz po 20 µL NADH ( o stężeniu 10 mg ml-1), frakcję cytozolową (10 µl frakcji cytozolowej nerki lub 10 µL 5-10-krotnie rozcieńczonej 0,9% NaCl frakcji cytosolowej watroby). Do tego dodać wodę w takiej objętości, by w chwili rozpoczęcia reakcji (po dodaniu 40 µl 0,1M roztworu pirogronianu sodu) całkowita objętość przygotowanej mieszaniny wynosiła 2 ml. Całość dokładnie wymieszać po czym zmierzyć wartość absorbancji NADH przy λ=340 nm. Prawdłowy wynik powinien plasować się pomiędzy 0,600 do 0,800. Próbkę inkubować 2 minuty, po inkubacji dodać 40 µl roztworu pirogronianu sodu i natychmiast dokładnie wymieszać. Mierzyć zmiany absorbancji roztworu co 15 sekund przez okres 2 do 3 minut.
Całkowitą aktywność enzymu przedstawioną w [µmol min-1] wyznacza się z prostoliniowego odcinka krzywej progresji [15].
Autor: Lidia Koperwas
Literatura:
[1].Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W.,1995. BIOCHEMIA HARPERA, Wydanie III, Redaktor naukowy tłumaczenia Franciszek Kokot. S.913, 917-918. Wydawnictwo Lekarskie PZWL
[2]. Szutowicz A., Raszei-Szpecht A., 2009. Diagnostyka laboratoryjna. Tom I.Gdański Uniwersytet Medyczny, Zlecenie KW/224/09.Recenzent prof. dr hab.Wiesława Łysiak-Szydłowska. S. 62-63
[3]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.529-531
[4].http://biochemistry.sote.hu/uploads/obi_okt_gra_en/obi_e_tananyag_en/obi_okt_gyakorlatok_en/obi_gya_en_LDH.pdf
[5]. http://www.intmedpress.com/servefile.cfm?suid=5c25afd7-440d-4590-881c-c1d70cf6484e
[6]. http://www.healthline.com/health/lactate-dehydrogenase-test#LDHIsoenzymes
[7]. http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=5892#itabs-2d
[8]. http://analiza.ovh.org/cw/cw2.pdf
[9]. http://pchba.amu.edu.pl/cw%20Fak/cw2.pdf
[10]. Dell E.J., Detection of NADH and NADPH with the Omega’s High Speed, Full UV/Vis Absorbance Spectrometer , BMG LABTECH, Inc., Durham, USA. http://www.bmglabtech.com/application-notes/absorbance/spectrometer-nadh-nadph-170.cfm , http://www.bmglabtech.com/db_assets/applications/downloads/applications/170-nadh-nadph.pdf
[11]. Ying W., 2008. NAD+/NADH and NADP+/NADPH in cellular functions and cell death: regulation and biological consequences. Antioxid Redox Signal. 2008 Feb;10(2):179-206. Department of Neurology, University of California at San Francisco, San Francisco, California 94121, USA.
[12]. http://www.uj.edu.pl/documents/2387936/4117775/cw8.pdf
[13].http://www.healthline.com/health/lactate-dehydrogenase-test#HighLDHLevels
[14]. Hames D.B, Hooper N.M, 2007. Biochemia-krótkie wykłady. Wydanie II, Wydawnictwo Naukowe PAN 2007, s.96-100
[15]. Bryła J., Drożak J., Garstka M., Jagielski A., Jarzyna R., Kiersztan A., Kaniuga Z., Winiarska K., 2011. Enzymologia I, s. 20-25. Materiały do ćwiczeń dla studentów kierunku Biotechnologia Wydziału Biologii UW. Skrypt przygotowany przez pracowników Zakładu Regulacji Metabolizmu,Instytut Biochemii Wydziału biologii. http://www.biol.uw.edu.pl/zrm/Skrypty/2011EnzymI.pdf
[16]. http://www.wiener-lab.com.ar/wiener/catalogo/archivos/7702_mg_color_aa_pl.pdf
[17]. BIELLMANN J.F., SAMAMA J.P., BRANDEN C.I., EKLUND H., 1979. X-Ray Studies of the Binding of Cibacron Blue F3GA to Liver Alcohol Dehydrogenase. Eur.
J. Biochem. 102, 107-110 (1979). http://onlinelibrary.wiley.com/doi/10.1111/j.1432-1033.1979.tb06268.x/pdf
[18]. Angal S., Dean P.D.G., 1977. The Effect of Matrix on the Binding of Albumin to Immobilized Cibacron Blue. Biochem J.(1997) 167, 301-303, http://www.docstoc.com/docs/28020884/Immobilized-Cibacron-Blue
[19]. http://www.biofizyka.p.lodz.pl/ch8.pdf
[20]. Drent M., Cobben N.A.M., Herderson R.F., Wouters E.F.M., van Dieijen-Visser M., 1996. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J, 1996, 9, 1736–1742 DOI: 10.1183/09031936.96.09081736. http://erj.ersjournals.com/content/9/8/1736.full.pdf
[21].http://www.laboklin.de/pdf/pl/wetinfo/aktualnosci/2012_01_analizy_wysiekow_oplucnowych.pdf
[22]. Sigma- Aldrich, In Vitro Toxicology Assay Kit, Lactic Dehydrogenase based. Technical Bulletyn, http://www.sigmaaldrich.com/etc/medialib/docs/Sigma/Bulletin/tox7bul.Par.0001.File.tmp/tox7bul.pdf
[23]. http://www.e-biotechnologia.pl/Artykuly/glikoliza/
[24]. Al-Saadoon E.A., MRCP (Pead)* Al-Naama L.M, Hassan J.K., 2003. Serum Lactate Dehydrogenase (LDH) Activity in Children with Malignant Diseases. Bahrain Medical Bulletin, Vol.25, No. 2, June 2003, http://www.bahrainmedicalbulletin.com/june_2003/Serum.pdf
[25]. Baba Ch., Yanagida K., Kanzaki T., Baba M., 2005. Colorimetric lactate dehydrogenase (LDH) assay for evaluation of antiviral activity against bovine viral diarrhoea virus (BVDV) in vitro. Antiviral Chemistry & Chemotherapy 16:33–39. ©2005 International Medical Press
https://laboratoria.net/artykul/19622.html


 Dehydrogenaza mleczanowa (określana w skrócie jako LDH) jest enzymem, który katalizuje konwersję mleczanu do pirogronianu (w obecności związku NAD+) i odwrotnie (pirogronian do mleczanu w obecności NADH). Jest to enzym występujący we wszystkich komórkach oraz płynach ustrojowych [1].
Dehydrogenaza mleczanowa (określana w skrócie jako LDH) jest enzymem, który katalizuje konwersję mleczanu do pirogronianu (w obecności związku NAD+) i odwrotnie (pirogronian do mleczanu w obecności NADH). Jest to enzym występujący we wszystkich komórkach oraz płynach ustrojowych [1]. 
Recenzje