

|
Zamknij X
|
Diagnostyka mikrobiologiczna opiera się na sprawdzaniu właściwości biochemicznych drobnoustrojów. Badania z udziałem drobnoustrojów prowadzone są na specjalnych podłożach diagnostycznych lub podłożach wybiórczo-diagnostycznych. Podłoża te oprócz substancji odżywczych zawierają również związki, które hamują wzrost innych drobnoustrojów. W tego typu badaniach najczęściej wykorzystywane są tzw. reakcje kataboliczne (tj. zdolność do rozkładu substratów za pomocą enzymów komórkowych). Produkty zachodzących reakcji wykrywane są za pomocą specjalnych wskaźników, odczynników lub testów [1]. Diagnostyka mikrobiologiczna ma bardzo dużą przydatność kliniczną w zapobieganiu i leczeniu chorób zakaźnych. Warunkiem koniecznym do uzyskania pożądanego efektu klinicznego jest odpowiednia współpraca pomiędzy laboratorium dokonującym analizy mikrobiologicznej, jak i lekarzem prowadzącym badanie [2].
Poszczególne grupy drobnoustrojów wykazują szereg właściwości biochemicznych, które determinowane są różnorodnymi enzymami przez nie wytwarzanymi. Różnice we właściwościach biochemicznych pozwalają na podział drobnoustrojów według rodzaju czy gatunku. Ma to szerokie zastosowanie w diagnostyce mikrobiologicznej, w której bada się m.in.:
Właściwości biochemiczne sprawdzane są z wykorzystaniem tzw. szeregów biochemicznych (określanych również mianem rzędów biochemicznych). Szeregi biochemiczne to zestawy podłoży, na które wysiewane są badane drobnoustroje. Następnie podłoża poddaje się inkubacji, po upływie której wykonywane są próby identyfikacyjne, polegające na wykrywaniu produktów odpowiednich reakcji chemicznych katalizowanych przez enzymy drobnoustrojów. Ponadto określane zostają zmiany pH środowiska wzrostu hodowli za pomocą odpowiednich indykatorów (wskaźników) [1].
Głównym cele diagnostyki mikrobiologicznej jest zidentyfikowanie czynnika zakażenia, dzięki czemu możliwe jest wskazanie drobnoustroju odpowiedzialnego za infekcję. Jest to podstawą wyboru sposobu leczenia oraz postępowania zmierzającego do ograniczenia rozprzestrzeniania się zakażenia oraz oceny ryzyka. Cały proces odbywa się etapami, w które zaangażowane jest zarówno laboratorium diagnostyczne, lekarz jak i pacjent [2].
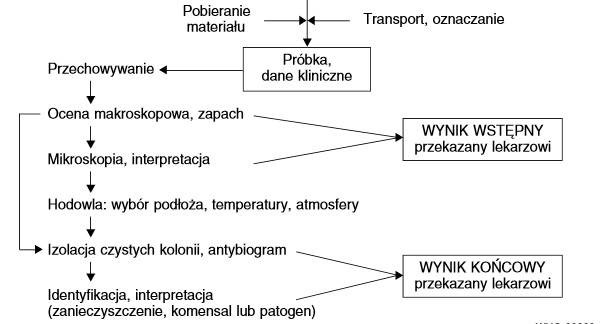
Zdjęcie: Etapy diagnostyki mikrobiologicznej zakażenia [2].
Na metabolizm drobnoustrojów składa się szereg przemian chemicznych. Dzięki nim komórka rośnie i rozmnaża się. Wszystkie zachodzące reakcje chemiczne katalizowane są przez enzymy, a do ich przeprowadzenia niezbędna jest energia oraz określone związki chemiczne, które stanowią tzw. substancje odżywcze [3].
Na metabolizm składają się następujące procesy:
Drobnoustroje czerpią energię z rozkładu cukrów prostych i złożonych w warunkach tlenowych i beztlenowych. W badaniach właściwości glikolitycznych wykorzystywane są węglowodany i ich pochodne oraz alkohole wielowodorotlenowe (pentozy, heksozy, disacharydy, trisacharydy, polisacharydy, glikozydy) [1].
Woda peptonowa ze wskaźnikiem Andrade jest podstawową pożywką, do której dodawać można różne węglowodany w celu śledzenia rekacji fermentacji przez drobnoustroje (zwłaszcza z rodziny Enterobacteriaceae) [5]. Wskaźnik Andrade jest to roztwór kwaśnej fuksyny, która w trakcie miareczkowania wodorotlenkiem sodu zmienia barwę z różowej na żółtą lub z żółtego na różowy gdy spada wartość pH [4].
Badanie zdolności drobnoustrojów do rozkładania węglowodanów
Badanie wykonywane jest najczęściej na tzw. małych szeregach cukrowych, które w swoim składzie zawierają kilka cukrów, w tym: laktozę, sacharozę, maltozę i mannitol. Cukry te dodawane są w 1% stężeniu do podłoża tzw. wody peptonowej, zawierającej wskaźnik Andrade (kwaśna fuksyna) lub błękit bromotymolowy.
Wykonanie:
Do probówek zawierających podłoże i cukry wkłada się dnem do góry małe probóweczki (tzw. rurki Durhama). Służą one do wykrywania gazu wydzielanego podczas wzrostu drobnoustrojów i rozkładu przez nie substratów węglowodanowych. Wydzielany gaz zbiera się w rurce, w której widoczny jest w postaci pęcherzyka). Powstające w trakcie rozkładu cukrów kwasy organiczne prowadzą do zmiany pH środowiska, co z kolei powoduje zmianę barwy indykatora (z koloru słomkowego na różowy- w przypadku zastosowania wskaźnika Andrade lub z koloru niebieskiego na żółty jeżeli zastosowano błękit bromotymolowy). W przypadku słabego wzrostu drobnoustrojów na wodzie peptonowej, możliwe jest dodanie zinaktywowanej (przez podgrzanie) surowicy końskiej (podłoże Robesona dla maczugowców) [1].
Błękit bromotymolowy (C27H28O5Br2S)
Błękit bromotymolowy stosowany jest jako wskaźnik w analizie chemicznej. Błękit bromotymolowy powinien mieć postać drobnokrystalicznego proszku o zabierwieniu od różowego z odcieniem fioletowym do fioletowego. Powinien być nierozpuszczalny w wodzie i dobrze rozpuszczalny w alkoholu etylowym oraz w rozcieńczonych roztworach wodorotlenków potasowców i wodnym roztworze amoniaku [7].
Rozkład cukrów na podłożu VL
Podłoże VL wykorzystywane jest w badaniach rozkładu węglowodanów przez bakterie beztlenowe. W jego skład wchodzi wyciąg mięsny, ekstrakt drożdżowy, pepton, badany cukier oraz chlorowodorek cysteiny. Chlorowodorek dodawany jest w celu obniżenia potencjału oksydo-redukcyjnego, co umożliwia wzrost bakterii beztlenowych. Po inkubacji bakterii, do hodowli dodawany jest wskaźnik np. roztwór błękitu bromotymolowego lub purpury bromokrezolowej. Jeżeliw próbce pojawi sie żółte zabarwienie, będzie ono wskazywac na zakwaszenie środowiska w następstwie rozkładu badanego cukru [1].
Przygotowanie podłoża VL
Wymienione składniki: wyciąg mięsny (100 ml), pepton (10 g), ekstrakt drożdży (5 g), NaCl (5 g), chlorowodorek cysteiny (0.4 g) oraz agar (20 g) należy rozpuścić w wyciągu mięsnym. Otrzymany roztwór doprowadzić do pH mieszczącego się w granicach: 7.2 - 7.4, a następnie zagotować. Całość przesączyć przez bibułę i rozlać do butelek. Sterylizować w temperaturze 117°C przez 20 minut [6].
Rozkład cukrów na podłożach stałych (podłoże Endo i płytka Chapmana)
Rozkład laktozy na podłożu Endo
Płytka Endo stanowi podłoże różnicujące dla bakterii z grupy coli. Wykorzytsywana jest w badaniach bakteriologicznych próbek wody lub ścieków, a także produktów spożywczych zawierających w swoim składzie laktozę, siarczyn sodowy oraz fuksynę zasadową. W trakcie przygotowywania podłoża siarczyn sodowy redukuje fuksynę zasadową, która przechodzi w bezbarwną leukozasadę. Drobnoustroje, które są zdolne do rozkładu laktozy (np. E.coli) rosną na podłożu Endo w postaci okrągłych, gładkich kolonii, wykazujących metaliczny połysk (o charakterystycznym ciemno-czerwonym zabarwieniu). Escherichia coli ma zdolność rozkładu laktozy z wytworzeniem aldehydu octowego. Powstały aldehyd octowy w reakcji z obecną w podłożu leukozasadą tworzy barwny kompleks [1], [8].
Płytka Chapmana
Na podłożu tym bardzo dobrze rosną drobnoustroje, które tolerują 8% stężenie NaCl oraz wykorzystujące mannitol jako źródło węgla. Bakteria S.aureus w warunkach tlenowych i względnie beztlenowych wyrasta w postaci kolonii otoczonych żółtą strefą, która powstaje w wyniku rozkładu mannitolu i zakwaszeniu środowiska. Z kolei bakteria S.epidermidis nie rozkłada mannitolu i rośnie w postaci białych kolonii nie powodując zmiany barwy tego podłoża [8]. W skład podłoża Chapmana wchodzą: wyciąg mięsny (1000 ml), pepton (10 g), NaCl (75 g), agar (15 g), mannitol (10 g) oraz czerwień fenolowa (roztwór 0.2% w 50% alkoholu etylowym (12.5 ml)) [6]. Mieszanina peptonu i wyciągu mięsnego dostarcza azotu, witamin, minerałów i aminokwasów niezbędnych do wzrostu bakterii. Mannitol jest źródłem energii, zaś chlorek sodu dostarcza elektrolitów niezbędnych dla transportu i równowagi osmotycznej. Agar bakteriologiczny stosowany jest w pożywce jako środek zestalający [10].
Podłoże Chapmana ma właściwości wybiórczo-różnicujące, przeznaczone jest do izolacji gronkowców. Duże stężenia NaCl (7,5%) hamuje wzrost flory towarzyszącej,a zwłaszcza pałeczek Gram-ujemnych. Zachodzący rozkład zawartego w podłożu mannitolu pozwala na wstępne różnicowanie gatunków w obrębie rodzaju Staphylococcus, zaś dodatek do podłoża wskaźnika (czerwieni fenolowej) sprawia, że bakterie rozkładające mannitol rozrastają się w postaci żółtych kolonii [6]. Przy wartości pH poniżej 6,9 podłoże przybiera żółty kolor, w neutralnych wartościach pH (6,9 do 8,4) ma kolor czerwony, natomiast przy pH powyżej 8,4 –różowy [11].
Zdolność bakterii do wykorzystywania skrobi
Badanie przeprowadzane jest na płytce agarowej w postaci tzw. posiewu pasmowego. Drobnoustroje wytwarzające enzymy amylolityczne mają zdolność degradowania skrobi do dekstryn, maltozy i glukozy. Obecność wydzielonych substancji sprawdza się w reakcji z płynem Lugola (tj. roztwór jodu w jodku potasu). Amylozy i amylopektyny będące składnikami skrobi ulegają reakcji z jodem, w wyniku czego pojawia się odpowiednio niebieskie i fioletowo-czerwone zabarwienie [1].
Próba na podłożu Hugh-Leifsona (H-L)
Metoda pozwala na określenie sposobu rozkładu cukrów przez drobnoustroje: czy jest to rozkład na drodze fermentacji czy utleniania.
Wykonanie: badany szczep bakteryjny należy wysiać do dwóch probówek zawierających przygotowane podłoże H-L. Jedną z probówek zakrywa się płynną parafiną. Bakterie, które nie są zdolne do rozkładu cukru nie zmieniają barwy podłoża. Bakterie wykorzystujące cukry w warunkach tlenowych zmieniają barwę podłoża w probówce nie przykrytej warstwą parafiny, zaś te fermentujące cukier powodują zmianę zabarwienia pożywki w obu probówkach. W skład podłoża H-L wchodzi wskaźnik (błękit bromotymolowy), który w warunkach niskiego pH wytworzonego na skutek produkcji kwaśnych produktów rozkładu cukru, zmienia barwę podłoża z koloru zielonego na żółty [1].
Określanie zdolności bakterii do fermentacji laktozy lub glukozy (podłoże Kliglera).
W pierwszych godzinach hodowli bakteryjnej na podłożu Kliglera drobnoustroje, które wykorzystują glukozę zakwaszają podłoże. Jeżeli mają również zdolność fermentowania laktozy, w dalszym etapie dochodzi do zmiany barwy podłoża na żółtą. Jeżeli zaś bakterie nie mogą korzystać z laktozy dochodzi do rozkładu aminokwasów zawartych w peptonie, w wyniku czego bakterie alkalizują środowisko, co objawia się zmianą barwy podłoża na czerwoną. Wydzielany w trakcie reakcji toksyczny siarkowodór reaguje z jonami Fe2+ dając siarczek żelaza, który powoduje zaczernienie podłoża hodowlanego (zdjęcie poniżej) [1].

Zdjęcie: Zmiany zabarwienia podłoża Kliglera [9].
Wykonanie: igłą inokulacyjną należy pobrać niewielką ilość hodowli poszczególnych szczepów bakterii (np. E.coli, S.aureus) i wykonać posiew kłuty i powierzchniowy wcześniej przygotowanego podłoża Kliglera. Zaszczepione probówki inkubować przez 24 godziny w temperaturze 37°C. Po upływie czasu inkubacji należy ocenić wzrost hodowli poszczególnych szczepów bakterii w probówkach biorąc pod uwagę zachodzące zmiany:
Próba Voges-Proskauera (VP) i Metyl Red (MR)
Rozróżnienie głównych grup bakterii Enterobacteriaceaemożna dokonać na podstawie ich właściwości biochemicznych i reakcjach enzymatycznych w obecności specyficznych substratów [12].
Próby VP i MR wykorzystywane są w identyfikacji bakterii, które rozkładają glukozę z wytworzeniem wielu produktów pośrednich (takich jak: kwasy organiczne, gazy czy alkohol etylowy). Obydwa testy oparte są na wykrywaniu specyficznych produktów rozpadu węglowodanów [13].
Próby MR i V-P przeprowadzane są na tzw. podłożu Clarka, w skład którego wchodzi glukoza i pepton [1]. Metoda pozwala na oznaczanie typu fermentacji (odczyn MR) i wytwarzania acetoiny (odczyn Voges Proskauera). Substratem reakcji jest glukoza, która jest fermentowana przez pałeczki z rodziny Enterobacteriaceae z wytworzeniem kwaśnych produktów - tzw. fermentacja kwaśna. Wskutek nagromadzenia się produktów kwaśnych w pożywce, dochodzi do obniżenia pH. Dodana do pożywki czerwień metylowa zmienia barwę z żółtej na czerwoną (jest to dodatni odczyn MR). Inne szczepy fermentują glukozę z wytworzeniem produktów obojętnych (np. glikol butylenowy) i wówczas dodana do hodowli czerwień metylowa przybiera zabarwienie żółte (ujemny odczyn MR) [14].
Wykonanie oznaczenia:
Hodowla bakterii prowadzona jest przez 72 godziny, po której do probówek dodawany jest roztwór czerwieni metylowej. Pojawienie się czerwonego zabarwienia świadczy o dodatniej próbie MR (obecność wysokiego stężenia kwasów organicznych- fermentacja charakterystyczna dla E.coli). Inkubacja w przypadku próby V-P prowadzona jest 48-godzin, w trakcie której do probówek dodawany jest alkoholowy roztwór α-naftolu, stężony roztwór wodorotlenku potasu oraz roztwór kreatyny. Pojawienie się czerwonego zabarwienia w górnej części hodowli świadczy o obecności w próbce acetoiny, która w środowisku zasadowym w obecności kreatyn i przy dostępie tlenu, ulega utlenieniu do diacetylu. Diacetyl z kolei w obecności α-naftolu ulega reakcji z guaniną zawartą w peptonie dając czerwone zabarwienie pożywki, co świadczy o dodatniej próbie V-P [1].
Podłoże MacConkeya – izolacja pałeczek Gram-ujemnych z materiałów klinicznych
Agar został opracowany na przełomie XX wieku przez Alfreda Theodore MacConkey’a. Celem prac było znalezienie medium, które pozwoli na selektywna identyfikację wzrostu bakterii Gram-ujemnych oraz na jednoczesne hamowanie wzrostu bakterii Gram-dodatnich. Dr MacConkey jako pierwszy opracował pożywkę zawierającą w składzie glikocholan, laktozę i lakmus, którą inkubowało się w 22°C (1900r.). Formuła ta została szybko zmieniona przez zastąpienie glikocholanu taurocholanem i przez podniesienie temp. inkubacji do 42°C (MacConkey, 1901). Receptura została ponownie zmieniona, po sugestii zastosowania w pożywce wskaźnika (Grunbaum and Hume, 1902). Końcowa formuła pożywki została zaprojektowana w celu wspierania wzrostu bakterii Shigella [15].
Wykonanie:
W 1000 ml wody destylowanej rozpuścić kolejno: pepton (20 g), chlorek sodu (20 g), dezoksycholan sodu (0,9 g) oraz agar (17 g). Roztwór doprowadzić do pH mieszczącego się w granicy od 7.3 do 7.4, po czym zagotować. Całość przesączyć i dodać barwniki tj.: 0,1% roztwór wodny czerwieni obojętnej (3 ml) oraz 0,1% roztwór wodny fioletu krystalicznego (1 ml). Roztwór poddać sterylizacji w temperaturze 117°C przez 20 minut [6].
Zaawartość w podłożu soli żółciowych oraz fioletu krystalicznego wpływa na hamowanie wzrostu bakterii Gram-dodatnich. Z kolei obecność laktozy pozwala na różnicowanie pałeczek laktozododatnich z tymi, które nie rozkładają laktozy. W obecności zawartego w podłożu wskaźnika (czerwieni obojętnej), wskutek zależnego od rozkładu laktozy zakwaszenia środowiska, kolonie bakterii rozkładających laktozę barwią się na kolor różowy. Co więcej, kolonie bakterii, które aktywnie rozkładają laktozę są dodatkowo otoczone różową strefą wytrąconych soli kwasów żółciowych. Pałeczki laktozo-ujemne tworzą bezbarwne kolonie [6].
Salmonella Shigella Agar jest modyfikacją podłoża Desoxycholate-Citrate Agar, opisanego przez Leifsona. Zaliczane jest do podłoży umiarkowanie selektywnych, hamujących wzrost drobnoustrojów Gram-dodatnich i Enterobacteriaceae (innych niż Salmonella i Shigella) ze względu na zawartość w swoim składzie soli żółciowych, zieleni brylantowej i cytrynianów [16]. Zawarta w podłożu laktoza pozwala odróżnić bakterie laktozododatnie. Dodawany do podłoża tiosiarczan sodowy jest zaś źródłem siarki gwarantującym wykrycie szczepów wytwarzających siarkowodór (H2S). Siarkowodór w reakcji z jonami żelaza daje czarny strąt zabarwiający środek kolonii. Pałeczki z rodzaju Shigella na podłożu „SS” rosną w postaci bezbarwnych kolonii, zaś szczepy Salmonella (wytwarzające siarkowodór) namnażają się w postaci bezbarwnych kolonii z zaczernieniem środka [6].
Przygotowanie podłoża SS (Salmonella Shigella Agar)
W 1000 ml wyciągu mięsnego należy rozpuścić 10 g peptonu, chlorek sodu (5 g), żółć (8,5 g), tiosiarczan sodu (8.5 g), cytrynian sodu (7,2 g), dezoksycholan sodu (2 g) oraz agar (15 g).Roztwór doprowadzić do pH mieszczącego się w granicach do 7.3-7.4. Całość zagotować, po czym dodać 1 g cytrynianu żelazowego rozpuszczonego w 10 ml wody destylowanej, laktozę (10 g) i barwniki: 1% wodny roztwór czerwieni obojętnej (2,5 ml) oraz 0,05% wodny roztwór zieleni brylantowej (0,66 ml). Otrzymaną pożywkę rozlać na płytki (nie sterylizować) [6].
Autor: Lidia Koperwas
Literatura:
[1]. Różalski A., 2003. Ćwiczenia z mikrobiologii ogólnej. Skrypt dla studentów biologii, wydanie III. Część I- teoretyczna.Wydawnictwo Uniwersytetu Łódzkiego, s. 162-168
[2]. Podstawowe procedury laboratoryjne w bakteriologii klinicznej. Wydane przez World Health Organization w 2003 r. pod tytułem ,,Basic Laboratory Procedures in Clinical Bacteriology’’, wydanie 2. http://apps.who.int/medicinedocs/documents/s16536o/s16536o.pdf
[3]. http://www.uwm.edu.pl/wnz/v3/fck_files/MZ_TZrokII_cw6_7_8.pdf
[4]. MacFaddin J. F., 1985, Media for Isolation-Cultivation-Identification-Maintenance of Medical Bacteria, Vol. I, Williams and Wilkins, Baltimore.
[5]. Andrade Pepton Water, http://himedialabs.com/TD/M885.pdf
[6]. http://www.pum.edu.pl/__data/assets/file/0003/19758/Anal.mikrob.Konspekt2-Pozywki.pdf
[7]. http://bc.pollub.pl/Content/4223/BN_88_6197_05.pdf
[8].http://mikrowir.sum.edu.pl/uploaded/w.%207-%20Instrukcja%20-metabolizm%20drobnoustroj%C3%B3w-w%C5%82a%C5%9Bciwo%C5%9Bci%20glikolityczne.pdf
[9]. http://www.ic.ucsc.edu/~saltikov/bio119l/exercises/characterization/12_Kligler_Iron_Agar
[10]. MANNITOL SALT AGAR(MSA)(Chapman Medium), Uptima, http://www.interchim.fr/ft/J/JH992A.pdf
[12]. http://amrita.vlab.co.in/?sub=3&brch=76&sim=215&cnt=1
[13]. MR-VP Medium (Glucose Phosphate Broth), Technical Data, http://himedialabs.com/TD/M070.pdf
[14]. http://www.biocorp.pl/product/pokaz/id/2264/mrvp-medium-.html
[15]. www.microbelibrary.org/component/resource/laboratory-test/2855-macconkey-agar-plates-protocols
[16]. http://www.bd.com/resource.aspx?IDX=9039
25 maja 2018 roku zacznie obowiązywać Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2016/679 z dnia 27 kwietnia 2016 r (RODO). Potrzebujemy Twojej zgody na przetwarzanie Twoich danych osobowych przechowywanych w plikach cookies. Poniżej znajdziesz pełny zakres informacji na ten temat.
Zgadzam się na przechowywanie na urządzeniu, z którego korzystam tzw. plików cookies oraz na przetwarzanie moich danych osobowych pozostawianych w czasie korzystania przeze mnie ze strony internetowej Laboratoria.net w celach marketingowych, w tym na profilowanie i w celach analitycznych.
Administratorami Twoich danych będziemy my: Portal Laboratoria.net z siedzibą w Krakowie (Grupa INTS ul. Czerwone Maki 55/25 30-392 Kraków).
Chodzi o dane osobowe, które są zbierane w ramach korzystania przez Ciebie z naszych usług w tym zapisywanych w plikach cookies.
Przetwarzamy te dane w celach opisanych w polityce prywatności, między innymi aby:
dopasować treści stron i ich tematykę, w tym tematykę ukazujących się tam materiałów do Twoich zainteresowań,
dokonywać pomiarów, które pozwalają nam udoskonalać nasze usługi i sprawić, że będą maksymalnie odpowiadać Twoim potrzebom,
pokazywać Ci reklamy dopasowane do Twoich potrzeb i zainteresowań.
Zgodnie z obowiązującym prawem Twoje dane możemy przekazywać podmiotom przetwarzającym je na nasze zlecenie, np. agencjom marketingowym, podwykonawcom naszych usług oraz podmiotom uprawnionym do uzyskania danych na podstawie obowiązującego prawa np. sądom lub organom ścigania – oczywiście tylko gdy wystąpią z żądaniem w oparciu o stosowną podstawę prawną.
Masz między innymi prawo do żądania dostępu do danych, sprostowania, usunięcia lub ograniczenia ich przetwarzania. Możesz także wycofać zgodę na przetwarzanie danych osobowych, zgłosić sprzeciw oraz skorzystać z innych praw.
Każde przetwarzanie Twoich danych musi być oparte na właściwej, zgodnej z obowiązującymi przepisami, podstawie prawnej. Podstawą prawną przetwarzania Twoich danych w celu świadczenia usług, w tym dopasowywania ich do Twoich zainteresowań, analizowania ich i udoskonalania oraz zapewniania ich bezpieczeństwa jest niezbędność do wykonania umów o ich świadczenie (tymi umowami są zazwyczaj regulaminy lub podobne dokumenty dostępne w usługach, z których korzystasz). Taką podstawą prawną dla pomiarów statystycznych i marketingu własnego administratorów jest tzw. uzasadniony interes administratora. Przetwarzanie Twoich danych w celach marketingowych podmiotów trzecich będzie odbywać się na podstawie Twojej dobrowolnej zgody.
Dlatego też proszę zaznacz przycisk "zgadzam się" jeżeli zgadzasz się na przetwarzanie Twoich danych osobowych zbieranych w ramach korzystania przez ze mnie z portalu *Laboratoria.net, udostępnianych zarówno w wersji "desktop", jak i "mobile", w tym także zbieranych w tzw. plikach cookies. Wyrażenie zgody jest dobrowolne i możesz ją w dowolnym momencie wycofać.
Więcej w naszej POLITYCE PRYWATNOŚCI
Recenzje