WPŁYW STATUSU SOCJALNGO SAMCÓW NA JAKOŚĆ NASIENIA (W OPARCIU O BADANIA ŻYWOTNOŚCI I RUCHLIWOŚCI GAMET MĘSKICH SAMCÓW NORNICY RUDEJ (MYODES GLAREOLUS)
1. WSTĘP
Wykazano niezwykłe podobieństwo w przebiegu spermatogenezy, budowie oraz parametrach oceniających jakość nasienia między plemnikami ludzkimi, a plemnikami nornicy rudej Myodes glareolus (Marchlewska-Koj A., Kołodziej B., Filipowska A., 1989). Z tego względu badania prowadzone na komórkach rozrodczych męskich pochodzących od samców nornicy rudej są tak ważne w próbie diagnostyki bezpłodności mężczyzn czy tez selekcji spermy do banków nasienia.
1.1. PARAMETRY OCENIAJĄCE JAKOSĆ NASIENIA.
Doskonałymi parametrami oceniającymi jakość nasienia są:
1) zdolność do ruchu,
2) prawidłowa budowa błony cytoplazmatycznej witki plemnika,
3) procent plemników żywych
Przyjmuje się, że u samców o wyższej pozycji socjalnej jest więcej i bardziej dojrzałych plemników to większa jest też ich szansa w dotarciu do komórki jajowej i jej zapłodnieniu. Można zatem wnioskować, że samica wybierając na partnera seksualnego samca dominanta otrzymuje lepsze gamety, co w konsekwencji zwiększa szansę na płodną kopulację.
1.2. SPERMATOGENEZA
Spermatogeneza jest to proces powstawania plemników, który zachodzi
w kanalikach nasiennych jąder. Składa się z dwóch procesów: spermatocytogenezy
i spermiogenezy. Pierwotne komórki rozrodcze (spermatogonia) dzielą się mitotycznie, stanowiąc źródło komórek, z których wykształcą się plemniki. Podziały te są synchroniczne dzięki połączeniu spermatogoniów mostkami cytoplazmatycznymi. Przesuwając się w kierunku światła kanalika, spermatogonia wzrastają i przekształcają się w spermatocyty I rzędu. Spermatocyty I rzędu przystępują do podziału mejotycznego. Po pierwszym podziale mejotycznym z jednego spermatocytu I rzędu powstają dwa spermatocyty II rzędu z haploidalną liczbą chromosomów. Komórki te od razu przystępują do II podziału mejotycznego. W jego wyniku powstają cztery spermatydy haploidalne (1n), które następnie przekształcają się w plemnik. Tak więc w wyniku podziału mejotycznego powstają cztery haploidalne plemniki. Na tym kończy się proces spermatocytogenezy ( Kurpisz, 1998).
Spermiogeneza czyli przekształcenie spermatydy w plemnik, przebiega w następujących etapach:
• wytworzenie akrosomu z materiału aparatu Golgiego, który zajmuje ponad połowę powierzchni jądra plemnika
• kondensacja i przekształcenie jądra plemnika
• wytworzenie szyjki, wstawki z licznymi mitochondriami oraz witki
• utrata większości cytoplazmy.
Wraz z zakończeniem spermiogenezy usuwana jest większość zbędnej cytoplazmy. Masa cytoplazmy zawierająca dużą liczbę rybosomów, kropli tłuszczu, ulegających degeneracji mitochondriów i błon aparatu Golgiego tworzy tzw. ciałko resztkowe Regauda. Jest ono albo uwalniane do światła kanalika nasiennego, albo fagocytowane przez komórki Sertoliego. Jednak niewielka część cytoplazmy tzw. kropla cytoplazmatyczna, pozostaje przyczepiona do dojrzałej spermatydy wokół początkowej części wici. Znika ona dopiero w czasie ostatecznego dojrzewania plemników w najądrzu (Austin i Short, 1978). Funkcja oczyszczająca (z masy „resztkowej”) przypisywana jest komórkom podporowym Sertoliego o ogromnych zdolnościach degradacji i fagocytozy (Kurpisz, 1998).
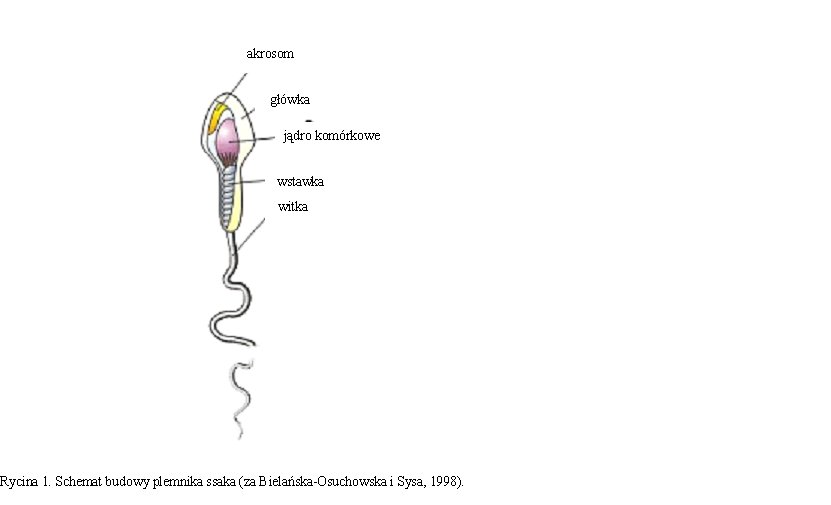
1.3. BUDOWA PLEMNIKA SSAKA
W plemnikach ssaków wyróżnia się główkę z akrosomem, wstawkę
i witkę (Rycina 1). W główce plemnika tkwi jądro komórkowe o bardzo zagęszczonej chromatynie, przechodzącą w okrężny fałd zwany otoczką jądrową. Przednią część główki stanowi akrosom w formie czapeczki nałożonej na jądro komórkowe, przylegającej do otoczki jądrowej. Za główką znajduje się wstawka, gdzie znajdują się liczne mitochondria. Plemnik zaopatrzony jest również w witkę, środkiem której biegnie włókno osiowe zbudowane z dwóch mikrotubul centralnych i otaczających je 9 mikrotubul podwójnych. Witka odpowiada za ruch plemnika, podobnie jak mitochondria obecne we wstawce, które produkują energię niezbędną do ruchu plemnika (Bielańska-Osuchowska i Sysa, 1998).
2. CHARAKTERYSTYKA GATUNKU
Nornica ruda (Myodes glareolus) (dawna nazwa gatunku: Clethrionomys glareolus, Schreber 1780) jest niewielkim gryzoniem z rodziny chomikowatych (Cricetidae) (Pavlinov, 2006). Zamieszkuje lasy liściaste i mieszane prawie całej Europy oraz lasy iglaste a zwłaszcza świerkowe, występuje również w Azji Środkowej i Ameryce Północnej. Ponadto gryzonie
te można spotkać w ogrodach, parkach, zaroślach śródpolnych i nadwodnych, unikają terenów suchych. Nornica ruda prowadzi zmierzchowo-nocny tryb życia, ale również za dnia wychodzi w poszukiwaniu pokarmu. Odżywia się pokarmem mieszanym, głównie nadziemnymi częściami roślin zielonych, owocami, nasionami, pąkami drzew oraz bezkręgowcami (Pucek, 1983; Raczyński, 1983).
W naturalnych warunkach żyje do dwóch lat i podobnie jak inne Cricetidae rozmnaża się od marca do października. Ciąża trwa około 22 dni, a samica w ciągu roku wydaje 3-4 mioty. W miocie rodzi się zwykle 4-5 młodych, które są nagie i ślepe. Dojrzałość płciową samice mogą osiągnąć przed upływem jednego miesiąca życia (Bujalska, 1990a), natomiast samce
w wieku dwóch miesięcy (Buchalczyk, 1970).
Struktura socjalna populacji nornicy rudej zmienia się wraz z porą roku. Podczas zimy nornica ruda tworzy zamknięte rodzinne grupy, które składają się z 2-4 samic
z młodymi z ostatniego miotu i z jednego lub dwóch samców (Ylönen i Mappes, 1995; Ylönen i wsp., 1995). Wczesną wiosną grupy zwierząt, które przezimowały rozpadają się, dorosłe samice stają się terytorialne. Podczas okresu rozrodczego areały osobnicze samic są częściowo pokrywane przez areały kilku dorosłych samców (Bujalska 1973, 1990b).
Zgodnie z teorią doboru płciowego samice u wielu gatunków ssaków powinny być płcią bardziej dyskryminującą, ponieważ one więcej inwestują w produkcję komórek jajowych
i opiekę nad potomstwem (Trivers, 1972). Wybór samicy może następować
na drodze dwóch mechanizmów: 1) niektóre samce swoim zachowaniem prowokują wybór samicy; 2) niektóre samice mogą preferować samca o szczególnym fenotypie.
Samce mogą się różnić zgodnie z ich pozycją socjalną w populacji a zadaniem samicy jest znalezienie i skojarzenie się z samcem o najwyższej hierarchii socjalnej (O'Donald, 1983).
Nornica ruda jest gatunkiem poligynicznym, samce konkurują ze sobą aby zdobyć możliwie najwięcej partnerek do kojarzenia (Gipps, 1985) a samice na partnera seksualnego wybierają samca o wyższej pozycji socjalnej kierując się substancjami zapachowymi (Hoffmeyer, 1982; Horne i Ylönen, 1996; Kruczek, 1997; Kruczek i Pochroń, 1997). Produkcja tych substancji zależy od poziomu krążącego we krwi testosteronu (Kruczek, 1994). Hormon ten kontroluje również rozwój gruczołów dodatkowych, które są zaangażowane
w wydzielanie substancji chemicznych. Wykazano, iż gruczoły te są bardziej rozwinięte
u dominantów niż u subordynantów prawdopodobnie dlatego, że mają wyższy poziom krążącego we krwi testosteronu. W konsekwencji samice Myodes glareolus są w stanie po zapachu rozróżnić pomiędzy samcem dojrzałym a niedojrzałym, aktywnym hormonalnie
a nieaktywnym, rozpoznają również pozycję socjalną samca (Kruczek, 1998). Można więc wnioskować, że działają tu oba wyżej wymienione mechanizmy – samce informują o swoim statusie socjalnym a samice dokonują wyboru samca o określonym fenotypie zapachowym. Uważa się , że samce o wyższej pozycji socjalnej odznaczają się wysoką jakością
a samice kierując swoje preferencje bardziej w kierunku samców dominujących (Trivers, 1972) mogą wpłynąć na sukces rozrodczy samców i ich potomstwa (Luque-Larena
i wsp., 2003). Sądzi się, że sukces samca w konkurencji z innymi osobnikami tego samego gatunku prawdopodobnie zależy od jego kondycji, zdrowia, lepszego dostosowania, zatem samice kojarząc się z dominantem będą odnosiły korzyści w postaci np. lepiej przeżywającego i atrakcyjniejszego potomstwa oraz korzyści genetyczne dla dzieci (Kirkpatrick, 1996; Qvarnström i Forsgren, 1998). Samce o wyższej pozycji socjalnej mogą być także bardziej skuteczni w pozyskiwaniu i obronie zasobów niż subordynanty. Wcześniejsze badania dowiodły, że wysoki status socjalny ułatwia ustalenie kolejności doboru partnera do kojarzenia i prowadzi do wzrostu sukcesu rozrodczego chomika złocistego (Huck i wsp., 1986). Podobnie u myszy, samiec dominant ma zdolność spłodzenia większej liczby młodych w miocie niż subordynant (D'Amato, 1988).
Zachodzi zatem pytanie w czym samce dominanty nornicy rudej są lepsze od subordynantów? Może różnią się ilością i jakością produkowanych gamet?
3. MATERAIŁY I METODY.
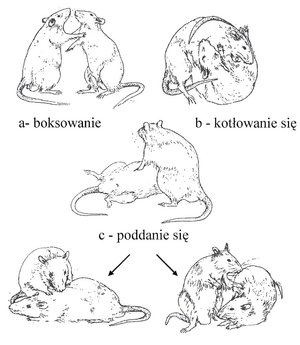
3.1. TEST OKREŚLAJĄCY POZYCJĘ SOCJALNĄ SAMCÓW
Pozycję socjalną samców ustalano na podstawie opracowanych współczynników dominacji i subordynacji. Współczynnik dominacji obliczano jako sumę gonitw i ataków, natomiast współczynnik subordynacji to suma straszeń, ucieczek i pozycji poddańczych podczas 7 dni testów. Zwierzę zaklasyfikowano jako dominanta, jeśli miało istotnie statystycznie większy współczynnik dominacji niż drugi osobnik z pary. Natomiast jako subordynanta zaklasyfikowano samca o istotnie statystycznie większym współczynniku subordynacji niż drugi samiec z pary. Ogółem do doświadczenia wykorzystano 17 par samców i 17 par samic.
Ryc.2. Pozycje samców nornicy rudej Myodes glareolus podczas ustalania pozycji dominanta.
3.3. OKREŚLENIE STOPNIA ROZWOJU MORFOLOGICZNEGO UKŁADU ROZRODCZEGO SAMCÓW
Samce o ustalonej pozycji socjalnej ( 13 samców dominantów i 13 samców subordynantów) zabijano przez dyslokację kręgów szyjnych, ważono z dokładnością do 0,01g, odsłaniano narządy wewnętrzne a następnie usuwano i ważono jądra oraz gruczoły dodatkowe (gruczoł pęcherzykowy i koagulujący ważone wspólnie)
z dokładnością do 0,01mg. Ciężar gonad i gruczołów dodatkowych przeliczano na 10g ciężaru ciała.
3.4. LICZBA PLEMNIKÓW
Po zważeniu samców i ich narządów wewnętrznych wypreparowano nasieniowody, po uprzednim lekkim naciśnięciu głowy najądrza wyciskano pincetą zawartość obu nasieniowodów do 100µl pożywki M2 (Sigma-Aldrich, Germany). Zawiesinę pozostawiano na 2 minuty aby plemniki rozproszyły się w pożywce. Następnie mieszalnikiem do białych krwinek pobierano zawiesinę do podziałki 0,5 i dopełniano pożywką M2 do górnej podziałki 11 i mieszano. Tak przygotowane plemniki nakładano na środek komory Bürkera i przykrywano szkiełkiem.
Preparat analizowano pod mikroskopem świetlnym o powiększeniu 20x (Rycina1). Liczbę plemników oceniano dwukrotnie w 100 małych kwadratach komory, następnie obliczano średnią z tych dwóch pomiarów. Oglądając preparat pomijano zgrupowania komórek (Seed i wsp., 1996).
Liczbę plemników w 1 mm3 nasienia wyliczano ze wzoru:
x = (b×4000×c)/a
gdzie:
x - liczba plemników w 1 mm3 nasienia
a - liczba małych kwadratów (100)
b - średnia liczba plemników z dwóch pomiarów we wszystkich kwadratach
c - rozcieńczenie (20x)
Rycina 3. Ogólny obraz plemników samców nornicy rudej pod mikroskopem w powiększeniu 400x, (Katarzyna Sowa-Lewandowska, 2008)
3.5. DOJRZAŁOŚĆ PLEMNIKÓW
Pobrano 20µl z zawiesiny plemników przygotowanej do oceny liczby gamet jak opisano w podrozdziale (3.4.) na szkiełko podstawowe i delikatnie zrobiono rozmaz. Preparat oglądano pod mikroskopem świetlnym o powiększeniu 40x. Analizowano położenie kropli cytoplazmatycznej w 100 żywych, poruszających się plemnikach. Pomiaru dokonywały dwie osoby, następnie obliczano średnią z tych dwóch wyników.
Wyróżniono trzy klasy plemników w zależności od położenia kropli cytoplazmatycznej (Rycina 2):
I) kropla cytoplazmatyczna położona tuż za główką plemnika (proksymalnie) – plemniki najmniej dojrzałe
II ) kropla cytoplazmatyczna położona w 1/3 długości witki za główką plemnika czyli tuż za wstawką (dystalnie)
III) plemniki pozbawione kropli cytoplazmatycznej – w pełni dojrzałe.
Liczbę plemników w poszczególnych klasach wyrażano jako procent (%) liczby oglądanych plemników.
3.6. ANALIZA STATYSTYCZNA
Do analizy statystycznej użyto następujących testów: analizę wariancji ANOVA, test t-Studenta dla dwóch prób niezależnych oraz nieparametryczny test kolejności par Wilkoxon'a dla dwóch zmiennych zależnych. W celu oszacowania istotności różnic
we współczynnikach dominacji i subordynacji dla poszczególnych par samców użyto ANOVA. Test t-Studenta wykorzystano w celu porównania ciężarów ciała, ciężarów gonad oraz ciężarów gruczołów dodatkowych między samcami dominantami
a subordynantami. Natomiast za pomocą testu Wilkoxon'a oszacowano różnice pomiędzy wartościami średnimi w liczbie i procentowej zawartości plemników poszczególnych klas dojrzałości w zależności od statusu socjalnego samców. Różnice między średnimi uznano za istotne statystycznie przy poziomie istotności p<0,05.
Analizę statystyczną przeprowadzano przy użyciu programu komputerowego Statistica 7.1.
Badania prezentowane w tej pracy uzyskały zgodę I Lokalnej Komisji Etycznej w Krakowie. Numer zgody 80/OP/2005 z dnia 26.10.2005 r.
4. Wyniki
4.1. TEST OKREŚLAJĄCY POZYCJĘ SOCJALNĄ SAMCÓW
Dla każdej pary testowanych samców ustalano współczynnik dominacji i subordynacji i tylko pary samców z istotnymi statystycznie różnicami pomiędzy średnimi wartościami danego współczynnika brano do dalszej analizy. Dla 13 spośród 17 par testowanych samców jasno określono pozycję socjalną. W czterech parach nie ustalono hierarchii socjalnej samców i nie brano ich pod uwagę do dalszych analiz.
U samców dominantów wykazano istotnie statystycznie większy współczynnik dominacji, natomiast u subordynantów zanotowano istotnie statystycznie większy współczynnik subordynacji.
4.2. OKREŚLENIE STOPNIA ROZWOJU MORFOLOGICZNEGO UKŁADU ROZRODCZEGO SAMCÓW
W celu oszacowania różnic w ciężarze ciała, ciężarze gonad i ciężarze gruczołów dodatkowych (gruczoł pęcherzykowy i koagulujący ważone wspólnie) pomiędzy samcami dominantami a subordynantami przeprowadzono test t-Studenta.
U samców o wyższej pozycji socjalnej zanotowano istotnie statystycznie większy ciężar ciała (xśr. = 26,17 ± 0,70g) niż u samców o niższej pozycji socjalnej (xśr. = 22,99 ± 0,66g) (t = 3,32; df = 24; p<0.01).
Względny ciężar gonad samców dominantów (xśr. = 355,52 ± 11,48mg) i subordynantów (xśr. = 337,69 ± 11,44mg) był zbliżony i nie różnił się istotnie statystycznie (t = 1,10; df = 24; p>0,05).Natomiast wykazano istotne statystycznie różnice we względnym ciężarze gruczołów dodatkowych pomiędzy samcami dominantami a subordynantami (xśr. = 177,37 ± 5,59mg; xśr. = 154,51 ± 7,49mg, odpowiednio) (t = 2,45; df = 24; p<0,05).
4.3. LICZBA PLEMNIKÓW
U samców o wyższym statusie socjalnym wykazano istotnie statystycznie więcej plemników w 1 mm3 spermy (xśr. = 122,67 ± 9,46×10-4/ml3) niż u subordynantów (x śr. = 66,64 ± 3,26×10-4/ml3) (Z = 3,18; p<0,01) (Wykres 3).
4.4. DOJRZAŁOŚĆ PLEMNIKÓW
Kolejnym badanym parametrem było określenie stopnia dojrzałości plemników samca dominanta i subordynanta, czego wskaźnikiem przyjęto obecność i położenie kropli cytoplazmatycznej.
W nasieniu samców o niższej pozycji socjalnej zanotowano statystycznie istotnie więcej plemników z kroplą cytoplazmatyczną położoną proksymalnie (xśr. = 5,4 ± 0,6%) niż u samców o wyższym statusie socjalnym (xśr. = 1,5 ± 0,2%) (Z = 3,18; p<0,01)
Również w spermie subordynantów stwierdzono statystycznie istotnie więcej plemników z kroplą cytoplazmatyczną położną dystalnie (xśr. = 16,2 ± 1,0%) niż u samców dominantów (xśr. = 8,3 ± 1,0%) (Z = 3,18; p<0,01) (Wykres 4B).Tak więc, u samców o wyższej pozycji socjalnej procent plemników w pełni dojrzałych, czyli pozbawionych kropli cytoplazmatycznej był istotnie statystycznie wyższy (xśr. = 90 ± 1,0%) niż u samców subordynantów (xśr. = 78 ± 1,0%) (Z = 3,18; p<0,01).
5. Dyskusja
O aktywności hormonalnej samców świadczy stopień rozwoju ich układu rozrodczego. Ponieważ w niniejszej pracy stwierdzono różnice w ciężarze ciała między dominantem a subordynantem , dlatego też policzono ciężar gonad
i gruczołów dodatkowych na 10g ciężaru ich ciała. Względny ciężar gonad samców
o odmiennym statusie socjalnym był zbliżony i nie różnił się istotnie statystycznie co jest zgodne z obserwacjami Kruczek (1997). W swoich badaniach na myszach Koyama i Kamimura (1999, 2000, 2003) również nie stwierdzili relacji między ciężarem jąder
a ciężarem ciała u dominantów i subordynantów. Wykazano natomiast istotne statystycznie różnice w ciężarze gruczołów dodatkowych pomiędzy samcami nornicy rudej o odmiennym statusie socjalnym. Zanotowano znacznie większy względny ciężar gruczołów dodatkowych u dominantów niż u subordynantów . Podobne wyniki uzyskała Kruczek (1997), masa gruczołów napletkowych, koagulujących i pęcherzykowych była mniejsza u subordynantów niż u dominantów. Podobnie większy ciężar gruczołów napletkowych u dominantów nornicy rudej zanotowano w badaniach Gustafssona i wsp., (1980). Ponieważ masa gruczołów dodatkowych jest wskaźnikiem aktywności hormonalnej jąder (Kruczek, 1986) a gruczoły te są znacznie większe u dominantów, to można pośrednio wnioskować o wyższym u nich poziomie testosteronu, co zostało wykazane w badaniach na norniku górskim (Jannett, 1978). Podobnie wyraźną zależność poziomu testosteronu we krwi od pozycji socjalnej samca u myszy zaobserwowali Bronson i Marsden (1973) oraz Koyama i Kamimura (2000).
Proces powstawania i dojrzewania plemników jest także pod kontrolą androgenów. Skoro samce dominanty i subordynanty różnią się poziomem testosteronu, to zachodzi pytanie czy te samce różnią się ilością i jakością produkowanych gamet?
Badania ilości i jakości plemników u samców nornicy rudej są nowatorskie, zatem nie ma jeszcze dostępnej literatury na ten temat. Dlatego też wyniki niniejszych badań dyskutowane będą na tle danych literaturowych dotyczących innych gatunków gryzoni. Ilość plemników produkowanych przez samce nornicy rudej
(46,36 – 176,72×10-4/ml3) jest porównywalna do ilości gamet produkowanych przez samce innych gatunków gryzoni. U samców szczurów liczba plemników w 1 mm3 spermy wynosiła 8,96×10-6 (Wier i Rumberger, 1995), natomiast u myszy 230×10-4 (Aragón i Altamirano-Lozano, 2001). Różnice w rzędzie wielkości mogą być spowodowane innymi metodami analizy plemników. Analiza liczby plemników wykazała istotne statystycznie różnice pomiędzy samcami o odmiennym statusie socjalnym. U samców dominantów zanotowano istotnie statystycznie większą liczbę plemników niż u subordynantów (xśr. = 122,67 ± 9,46×10-4/ml3; xśr. = 66,64 ± 3,26×10-4/ml3, odpowiednio). Podobne wyniki uzyskano dla samców myszy (Koyama i Kamimura, 2000, 2001). Wg Koyama
i Kamimura (2001) liczba plemników u samca o wyższym statusie socjalnym zależy dodatkowo od obecności samicy lub jej zapachu. Zapach samicy nie ma natomiast wpływu na samce o niższej pozycji socjalnej. U nich liczba plemników jest ogólnie niska. W badaniach Taylora i wsp. (1987) obecność samicy spowodowała wzrost liczby plemników w jądrach i najądrzach szczurów. Zatem można wnioskować, że zapach samicy dodatkowo stymuluje samce do produkcji większej liczby gamet u dominantów. W prezentowanych badaniach zarówno samce o wyższej hierarchii jak i samce o niższej pozycji socjalnej hodowano z samicami, zatem można wykluczyć wpływ obecności samicy na różnicę w liczbie produkowanych przez nie gamet. Wg Koyama i Kamimura (2000) liczba plemników u subordynantów myszy była ogólnie niska we wszystkich doświadczalnych grupach (w grupie z samicami, bez samic, z obecnością zapachu samic), co sugeruje, że wpływ socjalnej dominacji był tu silniejszy niż wpływ obecności samicy lub jej zapachu.
O efektywności plemników w zapłodnieniu decyduje nie tylko ich ilość ale także ich jakość. Wśród parametrów określających jakość spermy wyróżnia się: ruchliwość (Koyama i Kamimura 1999, 2000, 2001, 2003; Vetter i wsp., 1998), morfologię główki (Laudat i wsp., 1997; Krzanowska, 1981), żywotność (Somfai i wsp., 2002; Fielden i wsp., 2001) oraz prawidłową pracę witki plemnika (Calvo i wsp., 1997).
Miarą jakości gamet męskich może być również stopień zaawansowania dojrzewania. Plemniki opuszczające jądro nie są w pełni dojrzałymi komórkami rozrodczymi. W czasie pobytu w najądrzu przechodzą szereg zmian morfologicznych, biochemicznych i czynnościowych, w wyniku których uzyskują zdolność do ruchu
i zapłodnienia komórki jajowej. Najwięcej procesów związanych z dojrzewaniem plemników odbywa się w głowie najądrza. Czynnikami kontrolującymi proces dojrzewania plemników w najądrzu są androgeny (Wenda-Różewicka, 1998). Równocześnie wraz z zakończeniem spermiogenezy usuwana jest wzdłuż witki większość zbędnej cytoplazmy w postaci kropli cytoplazmatycznej (Austin i Short, 1978).
Położenie kropli cytoplazmatycznej wzdłuż witki plemnika może być dystalne lub proksymalne. Zadano więc pytanie których plemników jest więcej u dominantów
a których u subordynantów. W niniejszej pracy istotnie statystycznie więcej plemników z kroplą cytoplazmatyczną położoną proksymalnie, czyli tuż za główką plemnika (plemniki najmniej dojrzałe) zanotowano u samców o niższej pozycji socjalnej, jak również wykazano u nich więcej plemników z kroplą cytoplazmatyczną położoną dystalnie. Świadczy to o spowolnionym tempie dojrzewania gamet męskich samców subordynantów. Konsekwentnie u dominantów stwierdzono więcej plemników pozbawionych kropli cytoplazmatycznej, co świadczy o pełnej dojrzałości gamet.
Opóźnienie dojrzewania spermy w najądrzu czego wskaźnikiem jest większa frekwencja plemników z kroplą cytoplazmatyczną na witce, przyczynia się do fizjologicznej niewydajności gamet męskich w procesie zapłodnienia jak to wykazano dla myszy (Styrna i wsp., 2002; Xian i wsp., 1992).
Ejakulat zdrowych, dojrzałych samców posiada pewną ilość nieprawidłowych gamet męskich. Ta ilość zmienia się zależnie od gatunków zwierząt i jest spowodowana przez zmiany w spermatogenezie w jądrach (wady pierwotne) lub najądrzach (wady wtórne). Nieprawidłowo zbudowane plemniki reprezentują 14,6-19,6% wszystkich plemników
u dorosłych chomików (Calvo i wsp., 1997) a nieprawidłowości gamet męskich są uwarunkowane genetycznie (Styrna i wsp., 2002; 2003). Jakość nasienia jest silnie skorelowana z efektywnym zapłodnieniem (Snook, 2005).
U nornicy rudej stwierdzono wielokrotne kopulacje (Ratkiewicz i Borkowska, 2000). Samice Myodes glareolus podobnie jak inne Cricetidae charakteryzują się owulacją prowokowaną tj. wywołaną przez bodziec mechaniczny i występuje ona
od 6 do 14 godzin po kopulacji (Clarke i wsp., 1970). Spośród plemników zdeponowanych przez samca w drogach rodnych samicy część obumiera (Tannenbaum i wsp., 2003). Skoro
u samców o wyższej pozycji socjalnej jest więcej plemników to większa jest też ich szansa
w dotarciu do komórki jajowej i zapłodnieniu jej. O efektywności zapłodnienia decyduje również jakość gamet, zatem plemniki o lepszych parametrach jakie stwierdzono
u dominantów mają większą szansę w zapłodnieniu. Wydaje się więc, że samica czerpie zysk z kojarzenia z samcem dominantem, ponieważ jego gamety są lepsze i jest ich dużo. Można więc wnioskować, że plemniki które otrzymuje od samca dominanta zwyciężą konkurencję. Dodatkowo fakt wybrania na partnera seksualnego samca o wyższej pozycji socjalnej może zostać wzmocniony tym, iż doszło do kojarzenia z wybranym przez siebie partnerem. Badania na myszach (Drickamer i wsp., 2000, 2003) wykazały, że potomstwo pary, która wybrała się wzajemnie, charakteryzuje się lepszą przeżywalnością i aktywnością rozrodczą. Preferencja przez samice nornicy rudej samców dominujących mogłaby być adaptacją przystosowawczą samic, jeśli to prowadzi do bardziej pomyślnych godów i bardziej dostosowanego potomstwa (Kruczek, 1997).
Można zatem spekulować dalej, że potomstwo po dominancie powinno być „lepsze” niż po subordynancie. Udokumentowanie eksperymentalne tej ostatniej konkluzji znajduje się w pracy magisterskiej (Zatorska, 2007).
W niniejszej pracy badania jakości plemników ograniczone zostały do jednego parametru a jak wspomniano wyżej tych parametrów może być więcej. Dlatego też celowym wydaje się prowadzenie dalszych badań dotyczących oceny jakości gamet męskich samców nornicy rudej o odmiennym statusie socjalnym.
PODSUMOWANIE
1.Status samca wpływa na jakość nasienia - istnieją statystycznie istotne różnice pomiędzy spermą samców dominantów i subordynantów - wstęp do badań nad selekcja spermy do banków nasienia (?).
2. Samce o wyższej pozycji socjalnej cechuje większa liczba gamet jak też gamety te cechuje lepsza żywotność, zdolność do ruchu, dojrzałość i prawidłowo zbudowana błona cytoplazmatyczna witki.
3.Wszystkie wymienione parametry decydują o efektywności w zapłodnieniu:
- liczba plemników- istotna w konkurencji plemników (wielokrotne kopulacje),
- większa liczba żywych plemników = większa szansa na zapłodnienie komórki jajowej (prowokowana owulacja),
- większa liczba plemników ruchliwych = większa szansa na zapłodnienie komórki jajowej,
- utrzymanie prawidłowej integralności błony komórkowej konieczne dla zachowania szybkości pływania.
WNIOSEK
Samica wybierając na partnera seksualnego samca dominanta zyskuje lepsze gamety, co
w konsekwencji zwiększa szansę na zwycięstwo w konkurencji plemników, płodną kopulację i wydanie na świat potomstwa.
Opracowała:
Katarzyna Sowa-Lewandowska
6. Literatura
1) Aragón A. M., Altamirano-Lozano M., 2001, Sperm and testicular modifications induced by subchronic treatments with vanadium (IV) in CD-1 mice, Reprod. Toxicol., 15, 145-151.
2) Austin C. R., Short R. V. (red.), 1978, Rozród ssaków. Komórki płciowe
i zapłodnienie, Wiedza Powszechna, Warszawa.
3) Bielańska-Osuchowska Z., Sysa P., 1998, Ultrastruktura plemnika ssaka,
W: Łukaszyk A., Bilińska B., Kawiak J., Bielańska-Osuchowska Z. (red.), Ultrastruktura i funkcja komórki. Mechanizmy regulujące spermatogenezę, Warszawa, PWN, 7,77-98.
4) Breucker H., Schafer E., Holstein A. F., 1985, Morphogenesis and fate of the residual body in human spermiogenesis, Cell Tiss. Res., 240, 303-309.
5) Bronson F. H., Marsden H. M., 1973, The preputial gland as an indicator of social dominance in male mice, Behav. Biol., 9, 625-628.
6) Buchalczyk A., 1970, Reproduction, mortality and longevity of the bank vole under laboratory conditions, Acta Theriol., 15, 153-176.
7) Bujalska G., 1973, The role of spacing behaviour among females in the regulation of reproduction in the bank vole, J. Reprod. Fert. 19, 465-474.
8) Bujalska G., 1990a, Social system of the bank vole, Clethrionomys glareolus,
W: Tamarin R. H., Ostfeld R. S., Pugh S. R., Bujalska G., (red.), social system and population cycles in voles, Birkhauser Verlag, Basel, 155-167.
9) Bujalska G., 1990b, Struktura i organizacja socjalna nornicy rudej, Wiad. Ekol., 36, 187-202.
10) Calvo A., Martinez E., Pastor L. M., Vázquez J. M., Roca J., 1997, Classification and quantification of abnormal sperm along the epididymal tract. Comparison between adult and aged hamsters, Reprod. Natur. Dev., 37, 661-673.
11) Clarke J. R., Clulow F. V., Greig F., 1970, Ovulation in the bank vole, Clethrionomys glareolus, J. Reprod. Fert., 23, 531.
12) D'Amato F. R., 1988, Effects of male social status on reproductive success and on behavior in mice (Mus musculus), J. Com. Psychol., 2, 146-151.
13) Drickamer L. C., Gowaty P. A., Holmes C. M., 2000, Free female mate choice in house mice affects reproductive success and offspring viability and performance, Anim. Behav., 59, 371-378.
14) Drickamer L. C., Gowaty P. A., Wagner D. M., 2003, Free mutual mate preferences in house mice affect reproductive success and offspring performance, Anim. Behav., 65, 105-114.
15) Fielden M. R., Halgren R. G., Tashiro C. H. M., Yeo B. R., Chittim B., Chou K., Zacharewski T. R., 2001, Effects of gestational and lactational exposure to Aroclor 1242 on sperm quality and in vitro fertility in early adult and middle-aged mice, Reprod. Toxicol., 15, 281-292.
16) Gipps J. H. W., 1985, Spacing behaviour and male reproductive ecology in voles of the genus Clethrionomys, Ann. Zool. Fennici., 22, 343-351.
17) Gustafsson T., Andersson B., Meurling P., 1980, Effect of social rank on the growth of the preputial glands in male bank voles, Clethrionomys glareolus, Physiol. Behav., 24, 689-692.
18) Hoffmeyer I., 1982, Responses of female bank voles (Clethrionomys glareolus) to dominant vs subordinate conspecific males and to urine odors from dominant vs subordinate males, Behav. Neur. Biol., 36, 178-188.
19) Horne T. J., Ylönen H., 1996, Female bank voles (Clethrionomys glareolus) prefer dominant males; but what if there is no choice?, Behav. Ecol. Sociobiol., 38,
401-405.
20) Huck U. W., Lisk R. D., Allison J. C., van Dongen C. G., 1986, Determinants of mating success in the golden hamster (Mesocvicetus auratus): Social dominance and mating tacties under seminatural conditions, Anim. Behav., 34, 971-989.
21) Jakob E. M., Marshall S. D., Uetz G. W., 1996, Estimating fitness: a comparison of body condition indices, Okios, 77, 61-67.
22) Jannett J. F., 1978, Dosage response of the vesicular preputial, anal, and hip glands of the male vole, Microtus montanus, to testosterone propionate,
J. Mammal., 59, 772-779.
23) Kirkpatrick M., 1996, Good genes and direct selection in the evolution of mating preferences, Evolution, 50, 2125-2140.
24) Koyama S., Kamimura S., 1999, Lowered sperm motility in subordinate social status of mice, Physiol. Behav., 65, 665-669.
25) Koyama S., Kamimura S., 2000, Influence of social dominance and female odor on the sperm activity of male mice, Physiol. Behav., 71, 415-422.
26) Koyama S., Kamimura S., 2001, Effects of social dominance and female odor on sperm activity of male mice, W: Marchlewska-Koj A., Lepri J. J., Müller-Schwarze D., Chemical signals in vertebrates, Kluwer Academic/Plenum Publishers, New York, 9, 403-408.
27) Koyama S., Kamimura S., 2003, Study on the development of sperm motility and social dominance of male mice, Physiol. Behav., 80, 267-272.
28) Kruczek M., 1986, Seasonal variations of testicular in juvenile and mature bank voles (Clethrionomys glareolus), Folia Biologica (Kraków), 4, 373-380.
29) Kruczek M., 1994, Reaction of female bank voles Clethrionomys glareolus to male chemosignals, Acta Theriol., 39, 249-255.
30) Kruczek M., 1997, Male rank and female choice in the bank vole, Clethrionomys glareolus, Behav. Process., 40, 171-176.
31) Kruczek M., 1998, Male chemical signals and female choice in the bank vole Clethrionomys glareolus, Jagiellonian University, Kraków, Praca habilitacyjna, 334, 1-52.
32) Kruczek M., Pochroń E., 1997, Chemical signals from conspecifics modify the activity of female bank voles (Clethrionomys glareolus), Acta. Theriol., 42, 71-78.
33) Krzanowska H., 1981, Sperm head abnormalities in relation to the age and strain
of the mice, J. Reprod. Fertil., 62, 385-392.
34) Kurpisz M., 1998, Immunologiczne aspekty spermatogenezy u ssaków,
W: Łukaszyk A., Bilińska B., Kawiak J., Bielańska-Osuchowska Z. (red.), Ultrastruktura i funkcja komórki. Mechanizmy regulujące spermatogenezę, Warszawa, PWN, 7,127-143.
35) Lanctot R. B., Best L., 2000, Comparison of methods for determining dominance rank in male and female praire voles (Microtus ochrogaster), J. Mammal., 81,
734-745.
36) Laudat A., Foucault P., Palluel A. M., 1997, Relationship between seminal LDH-C4 and spermatozoa with acrosome anomalies, Acta Clin. Chemic., 265,
219-224.
37) Luque-Larena J. J., López P., Gosálbez J., 2002, Levels of social tolerance between snow voles Chionomys nivalis, during oper-wintering periods, Acta Theriol., 47, 163-173.
38) Luque-Larena J. J., López P., Gosálbez J., 2003, Male dominance and female chemosensory preferences the rock-dwelling snow vole, Behaviour, 140, 665-681.
39) Marchlewska-Koj A., Kołodziej B., Filipowska A., 1989, Agressive behaviour of adult bank voles (Clethrionomys glareolus) towards conspecifics, Agress. Behav., 15, 381-387.
40) O'Donald P., 1983, Sexual selection by female choice, W: Bateson P., (red.), Mate choice, Cambridge University Press, Cambridge, 53-66.
41) Pavlinov I. Y., 2006, Myodes pallas 1811 is a valid name for the genus of
red-backed voles (Critecidae), Z. Zool., 5, 667-669.
42) Pucek M., 1983, Habitat preference, Acta Theriol., 28, suppl. 1, W: Petrusewicz K. (red.), Ecology of bank vole. Polish Scientific Publishers, Warszawa,
31-40.
43) Qvarnström A., Forsgren E., 1998, Should females prefer dominant males?, Tree, 12, 498-501.
44) Raczyński J., 1983, Taxonomic position, geographical range, and the ecology of distribution, Acta Theriol., 28, suppl. 1, W: Petrusewicz K. (red.), Ecology of bank vole. Polish Scientific Publishers, Warszawa, 3-11.
45) Ratkiewicz M., Borkowska A., 2000, Multiple paternity in bank vole (Clethrionomys glareolus); field and experimental data, Inter. J. Mammal. Biol., 65, 6-14.
46) Seed J., Chapin R. E., Clegg E. D., Dostal L. A., Foote R. H., Hurtt M. E., Klinefelter G. R., Makris S. L., Perreault S. D., Schrader S., Seyler D., Sprando R., Treinen K. A., Veeramachaneni D. N. R., Wise L. D., 1996, Methods for assessing sperm motility, morphology, and counts in the rat, rabbit, and dog: consensus report, Reprod. Toxicol., 3, 237-244.
47) Snook R. R., 2005, Sperm in competition: not playing by the numbers, Trends Ecol. Evol., 1, 46-53.
48) Somfai T., Bodó Sz., Nagy Sz., Gócza E., Iváncsics J., Kovács A., 2002, Simultaneous evaluation of viability and acrosome integrity of mouse spermatozoa using light microscopy, Biotech. Histochem., 77, 117-120.
49) Styrna J., Bilińska B., Krzanowska H., 2002, The effect of a partial Y chromosome deletion in B10.BR-Ydel mice on testis morphology, sperm quality and efficiency of fertilization, Reprod. Fertil. Dev., 14, 101-108.
50) Styrna J., Kilarski W., Krzanowska H., 2003, Influence of the CBA genetic background on sperm morphology and fertilization efficiency in mice with a partial Y chromosome deletion, Reproduction, 126, 579-588.
51) Tannenbaum L. V., Bazar M., Hawkins M. S., Cornaby B. W., Ferguson E. A., Carroll L. Ch., Ryan P. F., 2003, Rodent sperm analysis in field-based ecological risk assessment: pilot study at Ravenna army ammunition plant, Ravenna, Ohio, Environm. Poll., 123, 21-29.
52) Taylor G. T., Weiss J., Rupich R., 1987, Male rat behavior, endocrinology and reproductive physiology in a mixed-sex, socially stressful colony, Physiol. Behav., 39, 429-433.
53) Trivers R. L., 1972, Parental investment and sexual selection, W: Campbell B. (red.), Sexual selection and the descent of man 1871-1971, Heinemann, London, 136-179.
54) Vetter Ch. M., Miller J. E., Crawford L. M., Armstrong M. J., Clair J. H., Conner M. W., Wise L. D., Skopek T. R., 1998, Comparison of motility and membrane integrity to assess rat sperm viability, Reprod. Toxicol., 2, 105-114.
55) Wenda-Różewicka L., 1998, Mechanizmy regulacyjne w najądrzach ssaków,
W: Łukaszyk A., Bilińska B., Kawiak J., Bielańska-Osuchowska Z. (red.), Ultrastruktura i funkcja komórki. Mechanizmy regulujące spermatogenezę, Warszawa, PWN, 7, 302-325.
56) Wier P. J., Rumberger D., 1995, Isolation of rat sperm from the vas deferens for sperm motion analysis, Reprod. Toxicol., 3, 327-330.
57) Xian M., Azuma S., Naito K., Kunieda T., Morivaki K., Toyoda T., 1992, Effect of a partial deletion of Y chromosome on in vitro fertilizing ability of mouse spermatozoa, Biol. Reprod., 47, 549-553.
58) Ylönen H., Mappes T., 1995, Spacing behaviour and key resources: an experiment on seasonal preferences of male bank voles, Clethrionomys glareolus, for food and females, Ann. Zool. Fennici., 32, 445-448.
59) Ylönen H., Pusenius J., Viitala J., 1995, Impact of kinship and familiarity on the annual social organization and populations dynamics of Clethrionomys and Microtus, Ann. Zool. Fennici., 32, 225-232.
60) Zatorska M., 2007, Wpływ statusu socjalnego samców nornicy rudej (Myodes glareolus) na tempo dojrzewania płciowego potomstwa, Praca magisterska.