W żargonie chemików mówi się wtedy o cieczach mieszających się ze sobą nieograniczenie. Na drugim biegunie znajduje się przypadek kiedy po zmieszaniu silnie polarnej cieczy, jaką jest woda z niepolarną lub mało polarna cieczą, tj. większość olejów, prowadzi do utworzenia mieszaniny, w której łatwo można rozróżnić dwie fazy ciekłe. To zjawisko jest zazwyczaj tłumaczone w podręcznikach poprzez stwierdzenie, iż olej jest hydrofobowy ("nie lubiący wody"), a zatem nie miesza się z wodą, podczas gdy małe, polarne cząsteczki organiczne (np. kwas octowy, który jest właśnie głównym składnikiem organicznym w occie winnym, a w spirytusowym - jedynym składnikiem organicznym) są hydrofilowe ("lubiące wodę"), a zatem mieszają się z wodą nieograniczenie (tworzą z wodą roztwory jednofazowe - homogeniczne).
Ten sposób tłumaczenia sprawia, iż uczniowie i studenci (a nawet zawodowi chemicy) wnioskują że pojedyncze cząsteczki wody i oleju odpychają się wzajemnie, albo co najwyżej niezwykle słabo przyciągają się. I właśnie ten błąd w rozumowaniu powinien zostać obalony: Pojedyncza cząsteczka oleju jest przyciągana przez cząsteczkę wody ze znacznie większą siła niż ma to miejsce pomiędzy samymi cząsteczkami oleju!
Możemy zaobserwować konsekwencje tej dużej siły przyciągania pomiędzy cząsteczkami wody i oleju jeśli umieścimy kroplę oleju na czystej powierzchni wody. Zanim kropla oleju uderzy w powierzchnię wody przyjmie ona kształt zbliżony do kuli. Kształt ten wynika z faktu, iż cząsteczki oleju przyciągają się wzajemnie, a dzięki kulistemu kształtowi minimalna ilość cząsteczek oleju znajdujących się na powierzchni tej kuli nie jest otoczona przez inne cząsteczki oleju. Kiedy tylko olej uderzy w powierzchnię wody rozprzestrzenia się na jej powierzchni i tworzy cienką warstwę. Właśnie ten efekt wynika bezpośrednio z faktu, iż siła przyciągania pomiędzy cząsteczkami oleju i wody jest większa niż pomiędzy samymi cząsteczkami oleju.
Jeśli na powierzchni wody umieści się odpowiednio małą ilość oleju, powstała cienka warstwa oleju jest warstwą monomolekularną (czyli o grubości pojedynczej cząsteczki). Poprzez pomiar powierzchni takiej warstwy można uzyskać przybliżone wymiary cząsteczek oleju jeśli uwzględni się jej masę (lub objętość i gęstość) oraz liczbę Avogadro. Można też odwrócić problem i obliczyć przybliżoną wartość liczby Avogadro w analogiczny sposób.
Jeśli oddziaływanie pomiędzy cząsteczkami wody i oleju jest tak silnie, to dlaczego każda cząsteczka oleju nie zanurzy się w wodzie (z utworzeniem roztworu), co doprowadziłoby do otoczenia każdej cząsteczki oleju przez cząsteczki wody? Aby tak się mogło stać, cząsteczka oleju musiałaby "wejść" pomiędzy cząsteczki wody. Oddziaływanie pomiędzy cząsteczkami wody jest znacznie silniejsze nawet od oddziaływania cząsteczek woda-olej. Dlatego wejście cząsteczki oleju pomiędzy wzajemnie silnie przyciągane cząsteczki wody musiało by zostać odkupione (zrekompensowane) dużą porcją energii. Z tej przyczyny znaczna większość cząsteczek oleju pozostanie na powierzchni, mimo iż chciałyby zostać otoczone ze wszystkich stron przez cząsteczki wody.
Mokra teoria jazdy na łyżwach
Woda ma wiele zaskakujących własności. Jedną z nich jest fakt, że jej niskociśnieniowa forma stała (znana nam jako lód) ma o ok. 10% większą objętość od odpowiedniej objętości formy ciekłej, w którą przekształca się lód podczas topnienia. Powszechną konsekwencją tej własności jest zjawisko "pływania" kawałków lodu na powierzchni ciekłej wody, przy czym ok. 10% ich objętości jest wynurzona, natomiast pozostałe 90% objętości jest zanurzone w wodzie.
Inną konsekwencją zmniejszenia objętości wody podczas topnienia jest obniżenie temperatury topnienia lodu ze wzrostem ciśnienia na jego powierzchni. Ta zależność może być również tłumaczona "regułą przekory" Le Chateliera. Wzrost ciśnienia na daną powierzchnię lodu może być częściowo zniwelowany (kompensowany) poprzez stopienie części lodu, co prowadzi do zmniejszenia części wyjściowej objętości. Jednakże jest to bardzo niewielki efekt: potrzebne jest ciśnienie ok. 121 atmosfer (1,22 MPa w jednostkach SI) na obniżenie temperatury topnienia lodu o 1 stopień Celsjusza.
Często zależność tę wykorzystuje się do tłumaczenia zjawiska, które pozwala na jazdę na łyżwach. Stosuje się uzasadnienie mówiące, że ciśnienie jakie łyżwy wywierają na powierzchnię lodu powoduje topnienie lodu pod łyżwami, co prowadzi do znacznego obniżenia tarcia pomiędzy lodem a ostrzem łyżwy. Mimo iż wygląda to dość logicznie, nie jest do końca prawdziwe. Jeśli łyżwiarz o masie 75 kg założy łyżwy o ostrzu, które ma 3 mm szerokości i 20 cm długości, przy uwzględnieniu siły grawitacji można obliczyć że ostrza łyżwy wywierają ciśnienie na powierzchnię lodu równe 12 atm. Jeśli nawet wyobrazimy sobie, iż siła nacisku jest skoncentrowana na mniejszą powierzchnię lodu, to wywierane ciśnienie na tę powierzchnię będzie w stanie obniżyć temperaturę topnienia lodu (na tej powierzchni) o dziesiętne części stopnia Celsjusza. Ale jeśli wszyscy wiemy, iż możliwa jest jazda na łyżwach nawet jeśli temperatura otoczenia (i lodu ) jest dużo niższa od temperatury krzepnięcia (i jednocześnie topnienia) lodu pod normalnym ciśnieniem, jak zatem wytłumaczyć to zjawisko łatwego przesuwania się ostrza łyżwy po lodzie, jeśli efekt obniżenia temperatury topnienia lodu, na skutek wywieranego nań ciśnienia przez ostrze łyżwy jest tak niewielki?
Jak wytłumaczyć swobodne przesuwanie się ostrza łyżwy po powierzchni lodu? Daleko jeszcze do pełnego wyjaśnienia tego, jak by się wydawało, oczywistego zjawiska. Dla jego wytłumaczenia można częściowo posłużyć się efektem "topnienia powierzchniowego". Stabilność ciał stałych wynika z ich regularnej struktury, dzięki której każda cząsteczka, która tworzy to ciało stałe przeciąga i jest przyciągana przez wiele otaczających ją sąsiednich cząsteczek. Na powierzchni ciała stałego cząsteczki oddziałują tylko z cząsteczkami znajdującymi się poniżej oraz z sąsiednim cząsteczkami na powierzchni, ponieważ nie ma żadnych cząsteczek (tego samego rodzaju) "nad" cząsteczkami ulokowanymi na powierzchni. W rezultacie, w przypadku cząsteczek na powierzchni często ich ułożenie jest zaburzone ("wyłamują się" z porządku panującego w całym ciele stałym) aby zwiększyć oddziaływania między sobą w ich mało korzystnej pozycji. Mówimy wtedy o "rekonstrukcji" powierzchni. Zostało również stwierdzone, że nieuporządkowanie pozycji cząsteczek, które tworzą powierzchnię ciała stałego powoduje iż właściwości tej warstwy są zbliżone do właściwości cieczy, nawet jeśli temperatura tej powierzchni jest dużo poniżej temperatury topnienia danego ciała stałego. To zjawisko nazywamy właśnie "topnieniem powierzchniowym". Jeśli dodatkowo cząsteczki o takim zaburzonym ułożeniu lub nieuporządkowane na powierzchni zetkną się z inną powierzchnią (metalu ostrza łyżwy), będą one na siebie wzajemnie oddziaływać. Kolejnym ważnym efektem jest tarcie, które jest źródłem ciepła wystarczającego na stopienie cienkiej warstwy na powierzchni lodu, z którą ostrze łyżwy ma bezpośredni kontakt.
Roztwór związku jonowego nie wygląda w ten sposób!
Powszechnie wiadomo, że dodanie soli do wody powoduje nieznaczny wzrost temperatury wrzenia wody. To zjawisko można łatwo zademonstrować umieszczając szklankę wypełnioną czystą wodą w większym naczyniu zawierającym osoloną wodę. Podczas powolnego ogrzewania tego naczynia można zauważyć, że czysta woda w szklance zacznie najpierw wrzeć, w drugiej zaś kolejności będziemy obserwować wrzenie wody, do której została dodana sól. W podręcznikach zawierających podstawy chemii tłumaczy się, iż wzrost temperatury wrzenia jest proporcjonalny do ułamka cząsteczek substancji rozpuszczonej w danym roztworze. Jako temperaturę wrzenia przyjmuje się tutaj temperaturę, w której równowagowe ciśnienie par roztworu jest równe ciśnieniu zewnętrznemu (przyrównanemu zazwyczaj do ciśnienia atmosfery nad powierzchnią danej cieczy). Należy pamiętać, że wrzenie (unoszenie się w cieczy szybko narastających pęcherzyków) nie jest zjawiskiem równowagowym i zaczyna się nawet w wyższej temperaturze. Wiele podręczników tłumaczy ten efekt posługując się schematycznym rysunkiem podobnym do zamieszczonego poniżej:
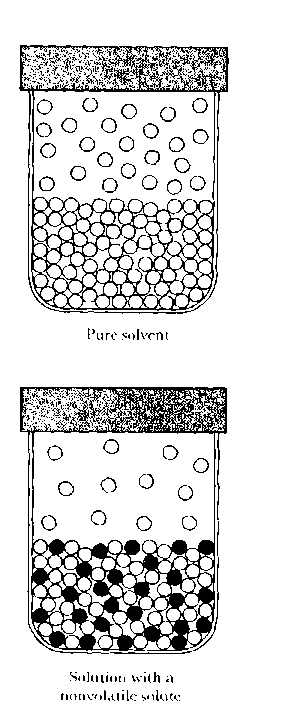 Rysunek często zamieszczany w podręcznikach. U góry zlewka z czystym rozpuszczalnikiem. Poniżej roztwór substancji nielotnej.
Rysunek często zamieszczany w podręcznikach. U góry zlewka z czystym rozpuszczalnikiem. Poniżej roztwór substancji nielotnej.
Powyższy rysunek ma stanowić następujące wyjaśnienie opisywanego zjawiska: prężność par czystego rozpuszczalnika w danej temperaturze zależy od równowagowej prężności par roztworu. Nielotne cząsteczki substancji rozpuszczonej mają częściowo blokować możliwość "ucieczki" cząsteczek rozpuszczalnika z powierzchni roztworu. Aby nastąpiło wrzenie roztworu, temperatura powinna być podniesiona o tyle, aby ciśnienie par roztworu (rozpuszczalnika) zrównało się z ciśnieniem zewnętrznym, które wypiera nacisk na powierzchnię roztworu.
Pomimo, że przedstawione powyżej rozumowanie wydaje się być rozsądne, daje ono bardzo zły obraz na temat własności roztworów. Sole jonowe, np. NaCl, tylko dlatego są rozpuszczalne w wodzie, ponieważ energia solwatacji (hydratacji) ich jonów jest prawie tak duża jak ogromna siła kulombowskiego przyciągania pomiędzy dodatnimi i ujemnymi jonami w sieci krystalicznej. Z powodu tak silnej solwatacji jony Na(+) czy Cl(-) nigdy nie będą chciały zająć miejsca przy powierzchni roztworu, ponieważ przy powierzchni jony te nie będą w pełni otoczone cząsteczkami rozpuszczalnika ze wszystkich stron. Nawet w przypadku bardziej stężonych roztworów soli powierzchnia jest czystą wodą (rozpuszczalnikiem).
Innym wnioskiem jaki daje powyższy rysunek jest złudzenie iż wielkość obniżenia ciśnienia par powinna zależeć od wielkości cząsteczek substancji rozpuszczonej względem wielkości cząsteczek rozpuszczalnika. Tego nie potwierdzają wyniki doświadczeń. Korzystając z metod termodynamiki chemicznej nawet na poziomie podręcznika chemii fizycznej można wykazać, że dla wystarczająco rozcieńczonych roztworów wielkość obniżenia prężności par zależy tylko od stosunku ilości cząsteczek substancji rozpuszczonej do ilości cząsteczek rozpuszczalnika, nie zaś od właściwości cząsteczek substancji rozpuszczonej.
Kolejnym mylnie przyjętym poglądem jest wytłumaczenie iż dodanie soli do gotujących się potraw podnosi ich temperaturę wrzenia. Twierdzi się iż dodatek soli powoduje podwyższenie temperatury wrzenia wody, a to ma w efekcie skracać ich czas potrzebny na ugotowanie. Niewątpliwie prawdą jest, że niewielkie podwyższenie temperatury gotowania może znacząco przyspieszyć szybkość gotowania: czas gotowania potrzebny na ugotowanie powinien być ok. 2 razy krótszy jeśli podwyższy się temperaturę wrzenia wody o 10-20 C. Jednakże nawet jeśli woda do gotowania będzie tak słona jak woda morska (co wymaga dodania 4 łyżek stołowych soli na litr wody!), jej temperatura wrzenia z tego powodu wzrośnie jedynie o 0,6 C, co może pozwolić na skrócenie czasu gotowania jedynie o parę procent. Jeśli uważasz, że warto skrócić czas gotowania nawet o te kilka procent, powinieneś zdawać sobie sprawę, że spowoduje to wzrost ciśnienia krwi na skutek spożycia tak dużej ilości jonów sodowych!
Autor:
prof. Kevin Lehmann
Tłumaczenie:
Nikodem Kuźnik
Źródło:
http://www.republika.pl/nkuznik/
Chcesz o tym porozmawiać na FORUM?
https://laboratoria.net/edukacja/3269.html


